- Beiträge: 1751
Sidebar
Restoring Roots, Entstehung von PH, Forschungsprojekt
21 Okt 2025 12:45 #2409
von danny
OMNIA TEMPUS HABENT
Diagnose IPAH im Februar 2013, in Behandlung bei OA Dr. Ulrich Krüger, jetzt Dr. Fischer Herzzentrum Duisburg, Medikamente: Sildenafil, Bosentan jetzt Macitentan, Subkutane Treprostinilpumpe, seit Januar 2024 getunnelter ZVK mit externer Pumpe (Groshongkatheter), 24/7 Sauerstoff, Marcumar, Diuretika
Restoring Roots, Entstehung von PH, Forschungsprojekt wurde erstellt von danny
www.innovationnewsnetwork.com/restoring-...sion/61582/Professor Soni Savai Pullamsetti vom Projekt „Restoring Roots“ betont, wie wichtig es ist, sich mit der pulmonalen Hypertonie zu befassen, und beschreibt, wie das Projekt dazu beitragen wird.Pulmonale Hypertonie ist eine zunehmend anerkannte, ernste Erkrankung, die Millionen von Menschen weltweit betrifft und nicht nur für die Patienten, sondern auch für die Gesundheitssysteme eine Herausforderung darstellt. Ein besseres Verständnis der zugrunde liegenden Mechanismen kann den Weg für innovative Therapiestrategien ebnen, und das Projekt „Restoring Roots“ steht an vorderster Front dieser Bemühungen.Unter der Leitung des engagierten Teams des
Pullamsetti-Labors
der Justus-Liebig-Universität untersucht das Projekt
„Restoring Roots“
die Zusammenhänge zwischen epigenetischen Faktoren und transkriptioneller Regulation bei der Entstehung von pulmonaler Hypertonie. Um mehr über die Erkrankung und die Lösungsansätze des Projekts zu erfahren, sprach The Innovation Platform mit Professor Soni Savai Pullamsetti.Für diejenigen, die damit nicht vertraut sind: Was ist pulmonale Hypertonie und welche Auswirkungen hat sie auf Menschen, die mit dieser Krankheit leben?Pulmonale Hypertonie ist eine Erkrankung, die sowohl das Herz als auch die Lunge betrifft. Zunächst werden die Blutgefäße in der Lunge geschädigt; sie verändern sich, wodurch sie sich versteifen und verengen. Die Versteifung entsteht durch Zellproliferation, die zu einer Gefäßverengung führt (Remodelling). Dies führt zu einer erhöhten Belastung der rechten Herzkammer, was letztendlich zu Herzversagen führen kann.Patienten mit pulmonaler Hypertonie fühlen sich typischerweise sehr erschöpft und leiden häufig unter Dyspnoe oder Kurzatmigkeit, was selbst einfache Aufgaben unglaublich schwierig macht. Leider ist die Fünfjahresüberlebensrate bei pulmonaler Hypertonie immer noch recht niedrig, und trotz einiger Fortschritte bleibt der größte Engpass bei der Verbesserung der Lebensqualität dieser Patienten.
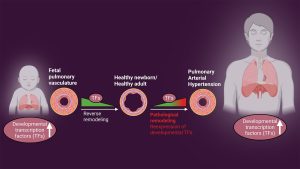 Schematische Darstellung der Reaktivierung pulmonaler Entwicklungspfade, die die pulmonale arterielle Hypertonie verursachen. Abbildungsunterstützung: Pullamsetti-
Schematische Darstellung der Reaktivierung pulmonaler Entwicklungspfade, die die pulmonale arterielle Hypertonie verursachen. Abbildungsunterstützung: Pullamsetti-
Labor (Priyasha De)Galt die Krankheit einst als selten, tritt sie heute weltweit auf. Die Ursachen variieren je nach Region: In Indien entwickeln viele Kinder aufgrund angeborener Herzfehler eine pulmonale Hypertonie. In Afrika scheinen Erkrankungen wie Bilharziose ein beitragender Faktor zu sein, und in Ländern wie China erhöht die Höhenlage die Anfälligkeit. Diese verschiedenen Formen der pulmonalen Hypertonie lassen darauf schließen, dass weltweit bis zu 100 Millionen Menschen betroffen sind.Es stehen zwar Medikamente zur Verfügung, diese sind jedoch speziell für die pulmonale arterielle Hypertonie entwickelt worden, die nur eine Untergruppe der pulmonalen Hypertonie darstellt. Andere Formen der Erkrankung können verschiedene Ursachen haben – beispielsweise eine Linksherzerkrankung, chronische Lungenerkrankungen wie COPD oder Lungenfibrose oder auch nicht aufgelöste Blutgerinnsel. Leider sind die Behandlungsmöglichkeiten für diese Patienten nach wie vor sehr begrenzt. Das bedeutet, dass zwar einige Menschen von gezielten Therapien profitieren, die Mehrheit der Patienten mit pulmonaler Hypertonie jedoch weiterhin einen erheblichen ungedeckten medizinischen Bedarf hat, insbesondere diejenigen, deren Erkrankung mit einer zugrunde liegenden Herz- oder Lungenerkrankung zusammenhängt.Ihr Projekt untersucht, wie sich beschädigte Blutgefäße wieder so verhalten wie in der frühen Entwicklung. Wie sind Sie auf diese Idee gekommen und warum ist es so wichtig, diesen Forschungsansatz zu verfolgen?Unser Labor untersucht, wie Transkriptionsfaktoren und epigenetische Mechanismen pulmonale Hypertonie und andere chronische Lungenerkrankungen verursachen. Lungenerkrankungen lassen sich nicht allein durch die Genetik erklären – Umwelteinflüsse und die Dauer der Exposition spielen durch epigenetische Veränderungen eine wichtige Rolle.Bei der Analyse des Epigenoms und Transkriptoms fanden wir etwas Erstaunliches: Etwa 35 Prozent der regulierten Gene waren mit Entwicklungsprogrammen und Entwicklungstranskriptionsfaktoren verknüpft. Diese Transkriptionsfaktoren sollten nach der Geburt normalerweise inaktiv sein, doch wir beobachteten ihre Reaktivierung. Das warf die große Frage auf: Handelt es sich bei dieser Reaktivierung um eine Schutzreaktion oder trägt sie zur Krankheit bei?Das brachte uns auf die Idee: Vielleicht können wir von der Natur lernen. Blutgefäße wachsen und passen sich in der frühen Entwicklung bemerkenswert gut an. Werden diese Entwicklungspfade später im Leben reaktiviert, können sie den Gefäßumbau vorantreiben. Wenn wir sie jedoch besser verstehen, können wir sie möglicherweise auf umgekehrten Umbau und Regeneration umprogrammieren. Indem wir die zugrunde liegenden epigenetischen Mechanismen identifizieren, wollen wir sie modulieren – nicht nur, um das Fortschreiten der Krankheit zu stoppen, sondern auch, um eine gesunde Gefäßarchitektur wiederherzustellen.Ein weiterer wichtiger Aspekt ist der Zeitpunkt. Die Wirksamkeit einer Intervention kann je nach Zeitpunkt im Leben variieren. Deshalb wollen wir diese Veränderungen in verschiedenen Stadien verstehen und die Therapien entsprechend anpassen. Klinisch werden die meisten Patienten heute mithilfe bildgebender Verfahren oder invasiver Verfahren in ihr Stadium eingeteilt. Unser Ziel ist es, noch weiter zu gehen – durch die Integration von Omics in die Praxis können wir Patienten präzise phänotypisieren und einer wirklich personalisierten Medizin näher kommen.„Restoring Roots“ nutzt leistungsstarke Labortechniken und Modellsysteme. Können Sie uns etwas über die Expertise Ihres Teams und die Art der Arbeit erzählen, für die Ihr Labor am bekanntesten ist?Das Projekt „Restoring Roots“ basiert auf leistungsstarken Labortechniken und Modellsystemen und konzentriert sich dabei auf die Lungen- und Gefäßepigenetik. Im Rahmen des Projekts „Restoring Roots“ konzentrierten wir uns auf zwei Hauptaspekte. Zunächst führten wir umfangreiche Omics-Analysen durch, darunter Next-Generation-Sequencing, CRISPR-Cas9-basierte Genomeditierung, epigenetisches Profiling und mehrschichtige epigenetische Analysen.Der zweite Aspekt zielt darauf ab, Krankheiten sowohl für Forschungs- als auch für Therapiezwecke zu verstehen und Modelle zu entwickeln, die In-vivo-Studien verbessern oder diese in Zukunft sogar ergänzen oder ersetzen können.Ein wichtiges Modell, das wir entwickelt haben, sind lebende Lungenschnitte. Dabei werden transplantierte Lungen von Patienten entnommen, in dicke Scheiben geschnitten und bis zu 14 Tage lang kultiviert. Wir können alle paar Tage spezifische Behandlungen verabreichen, um die Reaktion zu beobachten. Das ist besonders wertvoll, da diese transplantierten Lungen von Patienten stammen, die auf bestehende Therapien nicht angesprochen haben. Mithilfe dieses Modells können wir beurteilen, ob neue Medikamente oder andere molekulare Interventionen wirksam sind.
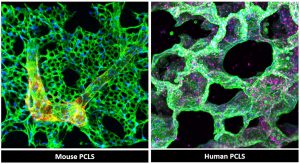 Konfokale Mikroskopie und 3D-Rekonstruktion von lebenden Präzisionslungenschnitten
Konfokale Mikroskopie und 3D-Rekonstruktion von lebenden Präzisionslungenschnitten
(PCLS) von Mensch und Maus, fixiert und gefärbt für Alveolar- und Gefäßnetzwerke. Bildunterstützung: Pullamsetti-Labor (Anoop
Vadakan Cherian)Unser Labor arbeitet außerdem an der Entwicklung vaskulärer Organoidmodelle. Diese vaskularisierten Lungenorganoide, die aus induzierten pluripotenten Stammzellen gewonnen werden, fungieren als Miniorgane in der Schale und können für die Erforschung der Gefäßregeneration und des Gefäßwachstums eingesetzt werden.Zwei weitere Techniken, die wir in diesem Bereich einbringen, sind die Wiederherstellung relevanter biologischer Pfade und die Entwicklung transgener Mausmodelle mit spezifischen Mutationen, beispielsweise im Tbx4-Gen. Diese mutierten Mausmodelle ahmen die bei menschlichen Patienten, insbesondere bei Kindern mit Tbx4-Mutationen, beobachteten Phänotypen genau nach. Durch diesen Ansatz können wir die Merkmale dieser Patienten besser verstehen und ihren Zustand im Labor nachbilden. Dies bietet wertvolle Erkenntnisse, die über traditionelle In-vitro- oder In-vivo-Studien hinausgehen und es uns ermöglichen, unsere Erkenntnisse vom Labor auf die Praxis zu übertragen.Hat das Projekt bisher unerwartete Erkenntnisse zutage gefördert oder die Tür zu neuen Forschungsrichtungen geöffnet, die Sie zunächst nicht erwartet hatten?In der Tat. Eine unserer überraschendsten Entdeckungen war, dass Entwicklungstranskriptionsfaktoren – Gene, die normalerweise nur in der frühen Lebensphase aktiv sind – je nach Zeitpunkt sehr unterschiedliche Rollen spielen. In der postnatalen Phase können sie zu unzureichendem Blutgefäßwachstum führen, während ihre Reaktivierung im Erwachsenenalter zu einem schädlichen Gefäßumbau führt. Dies verlagerte unseren Fokus von der bloßen Untersuchung des Umbaus hin zur Erforschung der Regeneration durch Neuprogrammierung dieser Entwicklungswege.Wir haben diese Ergebnisse in Science Translational Medicine veröffentlicht und dort auch gezeigt, dass epigenetische Therapien – Medikamente, die das An- und Abschalten von Genen beeinflussen, ohne die DNA selbst zu verändern – diese Faktoren potenziell angreifen könnten. Die Herausforderung besteht nun darin, diese Therapien in die klinische Erprobung zu bringen und gleichzeitig sicherzustellen, dass sie die richtigen Lungenzellen sicher und effektiv erreichen.Zu diesem Zweck arbeiten wir an Ansätzen zur präzisen Reprogrammierung. Beispielsweise verfügen wir über vielversprechende Daten zur Verwendung der CRISPR-Cas9-Geneditierung zur Steuerung der Genexpression durch Enhancer – DNA-Abschnitte, die die Funktion von Genen regulieren. Durch die Identifizierung lungenspezifischer Enhancer hoffen wir, die Lunge, ihre Blutgefäße und sogar bestimmte krankheitsverursachende Zelltypen deutlich präziser ansprechen zu können.Über neue Therapien hinaus öffnet dieses Projekt auch die Tür zu breiteren Anwendungen von „Omics“-Technologien – groß angelegten Analysen von Genen und molekularen Profilen. Pulmonale Hypertonie beginnt in der Lunge, führt aber häufig zu Rechtsherzversagen, der Haupttodesursache der Patienten. Durch die Anwendung von Omics zur Untersuchung der rechten Herzkammer können wir wertvolle Datensätze mit der Weltgemeinschaft teilen und den Krankheitsverlauf besser verstehen. Dieser Ansatz revolutioniert bereits die Krebsbehandlung durch Theragnostik – die Kombination von Diagnostik und zielgerichteten Therapien, um die Behandlung auf das molekulare Profil jedes Patienten und nicht nur auf den Tumortyp abzustimmen. Gemeinsam mit Professor Ardeschir Ghofrani sehen wir dasselbe Potenzial für Lungenerkrankungen: Wir wollen herausfinden, welche Patienten auf die Therapie ansprechen, und die Behandlungen gezielter auf sie zuschneiden.Schließlich regen uns unsere Erkenntnisse dazu an, auch Umweltfaktoren zu untersuchen. Nano- und Mikroplastik beispielsweise können sich im Körper anreichern und Schadstoffe wie Rauch in der Lunge einschließen. Dadurch entsteht eine Art „Gedächtnis“ in den Zellen, das die Genregulation nachhaltig beeinflussen und so zu chronischen Erkrankungen im späteren Leben beitragen kann. Das Verständnis dieser umwelt-epigenetischen Wechselwirkungen eröffnet uns spannende neue Wege.Sie sind an zwei großen Forschungsstandorten tätig – Gießen und dem Max-Planck-Institut. Wie beeinflussen diese Umgebungen Ihre Arbeit und wie binden Sie diese in größere wissenschaftliche Netzwerke ein?Die räumliche Nähe zu Gießen und dem Max-Planck-Institut verschafft unserer Arbeit einen einzigartigen Vorteil. Am Max-Planck-Institut für Herz- und Lungenforschung haben wir Zugang zu modernsten Technologien, insbesondere für Omics und epigenetische Analysen. An der Justus-Liebig-Universität in Gießen sind wir näher an der Klinik und haben direkten Zugang zu Patienten, auch zu Patienten mit spezifischen Mutationen. Diese Verbindung ermöglicht es uns, Patientenproben zu entnehmen und in Echtzeit zu beobachten, wie sich die Genexpression in isolierten Zellen verändert.
 © shutterstock/HodoimgÜber diese beiden Zentren hinaus sind wir eng in umfassendere Netzwerke eingebunden. Unser Labor arbeitet international mit Kollegen in den USA, Europa, Kanada und Indien zusammen und lokal über das Institute for Lung Health (ILH), das Deutsche Zentrum für Lungenforschung (DZL) und das Cardio-Pulmonary Institute (CPI). Diese Netzwerke bieten nicht nur fortschrittliche Werkzeuge und Fachwissen, sondern auch einen Ideenaustausch mit herausragenden Forschern.Vor Kurzem wurde ich Ehrenmitglied der Nationalen Akademie der Wissenschaften Leopoldina. Dadurch wurde mir eine Plattform eröffnet, um in Bereichen wie Gentechnik und Präzisionsmedizin zur Politikgestaltung beizutragen und unsere Forschung noch stärker mit den Patienten zu verbinden – was letztlich das Ziel ist.Wie geht es mit der Unterstützung des Europäischen Forschungsrats weiter? Möchten Sie neue Partnerschaften aufbauen oder diese Arbeit in zukünftigen Ausschreibungen oder Konsortien ausbauen?Der Europäische Forschungsrat ist einzigartig, da er Projekte mit hohem Risiko und hohem Nutzen fördert – und genau hier kommt unsere Arbeit ins Spiel. Mit dieser Unterstützung bewerben wir uns nun um Proof-of-Concept-Förderungen, um grundlegende Erkenntnisse zu Krankheitsmechanismen mit patientenorientierten klinischen Anwendungen zu verbinden.Eine spannende Zusammenarbeit besteht mit
Tbx4 Life
, einer Organisation, die von einem Vater gegründet wurde, dessen Kind aufgrund von Tbx4-Mutationen an pulmonaler Hypertonie leidet. Gemeinsam wollen wir gezielte Therapien entwickeln, Nachweismethoden verbessern und unser Verständnis der zugrunde liegenden Biologie vertiefen.Mit Blick auf die Zukunft verlagert sich unser Fokus auf die Lungenremodellierung und -regeneration. Im Rahmen von Horizont Europa erarbeiten wir Vorschläge zur entwicklungsbezogenen Reprogrammierung und Lungenregeneration. Diese Bemühungen vernetzen uns mit globalen Experten in den USA, Europa, Kanada und der Biotechnologiebranche, insbesondere der Biomedizintechnik. So haben wir (das Institute for Lung Health) beispielsweise eine Partnerschaft mit dem Indian Institute of Technology in Hyderabad geschlossen, um ein spezialisiertes Labor aufzubauen, das komplexe Lungenerkrankungen wie Steifheit, Durchblutung und Sauerstoffsättigung nachbilden kann, um Erkrankungen besser zu modellieren. Diese Initiative wird gemeinsam mit Professor Werner Seeger, Professor Rajkumar Savai und mir geleitet.Gleichzeitig starten wir klinische Studien zu epigenetischen Therapien in der Frühphase. Ein Schwerpunkt liegt dabei auf der Präzisionsmedizin mit maßgeschneiderten Strategien für bestimmte Organe und krankheitsverursachende Zelltypen. Unser Ziel ist es, diese Erkenntnisse in Therapien umzusetzen, die den Patienten direkt zugutekommen, insbesondere dort, wo der medizinische Bedarf am größten ist.
© shutterstock/HodoimgÜber diese beiden Zentren hinaus sind wir eng in umfassendere Netzwerke eingebunden. Unser Labor arbeitet international mit Kollegen in den USA, Europa, Kanada und Indien zusammen und lokal über das Institute for Lung Health (ILH), das Deutsche Zentrum für Lungenforschung (DZL) und das Cardio-Pulmonary Institute (CPI). Diese Netzwerke bieten nicht nur fortschrittliche Werkzeuge und Fachwissen, sondern auch einen Ideenaustausch mit herausragenden Forschern.Vor Kurzem wurde ich Ehrenmitglied der Nationalen Akademie der Wissenschaften Leopoldina. Dadurch wurde mir eine Plattform eröffnet, um in Bereichen wie Gentechnik und Präzisionsmedizin zur Politikgestaltung beizutragen und unsere Forschung noch stärker mit den Patienten zu verbinden – was letztlich das Ziel ist.Wie geht es mit der Unterstützung des Europäischen Forschungsrats weiter? Möchten Sie neue Partnerschaften aufbauen oder diese Arbeit in zukünftigen Ausschreibungen oder Konsortien ausbauen?Der Europäische Forschungsrat ist einzigartig, da er Projekte mit hohem Risiko und hohem Nutzen fördert – und genau hier kommt unsere Arbeit ins Spiel. Mit dieser Unterstützung bewerben wir uns nun um Proof-of-Concept-Förderungen, um grundlegende Erkenntnisse zu Krankheitsmechanismen mit patientenorientierten klinischen Anwendungen zu verbinden.Eine spannende Zusammenarbeit besteht mit
Tbx4 Life
, einer Organisation, die von einem Vater gegründet wurde, dessen Kind aufgrund von Tbx4-Mutationen an pulmonaler Hypertonie leidet. Gemeinsam wollen wir gezielte Therapien entwickeln, Nachweismethoden verbessern und unser Verständnis der zugrunde liegenden Biologie vertiefen.Mit Blick auf die Zukunft verlagert sich unser Fokus auf die Lungenremodellierung und -regeneration. Im Rahmen von Horizont Europa erarbeiten wir Vorschläge zur entwicklungsbezogenen Reprogrammierung und Lungenregeneration. Diese Bemühungen vernetzen uns mit globalen Experten in den USA, Europa, Kanada und der Biotechnologiebranche, insbesondere der Biomedizintechnik. So haben wir (das Institute for Lung Health) beispielsweise eine Partnerschaft mit dem Indian Institute of Technology in Hyderabad geschlossen, um ein spezialisiertes Labor aufzubauen, das komplexe Lungenerkrankungen wie Steifheit, Durchblutung und Sauerstoffsättigung nachbilden kann, um Erkrankungen besser zu modellieren. Diese Initiative wird gemeinsam mit Professor Werner Seeger, Professor Rajkumar Savai und mir geleitet.Gleichzeitig starten wir klinische Studien zu epigenetischen Therapien in der Frühphase. Ein Schwerpunkt liegt dabei auf der Präzisionsmedizin mit maßgeschneiderten Strategien für bestimmte Organe und krankheitsverursachende Zelltypen. Unser Ziel ist es, diese Erkenntnisse in Therapien umzusetzen, die den Patienten direkt zugutekommen, insbesondere dort, wo der medizinische Bedarf am größten ist.

Labor (Priyasha De)Galt die Krankheit einst als selten, tritt sie heute weltweit auf. Die Ursachen variieren je nach Region: In Indien entwickeln viele Kinder aufgrund angeborener Herzfehler eine pulmonale Hypertonie. In Afrika scheinen Erkrankungen wie Bilharziose ein beitragender Faktor zu sein, und in Ländern wie China erhöht die Höhenlage die Anfälligkeit. Diese verschiedenen Formen der pulmonalen Hypertonie lassen darauf schließen, dass weltweit bis zu 100 Millionen Menschen betroffen sind.Es stehen zwar Medikamente zur Verfügung, diese sind jedoch speziell für die pulmonale arterielle Hypertonie entwickelt worden, die nur eine Untergruppe der pulmonalen Hypertonie darstellt. Andere Formen der Erkrankung können verschiedene Ursachen haben – beispielsweise eine Linksherzerkrankung, chronische Lungenerkrankungen wie COPD oder Lungenfibrose oder auch nicht aufgelöste Blutgerinnsel. Leider sind die Behandlungsmöglichkeiten für diese Patienten nach wie vor sehr begrenzt. Das bedeutet, dass zwar einige Menschen von gezielten Therapien profitieren, die Mehrheit der Patienten mit pulmonaler Hypertonie jedoch weiterhin einen erheblichen ungedeckten medizinischen Bedarf hat, insbesondere diejenigen, deren Erkrankung mit einer zugrunde liegenden Herz- oder Lungenerkrankung zusammenhängt.Ihr Projekt untersucht, wie sich beschädigte Blutgefäße wieder so verhalten wie in der frühen Entwicklung. Wie sind Sie auf diese Idee gekommen und warum ist es so wichtig, diesen Forschungsansatz zu verfolgen?Unser Labor untersucht, wie Transkriptionsfaktoren und epigenetische Mechanismen pulmonale Hypertonie und andere chronische Lungenerkrankungen verursachen. Lungenerkrankungen lassen sich nicht allein durch die Genetik erklären – Umwelteinflüsse und die Dauer der Exposition spielen durch epigenetische Veränderungen eine wichtige Rolle.Bei der Analyse des Epigenoms und Transkriptoms fanden wir etwas Erstaunliches: Etwa 35 Prozent der regulierten Gene waren mit Entwicklungsprogrammen und Entwicklungstranskriptionsfaktoren verknüpft. Diese Transkriptionsfaktoren sollten nach der Geburt normalerweise inaktiv sein, doch wir beobachteten ihre Reaktivierung. Das warf die große Frage auf: Handelt es sich bei dieser Reaktivierung um eine Schutzreaktion oder trägt sie zur Krankheit bei?Das brachte uns auf die Idee: Vielleicht können wir von der Natur lernen. Blutgefäße wachsen und passen sich in der frühen Entwicklung bemerkenswert gut an. Werden diese Entwicklungspfade später im Leben reaktiviert, können sie den Gefäßumbau vorantreiben. Wenn wir sie jedoch besser verstehen, können wir sie möglicherweise auf umgekehrten Umbau und Regeneration umprogrammieren. Indem wir die zugrunde liegenden epigenetischen Mechanismen identifizieren, wollen wir sie modulieren – nicht nur, um das Fortschreiten der Krankheit zu stoppen, sondern auch, um eine gesunde Gefäßarchitektur wiederherzustellen.Ein weiterer wichtiger Aspekt ist der Zeitpunkt. Die Wirksamkeit einer Intervention kann je nach Zeitpunkt im Leben variieren. Deshalb wollen wir diese Veränderungen in verschiedenen Stadien verstehen und die Therapien entsprechend anpassen. Klinisch werden die meisten Patienten heute mithilfe bildgebender Verfahren oder invasiver Verfahren in ihr Stadium eingeteilt. Unser Ziel ist es, noch weiter zu gehen – durch die Integration von Omics in die Praxis können wir Patienten präzise phänotypisieren und einer wirklich personalisierten Medizin näher kommen.„Restoring Roots“ nutzt leistungsstarke Labortechniken und Modellsysteme. Können Sie uns etwas über die Expertise Ihres Teams und die Art der Arbeit erzählen, für die Ihr Labor am bekanntesten ist?Das Projekt „Restoring Roots“ basiert auf leistungsstarken Labortechniken und Modellsystemen und konzentriert sich dabei auf die Lungen- und Gefäßepigenetik. Im Rahmen des Projekts „Restoring Roots“ konzentrierten wir uns auf zwei Hauptaspekte. Zunächst führten wir umfangreiche Omics-Analysen durch, darunter Next-Generation-Sequencing, CRISPR-Cas9-basierte Genomeditierung, epigenetisches Profiling und mehrschichtige epigenetische Analysen.Der zweite Aspekt zielt darauf ab, Krankheiten sowohl für Forschungs- als auch für Therapiezwecke zu verstehen und Modelle zu entwickeln, die In-vivo-Studien verbessern oder diese in Zukunft sogar ergänzen oder ersetzen können.Ein wichtiges Modell, das wir entwickelt haben, sind lebende Lungenschnitte. Dabei werden transplantierte Lungen von Patienten entnommen, in dicke Scheiben geschnitten und bis zu 14 Tage lang kultiviert. Wir können alle paar Tage spezifische Behandlungen verabreichen, um die Reaktion zu beobachten. Das ist besonders wertvoll, da diese transplantierten Lungen von Patienten stammen, die auf bestehende Therapien nicht angesprochen haben. Mithilfe dieses Modells können wir beurteilen, ob neue Medikamente oder andere molekulare Interventionen wirksam sind.

(PCLS) von Mensch und Maus, fixiert und gefärbt für Alveolar- und Gefäßnetzwerke. Bildunterstützung: Pullamsetti-Labor (Anoop
Vadakan Cherian)Unser Labor arbeitet außerdem an der Entwicklung vaskulärer Organoidmodelle. Diese vaskularisierten Lungenorganoide, die aus induzierten pluripotenten Stammzellen gewonnen werden, fungieren als Miniorgane in der Schale und können für die Erforschung der Gefäßregeneration und des Gefäßwachstums eingesetzt werden.Zwei weitere Techniken, die wir in diesem Bereich einbringen, sind die Wiederherstellung relevanter biologischer Pfade und die Entwicklung transgener Mausmodelle mit spezifischen Mutationen, beispielsweise im Tbx4-Gen. Diese mutierten Mausmodelle ahmen die bei menschlichen Patienten, insbesondere bei Kindern mit Tbx4-Mutationen, beobachteten Phänotypen genau nach. Durch diesen Ansatz können wir die Merkmale dieser Patienten besser verstehen und ihren Zustand im Labor nachbilden. Dies bietet wertvolle Erkenntnisse, die über traditionelle In-vitro- oder In-vivo-Studien hinausgehen und es uns ermöglichen, unsere Erkenntnisse vom Labor auf die Praxis zu übertragen.Hat das Projekt bisher unerwartete Erkenntnisse zutage gefördert oder die Tür zu neuen Forschungsrichtungen geöffnet, die Sie zunächst nicht erwartet hatten?In der Tat. Eine unserer überraschendsten Entdeckungen war, dass Entwicklungstranskriptionsfaktoren – Gene, die normalerweise nur in der frühen Lebensphase aktiv sind – je nach Zeitpunkt sehr unterschiedliche Rollen spielen. In der postnatalen Phase können sie zu unzureichendem Blutgefäßwachstum führen, während ihre Reaktivierung im Erwachsenenalter zu einem schädlichen Gefäßumbau führt. Dies verlagerte unseren Fokus von der bloßen Untersuchung des Umbaus hin zur Erforschung der Regeneration durch Neuprogrammierung dieser Entwicklungswege.Wir haben diese Ergebnisse in Science Translational Medicine veröffentlicht und dort auch gezeigt, dass epigenetische Therapien – Medikamente, die das An- und Abschalten von Genen beeinflussen, ohne die DNA selbst zu verändern – diese Faktoren potenziell angreifen könnten. Die Herausforderung besteht nun darin, diese Therapien in die klinische Erprobung zu bringen und gleichzeitig sicherzustellen, dass sie die richtigen Lungenzellen sicher und effektiv erreichen.Zu diesem Zweck arbeiten wir an Ansätzen zur präzisen Reprogrammierung. Beispielsweise verfügen wir über vielversprechende Daten zur Verwendung der CRISPR-Cas9-Geneditierung zur Steuerung der Genexpression durch Enhancer – DNA-Abschnitte, die die Funktion von Genen regulieren. Durch die Identifizierung lungenspezifischer Enhancer hoffen wir, die Lunge, ihre Blutgefäße und sogar bestimmte krankheitsverursachende Zelltypen deutlich präziser ansprechen zu können.Über neue Therapien hinaus öffnet dieses Projekt auch die Tür zu breiteren Anwendungen von „Omics“-Technologien – groß angelegten Analysen von Genen und molekularen Profilen. Pulmonale Hypertonie beginnt in der Lunge, führt aber häufig zu Rechtsherzversagen, der Haupttodesursache der Patienten. Durch die Anwendung von Omics zur Untersuchung der rechten Herzkammer können wir wertvolle Datensätze mit der Weltgemeinschaft teilen und den Krankheitsverlauf besser verstehen. Dieser Ansatz revolutioniert bereits die Krebsbehandlung durch Theragnostik – die Kombination von Diagnostik und zielgerichteten Therapien, um die Behandlung auf das molekulare Profil jedes Patienten und nicht nur auf den Tumortyp abzustimmen. Gemeinsam mit Professor Ardeschir Ghofrani sehen wir dasselbe Potenzial für Lungenerkrankungen: Wir wollen herausfinden, welche Patienten auf die Therapie ansprechen, und die Behandlungen gezielter auf sie zuschneiden.Schließlich regen uns unsere Erkenntnisse dazu an, auch Umweltfaktoren zu untersuchen. Nano- und Mikroplastik beispielsweise können sich im Körper anreichern und Schadstoffe wie Rauch in der Lunge einschließen. Dadurch entsteht eine Art „Gedächtnis“ in den Zellen, das die Genregulation nachhaltig beeinflussen und so zu chronischen Erkrankungen im späteren Leben beitragen kann. Das Verständnis dieser umwelt-epigenetischen Wechselwirkungen eröffnet uns spannende neue Wege.Sie sind an zwei großen Forschungsstandorten tätig – Gießen und dem Max-Planck-Institut. Wie beeinflussen diese Umgebungen Ihre Arbeit und wie binden Sie diese in größere wissenschaftliche Netzwerke ein?Die räumliche Nähe zu Gießen und dem Max-Planck-Institut verschafft unserer Arbeit einen einzigartigen Vorteil. Am Max-Planck-Institut für Herz- und Lungenforschung haben wir Zugang zu modernsten Technologien, insbesondere für Omics und epigenetische Analysen. An der Justus-Liebig-Universität in Gießen sind wir näher an der Klinik und haben direkten Zugang zu Patienten, auch zu Patienten mit spezifischen Mutationen. Diese Verbindung ermöglicht es uns, Patientenproben zu entnehmen und in Echtzeit zu beobachten, wie sich die Genexpression in isolierten Zellen verändert.

OMNIA TEMPUS HABENT
Diagnose IPAH im Februar 2013, in Behandlung bei OA Dr. Ulrich Krüger, jetzt Dr. Fischer Herzzentrum Duisburg, Medikamente: Sildenafil, Bosentan jetzt Macitentan, Subkutane Treprostinilpumpe, seit Januar 2024 getunnelter ZVK mit externer Pumpe (Groshongkatheter), 24/7 Sauerstoff, Marcumar, Diuretika
Bitte Anmelden oder Registrieren um der Konversation beizutreten.
