- Beiträge: 1751
Sidebar
Vitamin D-Rezeptor und seine antiproliferative Wirkung bei PAH
01 Mär 2025 16:34 #2358
von danny
OMNIA TEMPUS HABENT
Diagnose IPAH im Februar 2013, in Behandlung bei OA Dr. Ulrich Krüger, jetzt Dr. Fischer Herzzentrum Duisburg, Medikamente: Sildenafil, Bosentan jetzt Macitentan, Subkutane Treprostinilpumpe, seit Januar 2024 getunnelter ZVK mit externer Pumpe (Groshongkatheter), 24/7 Sauerstoff, Marcumar, Diuretika
Vitamin D-Rezeptor und seine antiproliferative Wirkung bei PAH wurde erstellt von danny
www.nature.com/articles/s41598-024-78380-9Vitamin D-Rezeptor und seine antiproliferative Wirkung bei pulmonaler arterieller Hypertonie beim Menschen AbstraktEin Mangel an Vitamin D (VITD) wird häufig bei Patienten mit pulmonaler arterieller Hypertonie (PAH) beobachtet, und bei diesen Patienten korrelieren niedrige VitD-Werte mit einer schlechteren Prognose. Ziel dieser Studie war, die Expression und die antiproliferative Rolle des VitD-Rezeptors (VDR) und seines Signalwegs im menschlichen Lungengefäßsystem zu untersuchen. Vorhandensein und Expression von VDR wurden in Lungen, pulmonalarteriellen glatten Muskelzellen (PASMC) und Endothelzellen (PAEC) von Kontrollpersonen und PAH-Patienten analysiert. VDR-Expression und VDR-Zielgene wurden in mit Calcitriol behandelten PASMC untersucht. Die antiproliferative Wirkung von 48h-Calcitriol wurde in PASMC mittels MTT- und BrdU-Tests untersucht. VDR wird in PASMC exprimiert. Im Vergleich zu nicht-hypertensiven Kontrollpersonen ist es in Lungen und PASMC, aber nicht in PAEC von PAH-Patienten herunterreguliert. Calcitriol regulierte die VDR-Expression in PASMC und den VDR-Zielgenen KCNK3 (kodiert TASK1), BIRC5 (kodiert Survivin) und BMP4 stark hoch. Calcitriol erzeugte eine antiproliferative Wirkung, die durch Stilllegung oder pharmakologische Hemmung von Survivin oder BMPR2, nicht jedoch von TASK1, abgeschwächt wurde. Zusammenfassend lässt sich sagen, dass die Expression von VDR bei PAH-Patienten gering ist und durch Calcitriol gerettet werden kann. VDR übt eine antiproliferative Wirkung in PASMC aus, indem es Survivin und den BMP-Signalweg moduliert.
Die pulmonal-arterielle Hypertonie (PAH) ist eine multifaktorielle chronische Erkrankung, die durch pulmonal-arterielle Gefäßumbau und pulmonal-arterielle Vasokonstriktion gekennzeichnet ist 1. Ein wesentliches Kennzeichen ist der Gefäßumbau infolge einer übermäßigen und unkontrollierten Proliferation und Apoptoseresistenz von PA-Glattmuskelzellen (PASMC) und Endothelzellen (PAEC), was zu einer Verdickung der Intima und PA-Obliteration führt 2 , 3. Infolgedessen tendiert der rechte Ventrikel (RV) dazu, sich mit kompensatorischer RV-Hypertrophie an die Nachlast anzupassen, was zu RV-Versagen und vorzeitigem Tod führen kann.
In den letzten Jahren haben wir 4 und andere 5 gezeigt, dass Vitamin-D-Mangel (VitD) bei PAH-Patienten viel häufiger auftritt als in der Allgemeinbevölkerung oder sogar im Vergleich zu Patienten mit anderen Herz-Kreislauf-Erkrankungen. Bei PAH-Patienten oder Tiermodellen sind niedrigere VitD-Werte verbunden mit einer schlechteren Funktionsklasse, einer verkürzten 6-Minuten-Gehstrecke, einem erhöhten mittleren pulmonalarteriellen Druck (mPAP), einem erhöhten pulmonalvaskulären Widerstand, höheren BNP-/Pro-BNP-Werten, einer verringerten Herzleistung, einem verringerten therapeutischen Ansprechen auf Phosphodiesterase-5-Hemmer und/oder einer verringerten Überlebensrate 4 , 5 , 6 , 7 .
Die aktive Form von VitD, 1,25(OH) 2VitD (also Calcitriol) aktiviert den VitD-Rezeptor (VDR), einen Transkriptionsfaktor, der die Expression spezifischer Zielgene reguliert 8 . VDR wird in vielen Geweben und Zelltypen exprimiert, einschließlich Endothel- und glatten Muskelzellen. Es übt eine Vielzahl von Wirkungen aus, die nichts mit seinen bekannten Auswirkungen auf die Kalzium- und Phosphorhomöostase zu tun haben, also den sogenannten nicht-kalzämischen Wirkungen. Diese Wirkungen sind möglicherweise für Schlüsselprozesse im Herz-Kreislauf- und Atmungssystem relevant, wie etwa Zellproliferation, -differenzierung und -migration, Kontrolle des Gefäßtonus, Immunmodulation und Regulierung des Stoffwechsels, um nur einige zu nennen 9 .
Die Rolle von VDR im Lungengefäßsystem und bei PAH ist noch nicht erforscht. Ziel der vorliegenden Studie ist es, das Vorkommen, das Expressionsprofil und die durch VDR vermittelten Effekte im Lungengefäßsystem, seine antiproliferative Rolle bei PAH und den potenziellen Mechanismus zu charakterisieren.
ErgebnisseDie Expression des Lungen -VDR -Gens ist bei PAH herunterreguliertWir haben in einem öffentlichen Transkriptom-Datensatz nach der Expression von VDR gesucht und dabei 27 verschiedene Organe verglichen. Die VDR-Expression in der Lunge war niedriger als in gastrointestinalen Organen, den Nieren und der Haut, aber höher als in den meisten anderen Organen (Abb. 1 A). In einer anderen öffentlichen Transkriptom-Datenbank (GSE117261) war die VDR-Lungenexpression bei PAH-Patienten im Vergleich zu Kontrollpersonen herunterreguliert (Abb. 1 B, Kontrolle vs. alle PAH, p < 0,05, Mann-Whitney-Test). Die VDR-Lungenexpression unterschied sich zwischen den verschiedenen PAH-Untergruppen nicht signifikant (einfaktorielle ANOVA, Abb. 1 . Die Expression bei Frauen mit PAH war im Vergleich zu Kontrollpersonen signifikant reduziert. Bei Männern erreichte der Unterschied aufgrund der kleineren Stichprobengröße keine statistische Signifikanz (p = 0,06). Wir analysierten außerdem die VDR -mRNA-Expression mittels qRT-PCR und die VDR-Proteinexpression mittels Western Blot in Lungen von PAH-Patienten und in menschlichen Kontrolllungen (Abb.
1
C,D). Wir haben bestätigt, dass es bei PAH-Patienten zu einer signifikanten Herunterregulierung des VDR-Proteins kommt (Abb.
1
D).Abb. 1
. Die Expression bei Frauen mit PAH war im Vergleich zu Kontrollpersonen signifikant reduziert. Bei Männern erreichte der Unterschied aufgrund der kleineren Stichprobengröße keine statistische Signifikanz (p = 0,06). Wir analysierten außerdem die VDR -mRNA-Expression mittels qRT-PCR und die VDR-Proteinexpression mittels Western Blot in Lungen von PAH-Patienten und in menschlichen Kontrolllungen (Abb.
1
C,D). Wir haben bestätigt, dass es bei PAH-Patienten zu einer signifikanten Herunterregulierung des VDR-Proteins kommt (Abb.
1
D).Abb. 1
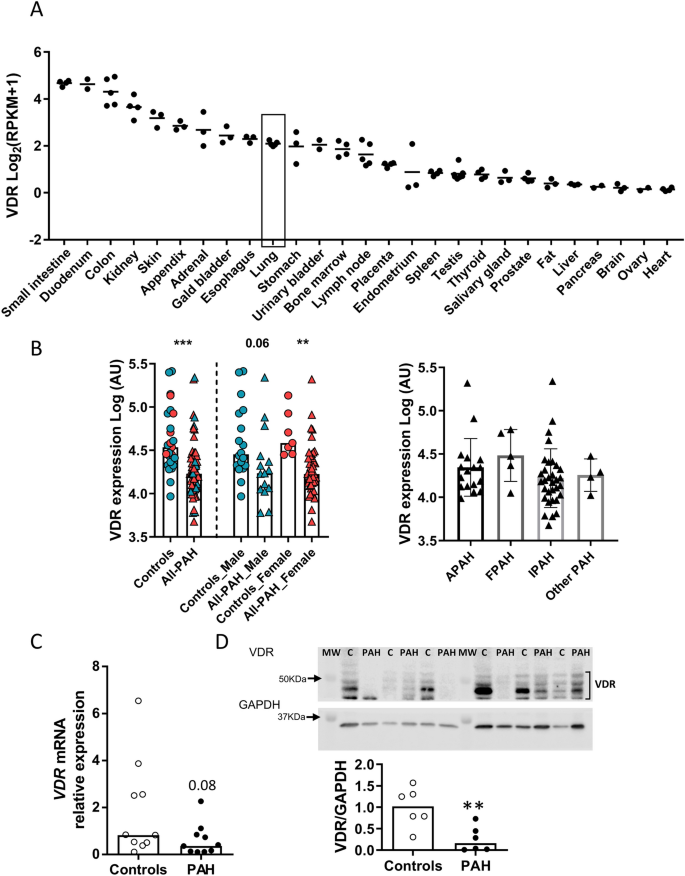 VDR wird in der menschlichen Lunge relativ stark exprimiert und ist bei PAH herunterreguliert. ( A ) VDR- Genexpressionsmuster in verschiedenen Geweben. Daten aus der NCBI-Datenbank, Projekt PRJEB4337. Die Daten werden logarithmisch in Log2(RPKM + 1) transformiert und als Punktdiagramm und Mittelwert dargestellt. ( B ) Analyse der VDR -mRNA-Expression in der Transkriptomdatenbank GSE117261 bei Kontrollen und PAH-Patienten (alle PAH). Die Analyse wurde auch nach Geschlecht und PAH-Unterklasse getrennt, einschließlich assoziierter (APAH), familiärer PAH (FPAH), idiopathischer PAH (IPAH) oder anderer oder unbekannter Ursachen. ( C ) VDR- mRNA-Expression durch qRT-PCR und ( D ) VDR-Protein normalisiert durch GAPDH-Expression durch Western Blot in Lungenproben von Kontrollen und PAH-Patienten. Mehrere VDR-Bänder wurden gemäß dem technischen Datenblatt des Antikörpers des Herstellers quantifiziert. Die Ergebnisse werden als Streudiagramme und Balken mit Medianen dargestellt. ** p < 0,01 und *** p < 0,001, nichtparametrischer Mann-Whitney-Test.
VDR-Genexpression innerhalb von PASMC und PAECDie Immunhistochemie in Lungenschnitten von Kontrollpersonen zeigt, dass VDR mit DAPI kolokalisiert ist, was auf eine Kernfärbung in fast allen Zellen in der Gefäßwand hinweist (Abb.
2
A). Wir haben auch die VDR-Expressionsdaten aus einer veröffentlichten Studie zu sc RNAseq in PAH
10
erneut analysiert . Abbildung
2
B zeigt das UMAP-Diagramm, das die verschiedenen Zellcluster identifiziert. In Abb.
2
C bestätigen die Daten, dass mehrere vaskuläre Zelltypen VDR exprimieren, darunter Perizyten, Fibroblasten, glatte Muskel- und Endothelzellen, und dass es auch in den meisten Arten von Immunzellen exprimiert wird. Bei PAH scheint VDR in PAH in vaskulären Zellen im Vergleich zu Kontrollen herunterreguliert zu sein. Die durch Immunzytochemie analysierte VDR-Expression blieb in kultivierten PASMC von Kontrollpersonen erhalten (Abb.
2
D). In diesen Zellen befand sich VDR hauptsächlich im Zellkern mit geringerer Expression im Zytosol. Wir verglichen die VDR -mRNA-Expression in kultivierten menschlichen Kontroll-PASMC mit PAEC durch qRT-PCR. Abbildung
2
E zeigt, dass die VDR- mRNA in PASMC viel höher war als in kultivierten menschlichen Kontroll-PAEC. PASMC von PAH-Patienten in Kultur zeigten auch eine geringere VDR-Expression im Vergleich zu denen von gesunden Spendern (Abb.
2
F). Im Gegensatz dazu war die VDR-Expression in PAEC bei Kontrollen und PAH-Patienten ähnlich (Abb.
2
G).Abb. 2
VDR wird in der menschlichen Lunge relativ stark exprimiert und ist bei PAH herunterreguliert. ( A ) VDR- Genexpressionsmuster in verschiedenen Geweben. Daten aus der NCBI-Datenbank, Projekt PRJEB4337. Die Daten werden logarithmisch in Log2(RPKM + 1) transformiert und als Punktdiagramm und Mittelwert dargestellt. ( B ) Analyse der VDR -mRNA-Expression in der Transkriptomdatenbank GSE117261 bei Kontrollen und PAH-Patienten (alle PAH). Die Analyse wurde auch nach Geschlecht und PAH-Unterklasse getrennt, einschließlich assoziierter (APAH), familiärer PAH (FPAH), idiopathischer PAH (IPAH) oder anderer oder unbekannter Ursachen. ( C ) VDR- mRNA-Expression durch qRT-PCR und ( D ) VDR-Protein normalisiert durch GAPDH-Expression durch Western Blot in Lungenproben von Kontrollen und PAH-Patienten. Mehrere VDR-Bänder wurden gemäß dem technischen Datenblatt des Antikörpers des Herstellers quantifiziert. Die Ergebnisse werden als Streudiagramme und Balken mit Medianen dargestellt. ** p < 0,01 und *** p < 0,001, nichtparametrischer Mann-Whitney-Test.
VDR-Genexpression innerhalb von PASMC und PAECDie Immunhistochemie in Lungenschnitten von Kontrollpersonen zeigt, dass VDR mit DAPI kolokalisiert ist, was auf eine Kernfärbung in fast allen Zellen in der Gefäßwand hinweist (Abb.
2
A). Wir haben auch die VDR-Expressionsdaten aus einer veröffentlichten Studie zu sc RNAseq in PAH
10
erneut analysiert . Abbildung
2
B zeigt das UMAP-Diagramm, das die verschiedenen Zellcluster identifiziert. In Abb.
2
C bestätigen die Daten, dass mehrere vaskuläre Zelltypen VDR exprimieren, darunter Perizyten, Fibroblasten, glatte Muskel- und Endothelzellen, und dass es auch in den meisten Arten von Immunzellen exprimiert wird. Bei PAH scheint VDR in PAH in vaskulären Zellen im Vergleich zu Kontrollen herunterreguliert zu sein. Die durch Immunzytochemie analysierte VDR-Expression blieb in kultivierten PASMC von Kontrollpersonen erhalten (Abb.
2
D). In diesen Zellen befand sich VDR hauptsächlich im Zellkern mit geringerer Expression im Zytosol. Wir verglichen die VDR -mRNA-Expression in kultivierten menschlichen Kontroll-PASMC mit PAEC durch qRT-PCR. Abbildung
2
E zeigt, dass die VDR- mRNA in PASMC viel höher war als in kultivierten menschlichen Kontroll-PAEC. PASMC von PAH-Patienten in Kultur zeigten auch eine geringere VDR-Expression im Vergleich zu denen von gesunden Spendern (Abb.
2
F). Im Gegensatz dazu war die VDR-Expression in PAEC bei Kontrollen und PAH-Patienten ähnlich (Abb.
2
G).Abb. 2
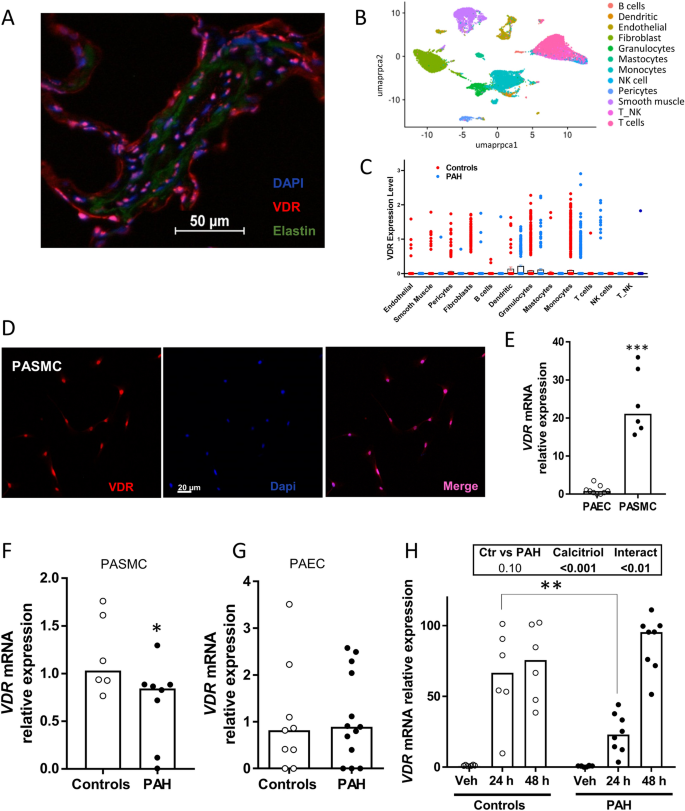 VDR wird in kultivierten menschlichen PASMC exprimiert und durch Calcitriol hochreguliert. ( A ) Repräsentative Immunhistochemie von VDR in einer menschlichen Kontrolllunge mit dargestellter Lungenarterie, die Elastin-Autofluoreszenz ist grün dargestellt. ( B ) Uniform Manifold Approximation and Projection (UMAP)-Diagramm der Lungenarterie-scRNA-Sequenzdaten von Spender- (Kontrolle, n = 3) und pulmonalarteriellen Hypertonie- (PAH, n = 3) Proben, eingefärbt nach Zellidentität. ( C ) Punktdiagramm mit VDR-Genexpression nach Zellidentität und Zustand (Kontrolle und PAH). ( D ) Immunzytochemie von PASMC, gefärbt mit Anti-VDR. ( E – G ) PASMC VDR- mRNA-Expression durch qRT-PCR in ( E ) PAEC (n = 9) vs. PASMC (n = 6) von Kontrollspendern, (F) PASMC von Kontrollspendern (n = 6) vs. PASMC von PAH-Patienten (n =
VDR wird in kultivierten menschlichen PASMC exprimiert und durch Calcitriol hochreguliert. ( A ) Repräsentative Immunhistochemie von VDR in einer menschlichen Kontrolllunge mit dargestellter Lungenarterie, die Elastin-Autofluoreszenz ist grün dargestellt. ( B ) Uniform Manifold Approximation and Projection (UMAP)-Diagramm der Lungenarterie-scRNA-Sequenzdaten von Spender- (Kontrolle, n = 3) und pulmonalarteriellen Hypertonie- (PAH, n = 3) Proben, eingefärbt nach Zellidentität. ( C ) Punktdiagramm mit VDR-Genexpression nach Zellidentität und Zustand (Kontrolle und PAH). ( D ) Immunzytochemie von PASMC, gefärbt mit Anti-VDR. ( E – G ) PASMC VDR- mRNA-Expression durch qRT-PCR in ( E ) PAEC (n = 9) vs. PASMC (n = 6) von Kontrollspendern, (F) PASMC von Kontrollspendern (n = 6) vs. PASMC von PAH-Patienten (n =  , und ( G ) PAEC von Kontrollspendern (n = 9) vs. PAEC von PAH-Patienten (n = 13). ( H ) VDR-Hochregulierung nach 24 und 48 Stunden durch Calcitriol (100 nmol/l) in PASMC von Kontrollspendern (n = 6) und PASMC von PAH-Patienten (n =
, und ( G ) PAEC von Kontrollspendern (n = 9) vs. PAEC von PAH-Patienten (n = 13). ( H ) VDR-Hochregulierung nach 24 und 48 Stunden durch Calcitriol (100 nmol/l) in PASMC von Kontrollspendern (n = 6) und PASMC von PAH-Patienten (n =  . Die Ergebnisse werden als Streudiagramme und Balken mit Medianen dargestellt. *** p < 0,001 vs. PAEC, * p < 0,05 vs. Kontrollen, nichtparametrischer Mann-Whitney-Test. In Panel H zeigt die Box die Ergebnisse der zweiseitigen ANOVA und ** p < 0,01 gemäß Bonferronis Test für Mehrfachvergleiche.
Die VDR-Expression wird nach der Calcitriol-Behandlung gerettetWir behandelten menschliche PASMC von Kontrollpersonen und PAH-Patienten 24 und 48 Stunden lang mit Calcitriol. Die VDR- mRNA-Expression war stark und zeitabhängig hochreguliert, wie durch RT-qPCR analysiert wurde (Abb.
2
H). Bemerkenswerterweise war die VDR- mRNA-Expression in PASMC von PAH-Patienten 24 Stunden nach der Calcitriol-Behandlung signifikant niedriger. Nach 48 Stunden war die VDR- mRNA-Expression in PAH-PASMC jedoch ähnlich wie in Kontroll-PASMC.VDR hemmt die PASMC-ProliferationAnschließend untersuchten wir die antiproliferativen Effekte der VDR-Stimulation mit Calcitriol in PASMC von PAH und Kontrollpersonen. In Gegenwart eines Vehikels zeigten PASMC eine proliferative Reaktion mit einem Anstieg der lebensfähigen Zellen um 50–100 % nach 48 Stunden, gemessen mit dem MTT-Test. Die Proliferation wurde durch Calcitriol (1–100 nmol/l) konzentrationsabhängig stark gehemmt, gemessen mit dem BrdU- oder dem MTT-Test (Abb.
3
A bzw.
. Die Ergebnisse werden als Streudiagramme und Balken mit Medianen dargestellt. *** p < 0,001 vs. PAEC, * p < 0,05 vs. Kontrollen, nichtparametrischer Mann-Whitney-Test. In Panel H zeigt die Box die Ergebnisse der zweiseitigen ANOVA und ** p < 0,01 gemäß Bonferronis Test für Mehrfachvergleiche.
Die VDR-Expression wird nach der Calcitriol-Behandlung gerettetWir behandelten menschliche PASMC von Kontrollpersonen und PAH-Patienten 24 und 48 Stunden lang mit Calcitriol. Die VDR- mRNA-Expression war stark und zeitabhängig hochreguliert, wie durch RT-qPCR analysiert wurde (Abb.
2
H). Bemerkenswerterweise war die VDR- mRNA-Expression in PASMC von PAH-Patienten 24 Stunden nach der Calcitriol-Behandlung signifikant niedriger. Nach 48 Stunden war die VDR- mRNA-Expression in PAH-PASMC jedoch ähnlich wie in Kontroll-PASMC.VDR hemmt die PASMC-ProliferationAnschließend untersuchten wir die antiproliferativen Effekte der VDR-Stimulation mit Calcitriol in PASMC von PAH und Kontrollpersonen. In Gegenwart eines Vehikels zeigten PASMC eine proliferative Reaktion mit einem Anstieg der lebensfähigen Zellen um 50–100 % nach 48 Stunden, gemessen mit dem MTT-Test. Die Proliferation wurde durch Calcitriol (1–100 nmol/l) konzentrationsabhängig stark gehemmt, gemessen mit dem BrdU- oder dem MTT-Test (Abb.
3
A bzw.  . Die hemmende Wirkung von Calcitriol auf die Proliferation wurde auch in PASMC von PAH-Patienten beobachtet (Abb.
3
C). Tatsächlich war die Hemmung bei 10 nM Calcitriol in PAH (94 ± 16 %, Abb.
3
C) signifikant höher als in Kontrollzellen (49 ± 11 %, p < 0,05, Abb.
3
. Die hemmende Wirkung von Calcitriol auf die Proliferation wurde auch in PASMC von PAH-Patienten beobachtet (Abb.
3
C). Tatsächlich war die Hemmung bei 10 nM Calcitriol in PAH (94 ± 16 %, Abb.
3
C) signifikant höher als in Kontrollzellen (49 ± 11 %, p < 0,05, Abb.
3
 .Abb. 3
.Abb. 3
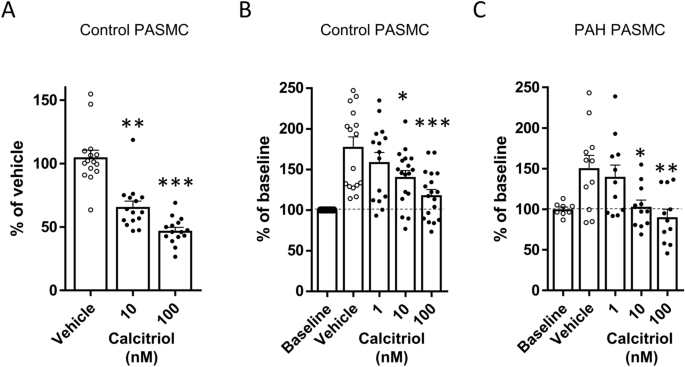 Calcitriol hat eine antiproliferative Wirkung auf humane PASMC. ( A ) und ( B ) Proliferation in humanen PASMC aus 5 (dreifach) Kontrollen, gemessen durch BrdU-Einbau bzw. MTT-Test, und ( C ) Proliferation in PASMC aus 4 verschiedenen Kulturen von PAH-Patienten, doppelt oder dreifach, durch MTT-Test, nach Exposition gegenüber Calcitriol (1–100 nmol/l) für 48 h. Die Ergebnisse sind als Mittelwert ± SEM angegeben. *, **, *** bedeuten p < 0,05, p < 0,01 und p < 0,001 gegenüber Vehikel, einfaktorielle ANOVA, Bonferroni-Test.
Calcitriol moduliert mehrere Gene, die bei der PAH-Proliferation von Interesse sindAls nächstes analysierten wir die Expression mehrerer Gene, die möglicherweise durch VDR moduliert werden und deren Dysregulation bekanntermaßen an der PASMC-Proliferation bei PAH beteiligt ist. Interessanterweise erhöhte eine 48-stündige Calcitriol-Behandlung in menschlichen Kontroll-PASMC die Expression von KCNK3 (Abb.
4A
), dem Gen, das den Kaliumkanal TASK-1 kodiert, und verringerte die Expression von BIRC5 , dem Gen, das das Survivin-Protein kodiert (Abb.
4B
). Wir analysierten außerdem seine Auswirkungen auf Gene des BMPR2- und TGFβ-Signalwegs. Calcitriol erhöhte die Expression von BMP4 signifikant , aber der Effekt war für BMP6, Liganden von BMPR2, nicht signifikant ( p = 0,06), hatte jedoch keine Auswirkungen auf BMPR2 selbst oder auf Gene, die mit seinem kanonischen, Smad-abhängigen Signalweg in Verbindung stehen (Abb.
4C
).Abb. 4
Calcitriol hat eine antiproliferative Wirkung auf humane PASMC. ( A ) und ( B ) Proliferation in humanen PASMC aus 5 (dreifach) Kontrollen, gemessen durch BrdU-Einbau bzw. MTT-Test, und ( C ) Proliferation in PASMC aus 4 verschiedenen Kulturen von PAH-Patienten, doppelt oder dreifach, durch MTT-Test, nach Exposition gegenüber Calcitriol (1–100 nmol/l) für 48 h. Die Ergebnisse sind als Mittelwert ± SEM angegeben. *, **, *** bedeuten p < 0,05, p < 0,01 und p < 0,001 gegenüber Vehikel, einfaktorielle ANOVA, Bonferroni-Test.
Calcitriol moduliert mehrere Gene, die bei der PAH-Proliferation von Interesse sindAls nächstes analysierten wir die Expression mehrerer Gene, die möglicherweise durch VDR moduliert werden und deren Dysregulation bekanntermaßen an der PASMC-Proliferation bei PAH beteiligt ist. Interessanterweise erhöhte eine 48-stündige Calcitriol-Behandlung in menschlichen Kontroll-PASMC die Expression von KCNK3 (Abb.
4A
), dem Gen, das den Kaliumkanal TASK-1 kodiert, und verringerte die Expression von BIRC5 , dem Gen, das das Survivin-Protein kodiert (Abb.
4B
). Wir analysierten außerdem seine Auswirkungen auf Gene des BMPR2- und TGFβ-Signalwegs. Calcitriol erhöhte die Expression von BMP4 signifikant , aber der Effekt war für BMP6, Liganden von BMPR2, nicht signifikant ( p = 0,06), hatte jedoch keine Auswirkungen auf BMPR2 selbst oder auf Gene, die mit seinem kanonischen, Smad-abhängigen Signalweg in Verbindung stehen (Abb.
4C
).Abb. 4
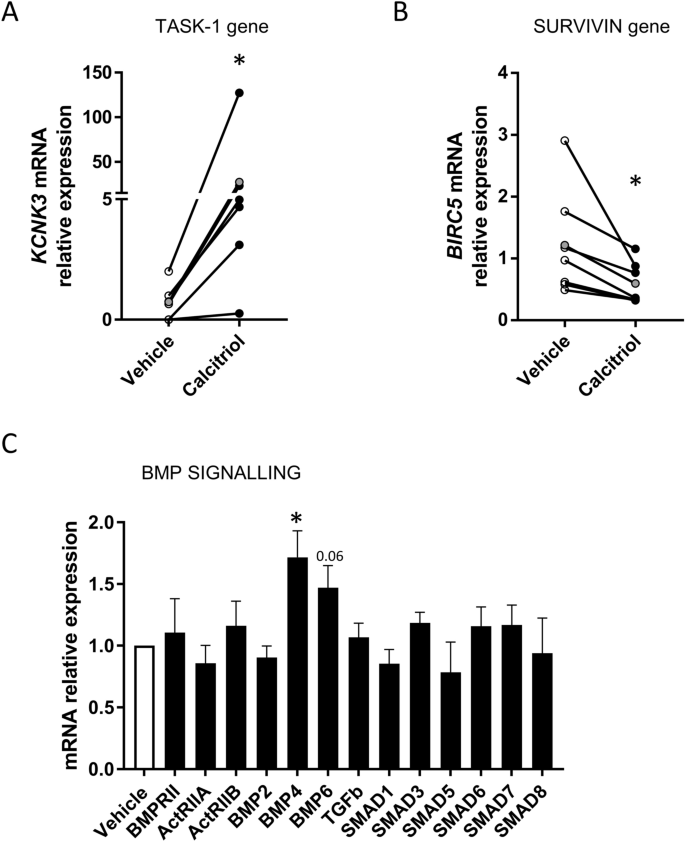 Calcitriol moduliert die Expression von Genen, die bei PAH von Interesse sind. Expression von ( A ) KCNK3 (Gen, das TASK1 kodiert, n = 6), ( B ) BIRC5 (Gen, das Survivin kodiert, n = 7) und ( C ) Genen, die am BMP-Signalweg beteiligt sind (n = 3–6) nach Exposition gegenüber einem Calcitriol-Vehikel (100 nmol/l) für 48 h. Die Daten in den Feldern A und B werden als Vorher-Nachher-Diagramm dargestellt. Der graue Punkt stellt den Mittelwert dar. * p < 0,05, nichtparametrischer Paartest vs. Vehikel. Die Ergebnisse in Feld C werden als Mittelwert ± SEM ausgedrückt.
Calcitriol hemmt die PASMC-Proliferation teilweise über den BMPR2-SignalwegMithilfe einer Gen-Abschaltung und eines pharmakologischen Ansatzes haben wir analysiert, ob der BMPR2-Signalweg an der antiproliferativen Wirkung von Calcitriol in Kontroll-PASMC beteiligt ist. 48 Stunden nach dem gezielten Knockdown (siBMPR2) war die BMPR2- mRNA-Expression im Vergleich zu einer Scramble-siRNA um ̴ 65 % reduziert (Abb.
5A
), was zu einer signifikanten Steigerung der Zellproliferation führte, gemessen mit dem MTT-Test (Abb.
5B
). Bemerkenswerterweise verringerte der Verlust des BMPR2 -Gens teilweise die antiproliferative Wirkung von vitD in kultivierten menschlichen PASMC, was sowohl mit MTT- (Abb.
5C
) als auch mit BrdU-Tests (Abb.
5D
) analysiert wurde. Um dieses Ergebnis zu bestätigen, behandelten wir in einer weiteren Reihe von Experimenten menschliche Kontroll-PASMC mit dem BMPR2-Signalhemmer DMH1 (5 µmol/l)
11
. Wir konnten nicht feststellen, dass die Hemmung der BMPR2-Signalgebung durch DMH1 die PASMC-Proliferation erhöhte (Abb.
5
E). Allerdings wurde, im Einklang mit den BMPR2- Silencing-Experimenten, die antiproliferative Wirkung von Calcitriol auch teilweise durch DMH1 gehemmt, wie durch MTT- oder BrdU-Tests gemessen wurde (Abb.
5
E). Somit hemmte Calcitriol den BrdU-Einbau um 55 ± 3 % bzw. 21 ± 7 % in Abwesenheit bzw. Anwesenheit von DMH-1 ( p < 0,001). Beim MTT-Test betrug die Hemmung 36 ± 5 % bzw. 18 ± 6 % ( p < 0,01). Da BMPR2 auch über einen nichtkanonischen Smad-unabhängigen Signalweg mit MAP-Kinasen signalisieren kann, analysierten wir auch die Wirkungen von Calcitriol in Anwesenheit von MAP-Kinasen-Hemmern. Die antiproliferative Wirkung von Calcitriol wurde in Gegenwart des p38-MAPK-Inhibitors SB203580 (10 µmol/l) oder des selektiven ERK-MAPK-Inhibitors PD98059 (5 µmol/l) nicht verändert, wie durch BrdU- und MTT-Tests analysiert wurde (ergänzende Abb.
1
A,
Calcitriol moduliert die Expression von Genen, die bei PAH von Interesse sind. Expression von ( A ) KCNK3 (Gen, das TASK1 kodiert, n = 6), ( B ) BIRC5 (Gen, das Survivin kodiert, n = 7) und ( C ) Genen, die am BMP-Signalweg beteiligt sind (n = 3–6) nach Exposition gegenüber einem Calcitriol-Vehikel (100 nmol/l) für 48 h. Die Daten in den Feldern A und B werden als Vorher-Nachher-Diagramm dargestellt. Der graue Punkt stellt den Mittelwert dar. * p < 0,05, nichtparametrischer Paartest vs. Vehikel. Die Ergebnisse in Feld C werden als Mittelwert ± SEM ausgedrückt.
Calcitriol hemmt die PASMC-Proliferation teilweise über den BMPR2-SignalwegMithilfe einer Gen-Abschaltung und eines pharmakologischen Ansatzes haben wir analysiert, ob der BMPR2-Signalweg an der antiproliferativen Wirkung von Calcitriol in Kontroll-PASMC beteiligt ist. 48 Stunden nach dem gezielten Knockdown (siBMPR2) war die BMPR2- mRNA-Expression im Vergleich zu einer Scramble-siRNA um ̴ 65 % reduziert (Abb.
5A
), was zu einer signifikanten Steigerung der Zellproliferation führte, gemessen mit dem MTT-Test (Abb.
5B
). Bemerkenswerterweise verringerte der Verlust des BMPR2 -Gens teilweise die antiproliferative Wirkung von vitD in kultivierten menschlichen PASMC, was sowohl mit MTT- (Abb.
5C
) als auch mit BrdU-Tests (Abb.
5D
) analysiert wurde. Um dieses Ergebnis zu bestätigen, behandelten wir in einer weiteren Reihe von Experimenten menschliche Kontroll-PASMC mit dem BMPR2-Signalhemmer DMH1 (5 µmol/l)
11
. Wir konnten nicht feststellen, dass die Hemmung der BMPR2-Signalgebung durch DMH1 die PASMC-Proliferation erhöhte (Abb.
5
E). Allerdings wurde, im Einklang mit den BMPR2- Silencing-Experimenten, die antiproliferative Wirkung von Calcitriol auch teilweise durch DMH1 gehemmt, wie durch MTT- oder BrdU-Tests gemessen wurde (Abb.
5
E). Somit hemmte Calcitriol den BrdU-Einbau um 55 ± 3 % bzw. 21 ± 7 % in Abwesenheit bzw. Anwesenheit von DMH-1 ( p < 0,001). Beim MTT-Test betrug die Hemmung 36 ± 5 % bzw. 18 ± 6 % ( p < 0,01). Da BMPR2 auch über einen nichtkanonischen Smad-unabhängigen Signalweg mit MAP-Kinasen signalisieren kann, analysierten wir auch die Wirkungen von Calcitriol in Anwesenheit von MAP-Kinasen-Hemmern. Die antiproliferative Wirkung von Calcitriol wurde in Gegenwart des p38-MAPK-Inhibitors SB203580 (10 µmol/l) oder des selektiven ERK-MAPK-Inhibitors PD98059 (5 µmol/l) nicht verändert, wie durch BrdU- und MTT-Tests analysiert wurde (ergänzende Abb.
1
A, .Abb. 5
.Abb. 5
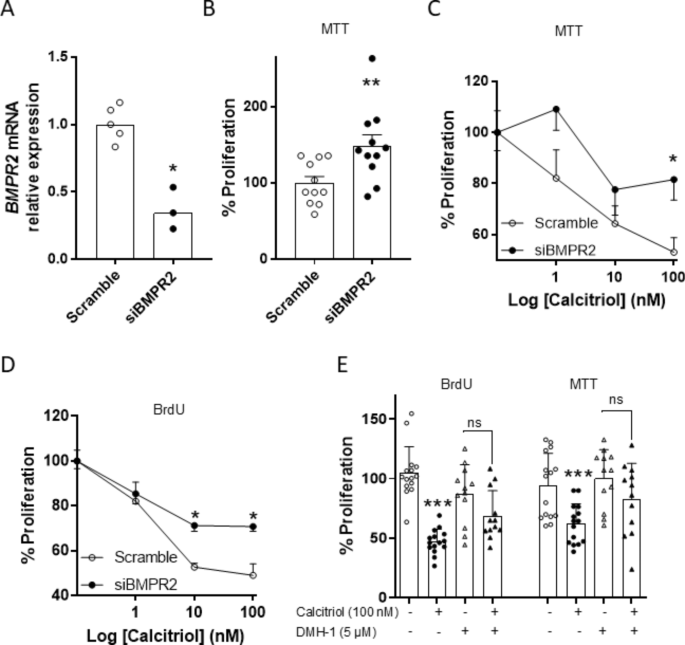 Calcitriol hemmt die Proliferation von PASMC über BMPR2. Menschliche Kontroll-PASMC wurden mit siRNA für BMPR2 (siBMPR2) oder Kontroll-siRNA (Scramble) transfiziert. ( A ) BMPR2 -mRNA-Expression, ermittelt durch qRT-PCR 48 Stunden nach der Transfektion. Die Daten werden als Streudiagramme und Balken mit Medianen ausgedrückt, * p < 0,05, Mann-Whitney-Test. ( B ) Wirkung von Calcitriol auf die Proliferation in stillgelegten BMPR2- PASMC, gemessen durch MTT-Test. Ergebnisse werden als Mittelwert ± SEM ausgedrückt. *p < 0,05, t-Test vs. Scramble. ( C ) und ( D ) Wirkung von Calcitriol (1–100 nmol/l) auf die Proliferation in mit siBMPR2 oder Scramble transfizierten PASMC, gemessen durch MTT- bzw. BrdU-Tests. * p < 0,05, zweiseitiger ANOVA, Bonferroni-Post-hoc-Test, vs. Scramble. ( E ) Wirkung von Calcitriol auf die Proliferation in PASMC in Anwesenheit oder Abwesenheit von DMH1 (5 µmol/l), durch MTT- und BrdU-Test; *** p < 0,001 Calcitriol vs. Vehikel (schwarze Säule), zweiseitiger ANOVA. n = 4–5 verschiedene Kulturen in zweifacher oder dreifacher Ausführung.
Calcitriol hemmt die PASMC-Proliferation teilweise durch Survivin-DownregulationDer durch Calcitriol induzierte antiproliferative Effekt wurde auch in menschlichen PASMC untersucht, die mit siRNA gegen BIRC5 , das Gen, das das Survivin-Protein kodiert, transfiziert oder mit dem Survivin-Hemmer YM155 inkubiert wurden. 48 Stunden nach dem gezielten Knockdown reduzierte siRNA die BIRC5- mRNA-Expression um ca. 80 % (Abb.
6A
). Das siBIRC5 (Abb.
6B
) oder 20 nM YM155 (Abb.
6C
) führten zu einer ca. 50-prozentigen Abnahme der Zellproliferation, gemessen mit MTT-Test oder BrdU-Test. Darüber hinaus hob der BIRC5- Knockdown den durch Calcitriol induzierten antiproliferativen Effekt in menschlichen PASMC auf (Abb.
6D
). In gleicher Weise hob der Survivin-Hemmer YM155 auch den antiproliferativen Effekt von Calcitriol auf (Abb.
6E
).Abb. 6
Calcitriol hemmt die Proliferation von PASMC über BMPR2. Menschliche Kontroll-PASMC wurden mit siRNA für BMPR2 (siBMPR2) oder Kontroll-siRNA (Scramble) transfiziert. ( A ) BMPR2 -mRNA-Expression, ermittelt durch qRT-PCR 48 Stunden nach der Transfektion. Die Daten werden als Streudiagramme und Balken mit Medianen ausgedrückt, * p < 0,05, Mann-Whitney-Test. ( B ) Wirkung von Calcitriol auf die Proliferation in stillgelegten BMPR2- PASMC, gemessen durch MTT-Test. Ergebnisse werden als Mittelwert ± SEM ausgedrückt. *p < 0,05, t-Test vs. Scramble. ( C ) und ( D ) Wirkung von Calcitriol (1–100 nmol/l) auf die Proliferation in mit siBMPR2 oder Scramble transfizierten PASMC, gemessen durch MTT- bzw. BrdU-Tests. * p < 0,05, zweiseitiger ANOVA, Bonferroni-Post-hoc-Test, vs. Scramble. ( E ) Wirkung von Calcitriol auf die Proliferation in PASMC in Anwesenheit oder Abwesenheit von DMH1 (5 µmol/l), durch MTT- und BrdU-Test; *** p < 0,001 Calcitriol vs. Vehikel (schwarze Säule), zweiseitiger ANOVA. n = 4–5 verschiedene Kulturen in zweifacher oder dreifacher Ausführung.
Calcitriol hemmt die PASMC-Proliferation teilweise durch Survivin-DownregulationDer durch Calcitriol induzierte antiproliferative Effekt wurde auch in menschlichen PASMC untersucht, die mit siRNA gegen BIRC5 , das Gen, das das Survivin-Protein kodiert, transfiziert oder mit dem Survivin-Hemmer YM155 inkubiert wurden. 48 Stunden nach dem gezielten Knockdown reduzierte siRNA die BIRC5- mRNA-Expression um ca. 80 % (Abb.
6A
). Das siBIRC5 (Abb.
6B
) oder 20 nM YM155 (Abb.
6C
) führten zu einer ca. 50-prozentigen Abnahme der Zellproliferation, gemessen mit MTT-Test oder BrdU-Test. Darüber hinaus hob der BIRC5- Knockdown den durch Calcitriol induzierten antiproliferativen Effekt in menschlichen PASMC auf (Abb.
6D
). In gleicher Weise hob der Survivin-Hemmer YM155 auch den antiproliferativen Effekt von Calcitriol auf (Abb.
6E
).Abb. 6
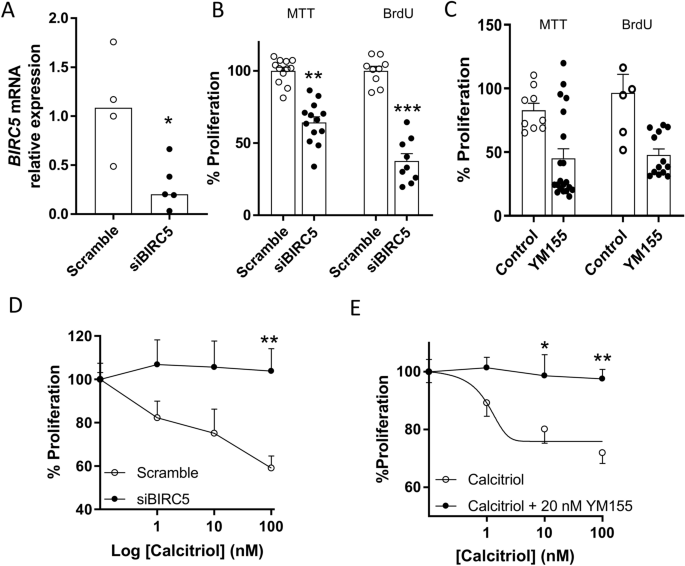 Die antiproliferative Wirkung von Calcitriol wird durch Survivin-Hemmung unterdrückt. ( A ) BIRC5- mRNA-Expression (Gen, das Survivin kodiert), bestimmt durch qRT-PCR 48 Stunden nach Transfektion mit siRNA gegen BIRC5 (siBIRC5) oder Scramble-siRNA. Die Daten werden als Streudiagramme dargestellt und die Balken stellen den Median dar, * p < 0,05, Mann-Whitney-Test. ( B , C ) Proliferation von PASMC, transfiziert mit siBIRC5 oder Scramble (
Die antiproliferative Wirkung von Calcitriol wird durch Survivin-Hemmung unterdrückt. ( A ) BIRC5- mRNA-Expression (Gen, das Survivin kodiert), bestimmt durch qRT-PCR 48 Stunden nach Transfektion mit siRNA gegen BIRC5 (siBIRC5) oder Scramble-siRNA. Die Daten werden als Streudiagramme dargestellt und die Balken stellen den Median dar, * p < 0,05, Mann-Whitney-Test. ( B , C ) Proliferation von PASMC, transfiziert mit siBIRC5 oder Scramble ( oder YM155 (20 nmol/l), gemessen durch MTT- und BrdU-Tests. ( D , E ) Auswirkungen von Calcitriol (1–100 nmol/l) auf die Proliferation in PASMC, die mit siBIRC5 oder Scramble transfiziert ( D ) oder mit YM155 (20 nmol/l) behandelt ( E ) wurden, gemessen mittels BrdU-Test über 48 Stunden. Daten sind als Mittelwert ± SEM angegeben. * p < 0,05 und ** p < 0,01 vs. Scramble oder Calcitriol, zweiseitiger ANOVA, Bonferroni-Test. n = 3–4 verschiedene Kulturen in dreifacher Ausführung.
Die antiproliferativen Effekte von Calcitriol bleiben in KCNK3- stillgelegten PASMC erhaltenUm die Rolle der TASK-1-Kanäle bei der antiproliferativen Wirkung von Calcitriol zu analysieren, transfizierten wir menschliche Kontroll-PASMC mit KCNK3- siRNA (n = 5; ergänzende Abb.
2
). Dies führte zu einer Steigerung der Proliferation, gemessen mit MTT- bzw. BrdU-Tests. Bemerkenswerterweise hatte die KCNK3- Stilllegung keinen Einfluss auf die antiproliferative Wirkung von Calcitriol, analysiert mit MTT und BrdU.Auswirkungen von Calcitriol auf die PAEC-ProliferationWir untersuchten die Auswirkungen von Calcitriol (10–100 nmol/l) auf die Proliferation von Kontroll-PAEC und PAEC von Patienten mit CTEPH, gemessen mit MTT- und BrdU-Inkorporationstests (ergänzende Abb.
3
). Calcitriol in einer Konzentration von 10 nmol/l steigerte das Zellwachstum sowohl in Kontroll- als auch in PAEC von Patienten mit CTEPH. Im Gegensatz dazu hatte 100 nmol/l Calcitriol keinen Einfluss auf das Zellwachstum.Calcitriol hat keine entspannende Wirkung bei PAWir untersuchten außerdem die direkte gefäßerweiternde Wirkung von Calcitriol bei PA von Kontrollpersonen, die in einem Drahtmyographen befestigt waren und mit einem Cocktail aus pulmonalen Vasokonstriktoren vorkontrahiert worden waren: Endothelin-1 (ET-1, 3 nmol/l), Thromboxan-A2-Mimetikum U46619 (30 nmol/l) und Serotonin (5-HT, 3 µmol/l). Unter diesen Bedingungen hatte Calcitriol (0,01–10 nmol/l) keine akute gefäßerweiternde Wirkung (ergänzende Abb.
4
).
oder YM155 (20 nmol/l), gemessen durch MTT- und BrdU-Tests. ( D , E ) Auswirkungen von Calcitriol (1–100 nmol/l) auf die Proliferation in PASMC, die mit siBIRC5 oder Scramble transfiziert ( D ) oder mit YM155 (20 nmol/l) behandelt ( E ) wurden, gemessen mittels BrdU-Test über 48 Stunden. Daten sind als Mittelwert ± SEM angegeben. * p < 0,05 und ** p < 0,01 vs. Scramble oder Calcitriol, zweiseitiger ANOVA, Bonferroni-Test. n = 3–4 verschiedene Kulturen in dreifacher Ausführung.
Die antiproliferativen Effekte von Calcitriol bleiben in KCNK3- stillgelegten PASMC erhaltenUm die Rolle der TASK-1-Kanäle bei der antiproliferativen Wirkung von Calcitriol zu analysieren, transfizierten wir menschliche Kontroll-PASMC mit KCNK3- siRNA (n = 5; ergänzende Abb.
2
). Dies führte zu einer Steigerung der Proliferation, gemessen mit MTT- bzw. BrdU-Tests. Bemerkenswerterweise hatte die KCNK3- Stilllegung keinen Einfluss auf die antiproliferative Wirkung von Calcitriol, analysiert mit MTT und BrdU.Auswirkungen von Calcitriol auf die PAEC-ProliferationWir untersuchten die Auswirkungen von Calcitriol (10–100 nmol/l) auf die Proliferation von Kontroll-PAEC und PAEC von Patienten mit CTEPH, gemessen mit MTT- und BrdU-Inkorporationstests (ergänzende Abb.
3
). Calcitriol in einer Konzentration von 10 nmol/l steigerte das Zellwachstum sowohl in Kontroll- als auch in PAEC von Patienten mit CTEPH. Im Gegensatz dazu hatte 100 nmol/l Calcitriol keinen Einfluss auf das Zellwachstum.Calcitriol hat keine entspannende Wirkung bei PAWir untersuchten außerdem die direkte gefäßerweiternde Wirkung von Calcitriol bei PA von Kontrollpersonen, die in einem Drahtmyographen befestigt waren und mit einem Cocktail aus pulmonalen Vasokonstriktoren vorkontrahiert worden waren: Endothelin-1 (ET-1, 3 nmol/l), Thromboxan-A2-Mimetikum U46619 (30 nmol/l) und Serotonin (5-HT, 3 µmol/l). Unter diesen Bedingungen hatte Calcitriol (0,01–10 nmol/l) keine akute gefäßerweiternde Wirkung (ergänzende Abb.
4
).
DiskussionIn der vorliegenden Studie haben wir die Expression und den Ort von VDR sowie die von diesem Rezeptor vermittelten Wirkungen im Lungengefäßsystem und seine mögliche Rolle bei PAH untersucht. Zum ersten Mal haben wir Beweise dafür geliefert, dass (1) VDR in mehreren Zelltypen in der Lunge exprimiert wird, einschließlich PASMC, (2) es in Lungen und PASMC von PAH-Patienten herunterreguliert ist, (3) eine Behandlung mit Calcitriol die Expression von VDR retten kann, (4) es KCNK3 und BMP4 hochreguliert und die Expression des Survivin-Gens in PASMC herunterreguliert und schließlich (5) es eine antiproliferative Wirkung in PASMC ausübt, indem es die Survivin- und BMP-Signalwege moduliert. Calcitriol hatte jedoch keine antiproliferative Wirkung in PAEC und keine direkte gefäßerweiternde Wirkung bei menschlichen PA.Das VDR- Genexpressionsmuster in der NCBI-Datenbank steht im Einklang mit der Tatsache, dass die Gewebe mit dem höchsten VDR-Gehalt diejenigen sind, die mit der Aufrechterhaltung der Kalziumhomöostase in Verbindung stehen. So ist VDR im gesamten Dünndarm vom Zwölffingerdarm über das Ileum bis hin zum Dickdarm weit verbreitet, insbesondere in den Darmepithelzellen, um die Kalziumaufnahme zu fördern, und in den distalen Nierentubuli, um die Kalziumrückaufnahme zu regulieren 12. Außer dieser Organgruppe gibt es eine weitere Gewebegruppe mit geringerer, aber beträchtlicher VDR-Expression, darunter die Lunge. Frühere Studien haben gezeigt, dass VDR in menschlichen Bronchialepithelzellen exprimiert wird 13. Zudem wurde VDR in kultivierten menschlichen PASMC exprimiert, während die Expression in PAEC deutlich geringer war. Immunhistochemie und sc-RNAseq bestätigten, dass VDR in mehreren vaskulären Zelltypen exprimiert wird, darunter – in absteigender Reihenfolge – Fibroblasten und Perizyten, glatte Muskelzellen und Endothelzellen.Frühere Studien unserer und anderer Gruppen 4 , 5 , 6 , 7 haben gezeigt, dass Vitamin-D-Mangel bei PAH wesentlich häufiger auftritt als in der Gesamtbevölkerung und dass bemerkenswerterweise niedrige Gesamt-25(OH)-Vitamin-D-Spiegel mit einer schlechten Prognose verbunden sind. Bislang hat jedoch keine dieser Studien die Rolle von VDR bei PAH untersucht. Zunächst analysierten wir VDR in der öffentlich zugänglichen Transkriptomdatenbank GSE117261 14. Die Analyse zeigte, dass die VDR-Expression in den Lungen von PAH-Patienten herunterreguliert ist. Außerdem haben wir per qPCR und Western Blot bestätigt, dass die VDR-Expression in den Lungen einer Kohorte spanischer PAH-Patienten im Vergleich zu den Lungen von Transplantationsspendern verringert ist. In sc-RNAseq-Experimenten scheint VDR in Gefäßzellen bei PAH reduziert zu sein, nicht aber in Immunzellen. Aufgrund der geringen Stichprobengröße (n = 3) und der begrenzten Sequenzierungstiefe lassen die Daten keine sichere Schlussfolgerung zu, ob VDR in einem bestimmten Gefäßzelltyp reduziert ist oder nicht. Wir untersuchten außerdem den VDR-Ausdruck in kultivierten menschlichen PASMC und PAEC aus Kontrollgruppen und PAH. In kultivierten PASMC wurde eine Herunterregulierung der VDR-mRNA bestätigt. In PAEC war der VDR-Ausdruck jedoch geringer und wir stellten keine Unterschiede zwischen Kontrollgruppen und PAH-Patienten fest. Bemerkenswerterweise werden niedrige VDR-Werte in der Lunge mit verschiedenen Lungenerkrankungen assoziiert, darunter COPD 15 und idiopathische Lungenfibrose 16 , und korrelieren mit einer schlechteren Prognose. Homozygote VDR-defiziente Mäuse weisen Veränderungen an den anhaftenden Verbindungen in der Lunge auf, was darauf hindeutet, dass VDR eine wichtige Rolle bei der Aufrechterhaltung der Integrität der Lungenbarriere 17 und bei pulmonalen Gefäßveränderungen, darunter hochregulierte Kv7-Kanalaktivität 18 , spielen könnte .Das VDR-Gen kann gewebespezifisch durch verschiedene Faktoren reguliert werden, zu denen auch sein aktivster Ligand Calcitriol gehört. Es besteht daher eine physiologische positive Rückkopplungsschleife zwischen den Calcitriolwerten und der VDR-Expression 19 . Diese Autoregulation wurde in vielen verschiedenen Zellen beobachtet. Sie kann durch eine erhöhte Transkription des VDR-Gens verursacht werden, die mit dem Vorhandensein eines Vitamin-D-Response-Elements (VDRE) in der Promotorregion des VDR-Gens einhergeht, sowie durch eine Stabilisierung von VDR, wodurch die Rezeptordegradation abnimmt. In Übereinstimmung mit dieser Ansicht zeigten unsere früheren Ergebnisse, dass PAH-Patienten einen schweren Vitamin-D-Mangel aufwiesen und wir zeigen nun auch bei diesen Patienten eine verringerte VDR-Expression in der Lunge. Daher fragten wir uns, ob eine Calcitriol-Behandlung die herunterregulierte VDR-Expression in PAH-PASMC retten könnte. Unsere Ergebnisse zeigten, dass die VDR -mRNA-Expression durch Calcitriol stark hochreguliert wird. Bemerkenswerterweise erreichte die VDR- Expression in PAH-PASMC nach 48-stündiger Calcitriol-Behandlung ähnliche Werte wie in Kontroll-PASMC.Die Entdeckung von VDR in vielen Geweben, die nicht an der Kalzium- und Phosphorhomöostase beteiligt sind, führte zur Identifizierung einer großen Bandbreite von durch VDR vermittelten Funktionen, die möglicherweise bei Herz-Kreislauf-Erkrankungen relevant sind, wie Zellproliferation, -differenzierung und -apoptose, Zelladhäsion, oxidativer Stress, Angiogenese und entzündungshemmende Aktivität 9 . Daher untersuchten wir einige potenzielle VDR-vermittelte Effekte, die bei PAH von Interesse sind, darunter auch jene auf die Zellproliferation.Es wurde gezeigt, dass VitD-Metaboliten die Zellproliferation über mehrere Mechanismen verändern. Calcitriol zeigte sowohl in normalen als auch in pathologischen Situationen eine antiproliferative Wirkung, darunter in aus Krebs stammenden Zelllinien und vaskulären glatten Muskelzellen (VSMC) 20 , 21 , 22 , 23. Dementsprechend haben wir herausgefunden, dass Calcitriol in vitro eine antiproliferative Wirkung auf menschliche PASMC hat. Bemerkenswerterweise wurde die hemmende Wirkung von Calcitriol auf das Zellwachstum auch bei PASMC von PAH-Patienten beobachtet. Tatsächlich schwächte die Calcitriol-Behandlung die pulmonale vaskuläre Umgestaltung in einem PAH-Tiermodell ab 24. Unsere Ergebnisse zeigen, dass Calcitriol die Expression des herunterregulierten VDR in PASMC von PAH-Patienten rettet, um antiproliferative Wirkungen zu erzielen. Die nukleäre Lokalisierung von VDR scheint notwendig zu sein, um antiproliferative Wirkungen auszuüben, wie sie bei anderen Zelltypen berichtet wurden. Bei Brustkrebs beispielsweise fördert in Abwesenheit eines Liganden die Ansammlung von VDR im Zytoplasma das Zellwachstum, im Gegensatz zur antiproliferativen nukleären Wirkung des Calcitriol-VDR-Komplexes 25 .Als nächstes analysierten wir mehrere mögliche Ziele von VDR, die an der antiproliferativen Wirkung beteiligt sind. Wir wählten den BMPR2-Signalweg, TASK1 und Survivin, weil diese bekanntermaßen an PAH beteiligt sind und weil wir fanden, dass sie in den Lungen von Ratten mit Vitamin-D-Mangel dysreguliert sind 26. Funktionsverlustmutationen und Herunterregulierung von KCNK3 (Gen, das den Kaliumkanal TASK-1 kodiert) kommen bei erblicher und idiopathischer PAH vor und tragen zur verstärkten pulmonalarteriellen Vasokonstriktion und zur Proliferation von PASMC und PAEC bei, was zu einer Umgestaltung der pulmonalarteriellen Erkrankungen führt 27 , 28. Einige Berichte haben gezeigt, dass KCNK3 ein Ziel von VDR sein könnte 29 , 30 , 31 und wir haben außerdem ein VDRE im KCNK3- Genpromotor identifiziert 26 . Es muss hervorgehoben werden, dass die Expression und Aktivität von KCNK3 in VSMC unter Kulturbedingungen fast verloren zu gehen scheinen (~ 75 % Reduktion) 32 . Trotzdem stellten wir fest, dass Calcitriol die KCNK3 -mRNA-Expression in kultivierten PASMC sowohl aus Kontrollgruppen als auch aus PAH-Patienten signifikant hochregulieren kann 26 . Die antiproliferativen Effekte von Calcitriol wurden jedoch durch die KCNK3- Hemmung nicht beeinflusst, was darauf hindeutet, dass die Hochregulierung von KCNK3 nicht zur durch Calcitriol induzierten antiproliferativen Wirkung beiträgt. Dennoch wird erwartet, dass die Erhöhung der KCNK3- Expression die TASK-1-Funktion steigern und verbessern und dadurch die PA-Vasokonstriktion bei PAH-Patienten begrenzen kann.Ein Ungleichgewicht zwischen den BMPRII- und Transforming Growth Factor-β (TGF-β)-Signalwegen ist ein bekanntes Kennzeichen der PAH 33. Ein Funktionsverlust durch Mutation des BMPR2 -Gens oder eine herunterregulierte oder gestörte BMPRII-Signalgebung führt zu einer abnormen Proliferation von PASMC 34 , 35. Entsprechend stellten wir nach der Stilllegung von BMPR2 in PASMC eine erhöhte Proliferation fest. Interessanterweise deuten unsere Ergebnisse darauf hin, dass der Verlust des BMPR2 -Gens oder die pharmakologische Hemmung des kanonischen BMPRII-Signalwegs die antiproliferative Wirkung von Calcitriol in kultivierten menschlichen PASMC teilweise verringerte, was darauf hindeutet, dass der BMPRII-Signalweg eine Rolle bei der Hemmung des Zellwachstums in PASMC durch VDR spielt. Die Hemmung des nicht-kanonischen Smad-unabhängigen Signalwegs der BMPR2-Signalgebung mit p38- oder ERK-MAPK-Hemmern hatte jedoch keinen Einfluss auf die antiproliferative Wirkung von Calcitriol. Die Aktivierung des BMPR2-Signalwegs wird möglicherweise zumindest teilweise durch den Liganden BMP4 vermittelt, dessen Expression nach einer Calcitriol-Behandlung in menschlichen PASMC erhöht ist. Dementsprechend wurde in einigen früheren Studien festgestellt, dass BMP4 ein Ziel von VDR in VSMC 30 , 36 und in anderen Zelltypen sein könnte. Im Zusammenhang mit PAH sind BMP4 und seine antiproliferativen Wirkungen über einen kanonischen Smad-abhängigen Signalweg verringert 37 , 38 , 39. Daher können Wirkstoffe, die die BMP/Smad-Signalgebung in PASMC verstärken, die wachstumshemmenden Wirkungen von BMP4 wiederherstellen. Bei vitD-defizienten Ratten stellten wir auch eine verringerte BMP4- und BMP6- Expression in der Lunge fest 26. Darüber hinaus schwächte die Calcitriol-Behandlung die Hochregulierung von Tgfβ2 bei PAH-Tieren ab 24. Unsere In-vitro-Daten in Kontroll-PASMC zeigten jedoch, dass Calcitriol die TGFβ- Expression nicht verringerte .Das Survivin-Protein, das durch das BIRC5 -Gen kodiert wird, gehört zur Familie der Apoptose-Inhibitoren. Im Zusammenhang mit PAH ist Survivin in PA von PAH-Patienten und in experimentellen PAH-Modellen hochreguliert 40 , 41. Sowohl in vitro als auch in vivo induziert die Hemmung von Survivin die Apoptose von PASMC, verringert die Proliferation und erhöht die Kv-Kanal-Aktivität 40 , 41. Frühere veröffentlichte Studien haben berichtet, dass Calcitriol Survivin negativ reguliert und diese Herunterregulierung für die antiproliferativen Wirkungen von Calcitriol in verschiedenen Arten von Krebszellen essentiell ist 42 , 43. Ebenso haben wir festgestellt, dass Calcitriol die BIRC5 -Genexpression in Kontroll-PASMCs verringert. Außerdem unterdrückte die Stilllegung von BIRC5 die antiproliferative Wirkung von Calcitriol, gemessen durch BrdU-Einbau, obwohl es die durch MTT gemessene Lebensfähigkeit nicht beeinflusste. Wir haben diese Ergebnisse mit der Verbindung YM155 bestätigt, die die Expression dieses Proteins durch Hemmung seines Promotors blockiert und den systolischen Druck im rechten Ventrikel sowie die pulmonale Gefäßumgestaltung in einem Tiermodell von PAH 44 reduziert . Insgesamt deuten die Daten darauf hin, dass Calcitriol die PASMC-Proliferation zumindest teilweise durch die Unterdrückung von Survivin hemmt.Schließlich stellten wir fest, dass Calcitriol keine akute Vasodilatation bei präkontraktierter menschlicher PA induzierte, was eine Regulierung des pulmonalen Gefäßtonus durch VDR über nicht-genomische Mechanismen ausschließt. Dies schließt jedoch nicht aus, dass VDR langfristige Auswirkungen auf den Gefäßtonus hat. Tatsächlich zeigen Mäuse mit endothelialer spezifischer Deletion des Vdr -Gens und Ratten mit Vitamin-D-Mangel eine endotheliale Dysfunktion 26 , 45 . Darüber hinaus löste Calcitriol keine antiproliferative Wirkung bei PAEC aus.Zusammenfassend lässt sich sagen, dass PAH-Patienten nicht nur einen schweren Vitamin-D-Mangel aufweisen, sondern auch eine Verringerung des Lungen-VDR. Calcitriol rettet die VDR-Expression und induziert eine antiproliferative Wirkung in PASMC. Diese Daten untermauern die Ansicht, dass ein Vitamin-D-Mangel zur Pathogenese von PAH beitragen kann. Aus mechanistischer Sicht spielen BMPRII-Signalisierung und Survivin eine Rolle bei der antiproliferativen Wirkung von Calcitriol in PASMC.
Die pulmonal-arterielle Hypertonie (PAH) ist eine multifaktorielle chronische Erkrankung, die durch pulmonal-arterielle Gefäßumbau und pulmonal-arterielle Vasokonstriktion gekennzeichnet ist 1. Ein wesentliches Kennzeichen ist der Gefäßumbau infolge einer übermäßigen und unkontrollierten Proliferation und Apoptoseresistenz von PA-Glattmuskelzellen (PASMC) und Endothelzellen (PAEC), was zu einer Verdickung der Intima und PA-Obliteration führt 2 , 3. Infolgedessen tendiert der rechte Ventrikel (RV) dazu, sich mit kompensatorischer RV-Hypertrophie an die Nachlast anzupassen, was zu RV-Versagen und vorzeitigem Tod führen kann.
In den letzten Jahren haben wir 4 und andere 5 gezeigt, dass Vitamin-D-Mangel (VitD) bei PAH-Patienten viel häufiger auftritt als in der Allgemeinbevölkerung oder sogar im Vergleich zu Patienten mit anderen Herz-Kreislauf-Erkrankungen. Bei PAH-Patienten oder Tiermodellen sind niedrigere VitD-Werte verbunden mit einer schlechteren Funktionsklasse, einer verkürzten 6-Minuten-Gehstrecke, einem erhöhten mittleren pulmonalarteriellen Druck (mPAP), einem erhöhten pulmonalvaskulären Widerstand, höheren BNP-/Pro-BNP-Werten, einer verringerten Herzleistung, einem verringerten therapeutischen Ansprechen auf Phosphodiesterase-5-Hemmer und/oder einer verringerten Überlebensrate 4 , 5 , 6 , 7 .
Die aktive Form von VitD, 1,25(OH) 2VitD (also Calcitriol) aktiviert den VitD-Rezeptor (VDR), einen Transkriptionsfaktor, der die Expression spezifischer Zielgene reguliert 8 . VDR wird in vielen Geweben und Zelltypen exprimiert, einschließlich Endothel- und glatten Muskelzellen. Es übt eine Vielzahl von Wirkungen aus, die nichts mit seinen bekannten Auswirkungen auf die Kalzium- und Phosphorhomöostase zu tun haben, also den sogenannten nicht-kalzämischen Wirkungen. Diese Wirkungen sind möglicherweise für Schlüsselprozesse im Herz-Kreislauf- und Atmungssystem relevant, wie etwa Zellproliferation, -differenzierung und -migration, Kontrolle des Gefäßtonus, Immunmodulation und Regulierung des Stoffwechsels, um nur einige zu nennen 9 .
Die Rolle von VDR im Lungengefäßsystem und bei PAH ist noch nicht erforscht. Ziel der vorliegenden Studie ist es, das Vorkommen, das Expressionsprofil und die durch VDR vermittelten Effekte im Lungengefäßsystem, seine antiproliferative Rolle bei PAH und den potenziellen Mechanismus zu charakterisieren.
ErgebnisseDie Expression des Lungen -VDR -Gens ist bei PAH herunterreguliertWir haben in einem öffentlichen Transkriptom-Datensatz nach der Expression von VDR gesucht und dabei 27 verschiedene Organe verglichen. Die VDR-Expression in der Lunge war niedriger als in gastrointestinalen Organen, den Nieren und der Haut, aber höher als in den meisten anderen Organen (Abb. 1 A). In einer anderen öffentlichen Transkriptom-Datenbank (GSE117261) war die VDR-Lungenexpression bei PAH-Patienten im Vergleich zu Kontrollpersonen herunterreguliert (Abb. 1 B, Kontrolle vs. alle PAH, p < 0,05, Mann-Whitney-Test). Die VDR-Lungenexpression unterschied sich zwischen den verschiedenen PAH-Untergruppen nicht signifikant (einfaktorielle ANOVA, Abb. 1






DiskussionIn der vorliegenden Studie haben wir die Expression und den Ort von VDR sowie die von diesem Rezeptor vermittelten Wirkungen im Lungengefäßsystem und seine mögliche Rolle bei PAH untersucht. Zum ersten Mal haben wir Beweise dafür geliefert, dass (1) VDR in mehreren Zelltypen in der Lunge exprimiert wird, einschließlich PASMC, (2) es in Lungen und PASMC von PAH-Patienten herunterreguliert ist, (3) eine Behandlung mit Calcitriol die Expression von VDR retten kann, (4) es KCNK3 und BMP4 hochreguliert und die Expression des Survivin-Gens in PASMC herunterreguliert und schließlich (5) es eine antiproliferative Wirkung in PASMC ausübt, indem es die Survivin- und BMP-Signalwege moduliert. Calcitriol hatte jedoch keine antiproliferative Wirkung in PAEC und keine direkte gefäßerweiternde Wirkung bei menschlichen PA.Das VDR- Genexpressionsmuster in der NCBI-Datenbank steht im Einklang mit der Tatsache, dass die Gewebe mit dem höchsten VDR-Gehalt diejenigen sind, die mit der Aufrechterhaltung der Kalziumhomöostase in Verbindung stehen. So ist VDR im gesamten Dünndarm vom Zwölffingerdarm über das Ileum bis hin zum Dickdarm weit verbreitet, insbesondere in den Darmepithelzellen, um die Kalziumaufnahme zu fördern, und in den distalen Nierentubuli, um die Kalziumrückaufnahme zu regulieren 12. Außer dieser Organgruppe gibt es eine weitere Gewebegruppe mit geringerer, aber beträchtlicher VDR-Expression, darunter die Lunge. Frühere Studien haben gezeigt, dass VDR in menschlichen Bronchialepithelzellen exprimiert wird 13. Zudem wurde VDR in kultivierten menschlichen PASMC exprimiert, während die Expression in PAEC deutlich geringer war. Immunhistochemie und sc-RNAseq bestätigten, dass VDR in mehreren vaskulären Zelltypen exprimiert wird, darunter – in absteigender Reihenfolge – Fibroblasten und Perizyten, glatte Muskelzellen und Endothelzellen.Frühere Studien unserer und anderer Gruppen 4 , 5 , 6 , 7 haben gezeigt, dass Vitamin-D-Mangel bei PAH wesentlich häufiger auftritt als in der Gesamtbevölkerung und dass bemerkenswerterweise niedrige Gesamt-25(OH)-Vitamin-D-Spiegel mit einer schlechten Prognose verbunden sind. Bislang hat jedoch keine dieser Studien die Rolle von VDR bei PAH untersucht. Zunächst analysierten wir VDR in der öffentlich zugänglichen Transkriptomdatenbank GSE117261 14. Die Analyse zeigte, dass die VDR-Expression in den Lungen von PAH-Patienten herunterreguliert ist. Außerdem haben wir per qPCR und Western Blot bestätigt, dass die VDR-Expression in den Lungen einer Kohorte spanischer PAH-Patienten im Vergleich zu den Lungen von Transplantationsspendern verringert ist. In sc-RNAseq-Experimenten scheint VDR in Gefäßzellen bei PAH reduziert zu sein, nicht aber in Immunzellen. Aufgrund der geringen Stichprobengröße (n = 3) und der begrenzten Sequenzierungstiefe lassen die Daten keine sichere Schlussfolgerung zu, ob VDR in einem bestimmten Gefäßzelltyp reduziert ist oder nicht. Wir untersuchten außerdem den VDR-Ausdruck in kultivierten menschlichen PASMC und PAEC aus Kontrollgruppen und PAH. In kultivierten PASMC wurde eine Herunterregulierung der VDR-mRNA bestätigt. In PAEC war der VDR-Ausdruck jedoch geringer und wir stellten keine Unterschiede zwischen Kontrollgruppen und PAH-Patienten fest. Bemerkenswerterweise werden niedrige VDR-Werte in der Lunge mit verschiedenen Lungenerkrankungen assoziiert, darunter COPD 15 und idiopathische Lungenfibrose 16 , und korrelieren mit einer schlechteren Prognose. Homozygote VDR-defiziente Mäuse weisen Veränderungen an den anhaftenden Verbindungen in der Lunge auf, was darauf hindeutet, dass VDR eine wichtige Rolle bei der Aufrechterhaltung der Integrität der Lungenbarriere 17 und bei pulmonalen Gefäßveränderungen, darunter hochregulierte Kv7-Kanalaktivität 18 , spielen könnte .Das VDR-Gen kann gewebespezifisch durch verschiedene Faktoren reguliert werden, zu denen auch sein aktivster Ligand Calcitriol gehört. Es besteht daher eine physiologische positive Rückkopplungsschleife zwischen den Calcitriolwerten und der VDR-Expression 19 . Diese Autoregulation wurde in vielen verschiedenen Zellen beobachtet. Sie kann durch eine erhöhte Transkription des VDR-Gens verursacht werden, die mit dem Vorhandensein eines Vitamin-D-Response-Elements (VDRE) in der Promotorregion des VDR-Gens einhergeht, sowie durch eine Stabilisierung von VDR, wodurch die Rezeptordegradation abnimmt. In Übereinstimmung mit dieser Ansicht zeigten unsere früheren Ergebnisse, dass PAH-Patienten einen schweren Vitamin-D-Mangel aufwiesen und wir zeigen nun auch bei diesen Patienten eine verringerte VDR-Expression in der Lunge. Daher fragten wir uns, ob eine Calcitriol-Behandlung die herunterregulierte VDR-Expression in PAH-PASMC retten könnte. Unsere Ergebnisse zeigten, dass die VDR -mRNA-Expression durch Calcitriol stark hochreguliert wird. Bemerkenswerterweise erreichte die VDR- Expression in PAH-PASMC nach 48-stündiger Calcitriol-Behandlung ähnliche Werte wie in Kontroll-PASMC.Die Entdeckung von VDR in vielen Geweben, die nicht an der Kalzium- und Phosphorhomöostase beteiligt sind, führte zur Identifizierung einer großen Bandbreite von durch VDR vermittelten Funktionen, die möglicherweise bei Herz-Kreislauf-Erkrankungen relevant sind, wie Zellproliferation, -differenzierung und -apoptose, Zelladhäsion, oxidativer Stress, Angiogenese und entzündungshemmende Aktivität 9 . Daher untersuchten wir einige potenzielle VDR-vermittelte Effekte, die bei PAH von Interesse sind, darunter auch jene auf die Zellproliferation.Es wurde gezeigt, dass VitD-Metaboliten die Zellproliferation über mehrere Mechanismen verändern. Calcitriol zeigte sowohl in normalen als auch in pathologischen Situationen eine antiproliferative Wirkung, darunter in aus Krebs stammenden Zelllinien und vaskulären glatten Muskelzellen (VSMC) 20 , 21 , 22 , 23. Dementsprechend haben wir herausgefunden, dass Calcitriol in vitro eine antiproliferative Wirkung auf menschliche PASMC hat. Bemerkenswerterweise wurde die hemmende Wirkung von Calcitriol auf das Zellwachstum auch bei PASMC von PAH-Patienten beobachtet. Tatsächlich schwächte die Calcitriol-Behandlung die pulmonale vaskuläre Umgestaltung in einem PAH-Tiermodell ab 24. Unsere Ergebnisse zeigen, dass Calcitriol die Expression des herunterregulierten VDR in PASMC von PAH-Patienten rettet, um antiproliferative Wirkungen zu erzielen. Die nukleäre Lokalisierung von VDR scheint notwendig zu sein, um antiproliferative Wirkungen auszuüben, wie sie bei anderen Zelltypen berichtet wurden. Bei Brustkrebs beispielsweise fördert in Abwesenheit eines Liganden die Ansammlung von VDR im Zytoplasma das Zellwachstum, im Gegensatz zur antiproliferativen nukleären Wirkung des Calcitriol-VDR-Komplexes 25 .Als nächstes analysierten wir mehrere mögliche Ziele von VDR, die an der antiproliferativen Wirkung beteiligt sind. Wir wählten den BMPR2-Signalweg, TASK1 und Survivin, weil diese bekanntermaßen an PAH beteiligt sind und weil wir fanden, dass sie in den Lungen von Ratten mit Vitamin-D-Mangel dysreguliert sind 26. Funktionsverlustmutationen und Herunterregulierung von KCNK3 (Gen, das den Kaliumkanal TASK-1 kodiert) kommen bei erblicher und idiopathischer PAH vor und tragen zur verstärkten pulmonalarteriellen Vasokonstriktion und zur Proliferation von PASMC und PAEC bei, was zu einer Umgestaltung der pulmonalarteriellen Erkrankungen führt 27 , 28. Einige Berichte haben gezeigt, dass KCNK3 ein Ziel von VDR sein könnte 29 , 30 , 31 und wir haben außerdem ein VDRE im KCNK3- Genpromotor identifiziert 26 . Es muss hervorgehoben werden, dass die Expression und Aktivität von KCNK3 in VSMC unter Kulturbedingungen fast verloren zu gehen scheinen (~ 75 % Reduktion) 32 . Trotzdem stellten wir fest, dass Calcitriol die KCNK3 -mRNA-Expression in kultivierten PASMC sowohl aus Kontrollgruppen als auch aus PAH-Patienten signifikant hochregulieren kann 26 . Die antiproliferativen Effekte von Calcitriol wurden jedoch durch die KCNK3- Hemmung nicht beeinflusst, was darauf hindeutet, dass die Hochregulierung von KCNK3 nicht zur durch Calcitriol induzierten antiproliferativen Wirkung beiträgt. Dennoch wird erwartet, dass die Erhöhung der KCNK3- Expression die TASK-1-Funktion steigern und verbessern und dadurch die PA-Vasokonstriktion bei PAH-Patienten begrenzen kann.Ein Ungleichgewicht zwischen den BMPRII- und Transforming Growth Factor-β (TGF-β)-Signalwegen ist ein bekanntes Kennzeichen der PAH 33. Ein Funktionsverlust durch Mutation des BMPR2 -Gens oder eine herunterregulierte oder gestörte BMPRII-Signalgebung führt zu einer abnormen Proliferation von PASMC 34 , 35. Entsprechend stellten wir nach der Stilllegung von BMPR2 in PASMC eine erhöhte Proliferation fest. Interessanterweise deuten unsere Ergebnisse darauf hin, dass der Verlust des BMPR2 -Gens oder die pharmakologische Hemmung des kanonischen BMPRII-Signalwegs die antiproliferative Wirkung von Calcitriol in kultivierten menschlichen PASMC teilweise verringerte, was darauf hindeutet, dass der BMPRII-Signalweg eine Rolle bei der Hemmung des Zellwachstums in PASMC durch VDR spielt. Die Hemmung des nicht-kanonischen Smad-unabhängigen Signalwegs der BMPR2-Signalgebung mit p38- oder ERK-MAPK-Hemmern hatte jedoch keinen Einfluss auf die antiproliferative Wirkung von Calcitriol. Die Aktivierung des BMPR2-Signalwegs wird möglicherweise zumindest teilweise durch den Liganden BMP4 vermittelt, dessen Expression nach einer Calcitriol-Behandlung in menschlichen PASMC erhöht ist. Dementsprechend wurde in einigen früheren Studien festgestellt, dass BMP4 ein Ziel von VDR in VSMC 30 , 36 und in anderen Zelltypen sein könnte. Im Zusammenhang mit PAH sind BMP4 und seine antiproliferativen Wirkungen über einen kanonischen Smad-abhängigen Signalweg verringert 37 , 38 , 39. Daher können Wirkstoffe, die die BMP/Smad-Signalgebung in PASMC verstärken, die wachstumshemmenden Wirkungen von BMP4 wiederherstellen. Bei vitD-defizienten Ratten stellten wir auch eine verringerte BMP4- und BMP6- Expression in der Lunge fest 26. Darüber hinaus schwächte die Calcitriol-Behandlung die Hochregulierung von Tgfβ2 bei PAH-Tieren ab 24. Unsere In-vitro-Daten in Kontroll-PASMC zeigten jedoch, dass Calcitriol die TGFβ- Expression nicht verringerte .Das Survivin-Protein, das durch das BIRC5 -Gen kodiert wird, gehört zur Familie der Apoptose-Inhibitoren. Im Zusammenhang mit PAH ist Survivin in PA von PAH-Patienten und in experimentellen PAH-Modellen hochreguliert 40 , 41. Sowohl in vitro als auch in vivo induziert die Hemmung von Survivin die Apoptose von PASMC, verringert die Proliferation und erhöht die Kv-Kanal-Aktivität 40 , 41. Frühere veröffentlichte Studien haben berichtet, dass Calcitriol Survivin negativ reguliert und diese Herunterregulierung für die antiproliferativen Wirkungen von Calcitriol in verschiedenen Arten von Krebszellen essentiell ist 42 , 43. Ebenso haben wir festgestellt, dass Calcitriol die BIRC5 -Genexpression in Kontroll-PASMCs verringert. Außerdem unterdrückte die Stilllegung von BIRC5 die antiproliferative Wirkung von Calcitriol, gemessen durch BrdU-Einbau, obwohl es die durch MTT gemessene Lebensfähigkeit nicht beeinflusste. Wir haben diese Ergebnisse mit der Verbindung YM155 bestätigt, die die Expression dieses Proteins durch Hemmung seines Promotors blockiert und den systolischen Druck im rechten Ventrikel sowie die pulmonale Gefäßumgestaltung in einem Tiermodell von PAH 44 reduziert . Insgesamt deuten die Daten darauf hin, dass Calcitriol die PASMC-Proliferation zumindest teilweise durch die Unterdrückung von Survivin hemmt.Schließlich stellten wir fest, dass Calcitriol keine akute Vasodilatation bei präkontraktierter menschlicher PA induzierte, was eine Regulierung des pulmonalen Gefäßtonus durch VDR über nicht-genomische Mechanismen ausschließt. Dies schließt jedoch nicht aus, dass VDR langfristige Auswirkungen auf den Gefäßtonus hat. Tatsächlich zeigen Mäuse mit endothelialer spezifischer Deletion des Vdr -Gens und Ratten mit Vitamin-D-Mangel eine endotheliale Dysfunktion 26 , 45 . Darüber hinaus löste Calcitriol keine antiproliferative Wirkung bei PAEC aus.Zusammenfassend lässt sich sagen, dass PAH-Patienten nicht nur einen schweren Vitamin-D-Mangel aufweisen, sondern auch eine Verringerung des Lungen-VDR. Calcitriol rettet die VDR-Expression und induziert eine antiproliferative Wirkung in PASMC. Diese Daten untermauern die Ansicht, dass ein Vitamin-D-Mangel zur Pathogenese von PAH beitragen kann. Aus mechanistischer Sicht spielen BMPRII-Signalisierung und Survivin eine Rolle bei der antiproliferativen Wirkung von Calcitriol in PASMC.
OMNIA TEMPUS HABENT
Diagnose IPAH im Februar 2013, in Behandlung bei OA Dr. Ulrich Krüger, jetzt Dr. Fischer Herzzentrum Duisburg, Medikamente: Sildenafil, Bosentan jetzt Macitentan, Subkutane Treprostinilpumpe, seit Januar 2024 getunnelter ZVK mit externer Pumpe (Groshongkatheter), 24/7 Sauerstoff, Marcumar, Diuretika
Bitte Anmelden oder Registrieren um der Konversation beizutreten.
