- Beiträge: 1751
Sidebar
Perspektiven Sotatercept
28 Feb 2025 15:16 #2357
von danny
OMNIA TEMPUS HABENT
Diagnose IPAH im Februar 2013, in Behandlung bei OA Dr. Ulrich Krüger, jetzt Dr. Fischer Herzzentrum Duisburg, Medikamente: Sildenafil, Bosentan jetzt Macitentan, Subkutane Treprostinilpumpe, seit Januar 2024 getunnelter ZVK mit externer Pumpe (Groshongkatheter), 24/7 Sauerstoff, Marcumar, Diuretika
Perspektiven Sotatercept wurde erstellt von danny
pmc.ncbi.nlm.nih.gov/articles/PMC11547004/
Perspektiven zu Sotatercept bei pulmonaler arterieller Hypertonie Rosalinda Madonna 1, 2, * , Filippo Biondi 1
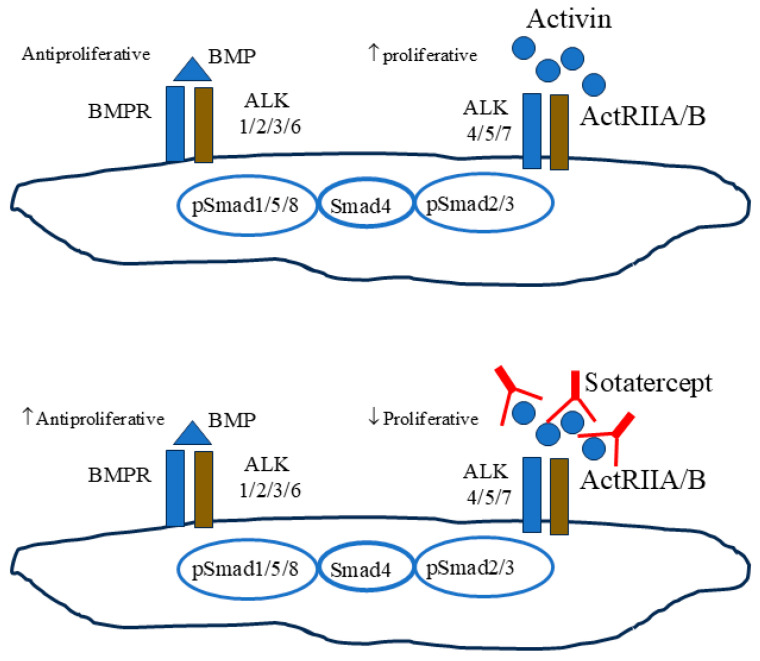 Sotatercept fungiert als Ligandenfalle für Activin. Sotatercept bindet überschüssige ActRIIA-Liganden und reduziert dadurch die ActRIIA–Smad2/3-Signalgebung, um wachstumsfördernde und wachstumshemmende Signale wieder ins Gleichgewicht zu bringen. Legende zur Abbildung: BMPR, BMP-Rezeptor Typ 2; ALK, Activin-Rezeptor-ähnliche Kinase; ActRIIA/B, Activin-Typ-II-Rezeptoren.3. Präklinische Erkenntnisse zum gezielten Ansprechen des Activin-Signalwegs in PAH-ModellenDie potenzielle therapeutische Rolle des gezielten Angriffs auf den Activin-Signalweg mittels Sotatercept bei menschlicher PAH wird durch umfangreiche präklinische Daten aus Tiermodellen gestützt, die den Sotatercept-Signalweg nachahmen. Sotatercept ist ein Activin-Rezeptor-Typ IIA-Fc (ActRIIA-Fc), ein IgGq-Fc-Fusionsprotein mit derselben extrazellulären Domäne wie ACTRIIA [
12
]. Das Sugen-Hypoxie-Rattenmodell für schwere angioobliterative PAH zeigte, dass die Behandlung mit ActRIIa-Fc die proinflammatorische und proliferative Genexpression umkehrte [
12
]. Darüber hinaus wurde die Makrophageninfiltration in den Lungen von Nagetieren gemildert [
12
]. Yung et al. testeten einen selektiven Inhibitor des transformierenden Wachstumsfaktors Beta-Rezeptor II (TGFBRII) an durch Monocrotalin und Hypoxie induzierter pulmonaler Hypertonie bei Ratten und dokumentierten Verbesserungen der pulmonalvaskulären Umgestaltung und Hämodynamik [
13
]. Diese Gruppe berichtete über ähnliche Ergebnisse bei der Verwendung von ACTRIIA-Fc sowohl prophylaktisch als auch nach Auftreten einer hämodynamisch schweren pulmonalen Hypertonie in verschiedenen Tiermodellen [
11
]. Die Blockierung von ALK5 (Activin-ähnliche Kinase 5) erwies sich in einem Rattenmodell mit durch Monocrotalin induzierter pulmonaler Hypertonie als vorteilhaft [
14
]. Histologisch wurde beobachtet, dass die günstigen Auswirkungen auf die pulmonale Gefäßumgestaltung durch eine Abnahme der frühen Gefäßzellapoptose, der Proliferation von Adventitiazellen und der Metalloproteinaseexpression vermittelt werden [
15
]. Mechanistisch gesehen schwächt die Hemmung des ALK5-Signalwegs die SMAD2-Phosphorylierung ab [
13
]. Es wurde gezeigt, dass der pro-proliferative Activin-SMAD2-Signalweg in den Lungengefäßen von PAH-Ratten hochreguliert ist [
16
], und dieser Befund konnte kürzlich bei der menschlichen idiopathischen PAH repliziert werden. Bei Patienten mit idiopathischer PAH (iPAH) war die Smad2-Signalübertragung erhöht, und die Konzentration von Activin A korrelierte signifikant mit Mortalität und Lungentransplantation [
17
]. Zusammenfassend ergibt sich ein klares pathogenetisches Modell für PAH: Die BMPR2-vermittelte antiproliferative Signalübertragung ist reduziert, während der ActRIIA-SMAD2-Signalweg an Bedeutung gewinnt und durch seine pro-proliferativen Effekte zu einer vaskulären Umgestaltung führt [
11
].4. Interventionelle Studien und laufende registrierte Studien zu Activin-Inhibitoren in der PAH-Gruppe 1Activin-Inhibitoren wurden und werden derzeit in mehreren randomisierten kontrollierten Studien (RCTs) getestet. Die PULSAR-Studie [
18
], eine RCT der Phase II, war eine 24-wöchige multizentrische Studie, in der 106 Patienten mit PAH randomisiert subkutan Sotatercept in zwei verschiedenen Dosierungen (0,3 mg/kg und eine weitere Dosis) oder ein Placebo erhielten. Die Teilnehmer hatten eine lange PAH-Vorgeschichte. Seit der Diagnose waren insgesamt 7,7 ± 5,6 Jahre vergangen, und sie wiesen leichte bis mittelschwere Funktionsstörungen auf (WHO FC II-III). Alle Patienten erhielten eine PAH-Hintergrundtherapie, wobei bis zu 53 % eine dreifache vasodilatatorische Therapie erhielten. Die Studie erreichte ihren primären Zielparameter und zeigte eine Abnahme des pulmonalvaskulären Widerstands (PVR) für beide Arzneimittelschemata sowie Verbesserungen bei der 6-Minuten-Gehstrecke (6MWD) und dem N-terminalen pro-b-Typ natriuretischen Peptid (NT-pro-BNP). Es traten keine schwerwiegenden Sicherheitsprobleme auf. Die wichtigsten Nebenwirkungen waren Thrombozytopenie und erhöhte Hämoglobinwerte. 97 Patienten setzten die Behandlung in einer 24-monatigen offenen Verlängerungsphase fort, wobei die Patienten aus der Placebogruppe auf Sotatercept umstiegen. Die Ergebnisse zur Wirksamkeit zeigten, dass die Verbesserungen bei PVR, 6MWD und NT-pro-BNP in der Crossover-Gruppe mit denen der Patienten, die weiterhin Sotatercept einnahmen, vergleichbar waren. 98 % der Teilnehmer berichteten von Nebenwirkungen, die hauptsächlich mit der Behandlung zusammenhingen. Thrombozytopenie und erhöhte Hämoglobinwerte blieben die häufigsten Nebenwirkungen, während Teleangiektasien bei 11 % der Teilnehmer auftraten. Bemerkenswert ist, dass das Medikament bei fast 10 % der Patienten abgesetzt werden musste. Sechs schwerwiegende Nebenwirkungen standen im Zusammenhang mit Sotatercept, darunter Fälle von Lupus erythematodes und ischämischem Schlaganfall.An der STELLAR-Studie [
2
], einer randomisierten kontrollierten Studie der Phase III, nahmen 323 Patienten teil und wurden randomisiert entweder mit Placebo oder Sotatercept behandelt. Die Ausgangsdosis betrug 0,3 mg/kg und wurde bis zu einem Zielwert von 0,7 mg/kg gesteigert. Die Studie erreichte ihren primären Zielparameter und zeigte eine statistisch und klinisch signifikante Verbesserung der 6MWD mit einer geschätzten Differenz vom Ausgangswert von 40,8 m (27,5 zu 54,1). Sekundäre Zielparameter wurden hierarchisch getestet und acht waren statistisch signifikant. Wichtig ist, dass die Zeit bis zum ersten Auftreten eines Todesfalls oder einer nicht tödlichen klinischen Verschlechterung in der Sotatercept-Gruppe signifikant verbessert wurde, mit einer Hazard Ratio von 0,16 (0,08 zu 0,35). Die Zeit bis zur klinischen Verschlechterung ist ein Surrogatendpunkt, dessen Beziehung zu Krankenhausaufenthalt und Tod sich als konsistenter erwiesen hat als die der 6MWD [
2
]. In Bezug auf die Verträglichkeit und Sicherheit des Arzneimittels erreichte nur ein Patient die Höchstdosis nicht, und schwere Nebenwirkungen traten in der Placebogruppe häufiger auf als in der Sotatercept-Gruppe. Blutungen, Thrombozytopenie, erhöhte Hämoglobinwerte und Teleangiektasien traten jedoch in der Behandlungsgruppe häufiger auf, was mit den Daten der PULSAR-Studie und ihrer Erweiterung übereinstimmt. Weitere Daten zur Sicherheit und Wirksamkeit von Sotatercept werden in der laufenden SOTERIA-Studie (A Long-term Follow-up Study of Sotatercept for PAH Treatment,
NCT04796337
) bereitgestellt, der offenen Erweiterung von STELLAR.Da proteinbasierte Medikamente Immunreaktionen auslösen können, die ihre Pharmakokinetik und Pharmakodynamik verändern können, wurde außerdem eine parallele Studie an der STELLAR-Kohorte durchgeführt, um das Auftreten neutralisierender Antikörper gegen Sotatercept zu untersuchen [
19
]. Ihre Prävalenz war mit 6,7 % bemerkenswert, es zeigten sich jedoch keine klaren Auswirkungen auf die Sicherheit und Wirksamkeit der Behandlung. Schließlich untersuchte die SPECTRA-Studie [
20
], eine offene explorative Phase-II-Studie, die Auswirkungen von Sotatercept auf die Herzfunktion und -struktur bei kardiopulmonalen Belastungstests und kardialer Magnetresonanz in einem einarmigen Design. Sie kam zu dem Schluss, dass die Behandlung die maximale Sauerstoffaufnahme verbesserte und das umgekehrte Remodeling des rechten Ventrikels bestimmte. Die kleine Stichprobengröße (21 Teilnehmer), das Vorher-Nachher-Studiendesign und das Fehlen eines Vergleichspräparats stellen jedoch erhebliche Einschränkungen dar.Mehrere laufende registrierte klinische Studien untersuchen die Sicherheit und Wirksamkeit von Sotatercept bei bestimmten Patientengruppen, die in früheren RCTs nicht berücksichtigt wurden. MOONBEAM (NCT05597712) wird die Sicherheit und Verträglichkeit der Activin-Hemmung bei Kindern mit PAH klären. HYPERION (Studie zu Sotatercept an Teilnehmern mit neu diagnostizierter PAH mit mittlerem und hohem Risiko,
NCT04811092
) nimmt neu diagnostizierte PAH-Patienten mit mittlerem oder hohem Progressionsrisiko auf, angezeigt durch einen REVEAL-Score ≥ 6 oder einen COMPERA-Score ≥ 2. ZENITH (Eine Studie zu Sotatercept an Teilnehmern mit PAH WHO FC III oder FC IV mit hohem Sterberisiko,
NCT04896008
) testet Sotatercept an einer PAH-Kohorte mit mittelschwerer bis schwerer Funktionsbeeinträchtigung (FC III-IV) und hohem Sterberisiko (COMPERA ≥ 9).5. Lücken in der Evidenz und Probleme mit vorhandenen RCTsTrotz der beeindruckenden Ergebnisse von PULSAR und STELLAR, die zur Zulassung als erste nicht-vasodilatatorische Therapie für PAH [
2
] geführt haben, ist die Evidenz zu Sotatercept in vielerlei Hinsicht begrenzt, und einige Fragen müssen noch weiter geklärt werden. Insbesondere wird die externe Validität von PULSAR und STELLAR durch die strengen Einschlusskriterien und die demografischen und klinischen Merkmale der eingeschlossenen Kohorte eingeschränkt, und einige Aspekte der Nebenwirkungen von Sotatercept müssen noch weiter geklärt werden.Bezüglich der Einschlusskriterien schlossen beide Studien neu diagnostizierte Patienten, Patienten mit schwerer Funktionsbeeinträchtigung (d. h. FC WHO IV) und – vielleicht am wichtigsten – Patienten mit kardialen und/oder pulmonalen Komorbiditäten aus. Darüber hinaus wendete STELLAR strenge hämodynamische Einschlusskriterien an, um PAH-Gruppe 1 mit einer rein präkapillären Komponente (präkapillärer Verschlussdruck < 15 mmHg) und fortgeschrittener pulmonaler vaskulärer Umgestaltung [pulmonaler vaskulärer Widerstand (PVR) > 5 Wood-Einheiten (WU)] auszuwählen. Es ist zu beachten, dass zwar der erste Parameter der Definition der präkapillären PAH entspricht, der zweite jedoch deutlich über dem aktuellen Grenzwert für PAH-Gruppe 1 (PVR = 2 WU) liegt. Es ist seit langem bekannt, dass kardiale und pulmonale Komorbiditäten das Ansprechen auf eine vasodilatatorische PAH-Therapie beeinflussen und insbesondere die Wirksamkeit und/oder Verträglichkeit kombinierter pulmonaler Vasodilatatoren beeinträchtigen [
21
]. Angesichts der hohen und weiter steigenden Prävalenz komorbider PAH könnte der derzeitige Mangel an Daten zu Sotatercept in diesem Zusammenhang die Auswirkungen dieses Medikaments auf die PAH-Population insgesamt stark einschränken. Während laufende Studien speziell versuchen, die Lücke in Bezug auf neue PAH-Diagnosen (
NCT04811092
) und PAH-Patienten mit fortgeschrittener Erkrankung und/oder funktionellen Einschränkungen (
NCT04896008
) zu schließen, gibt es keine registrierte interventionelle oder Beobachtungsstudie zu PAH mit Komorbiditäten. Wie dies bei pulmonalen Vasodilatatoren der Fall war [
22
], werden mit dem Einzug von Sotatercept in die klinische Praxis nützliche Daten über seine Wirksamkeit und Sicherheit im realen Umfeld mit stark komorbiden Erkrankungen aus Registern stammen. Allerdings sind solche Informationen anfällig für Verzerrungen [
23
,
24
] und können den Ausschluss komorbider PAH aus randomisierten kontrollierten Studien sicherlich nicht wettmachen. Daher werden RCTs, die sich mit dem komorbiden PAH-Phänotyp befassen, dringend benötigt.Was die demographischen und klinischen Charakteristika der Studienkohorte betrifft, waren schwarze und asiatische Patienten kaum vertreten, obwohl es Berichte gibt, dass die ethnische Zugehörigkeit einen Einfluss auf die Prognose [
25
] und das Ansprechen auf PAH-Therapien [
26
] hat. Zukünftige Beobachtungsstudien und RCTs müssen sich mit dieser Frage befassen und eine ausreichende Anzahl von Patienten für jede ethnische Gruppe einschließen, um Untergruppenanalysen durchzuführen und den Einfluss der ethnischen Zugehörigkeit auf die Wirksamkeit und Sicherheit von Sotatercept zu klären. Zudem waren die Kohorten in PULSAR und STELLAR beide von langjähriger PAH betroffen (mittlere Zeit seit der Diagnose 8,8 + −7,0 Jahre und 7,7 + −5,6 Jahre) und waren untypisch für den hohen Anteil von Patienten, die eine Doppel- oder Dreifachkombinationstherapie erhielten (94,5 % in STELLAR vs. 46,3 % im COMPERA-Register). In Anbetracht der Tatsache, dass die Überlebenswahrscheinlichkeit von PAH-Patienten in den ersten Jahren nach der Diagnose stärker abnimmt und sich in einem späteren Stadium der CIT tendenziell stabilisiert, könnten RCTs zu Sotatercept eine Kohorte mit einem hohen Anteil optimal behandelter Langzeitüberlebender erfasst haben. Darüber hinaus erscheint diese Kohorte von Langzeitüberlebenden aufgrund des hohen Anteils der Dreifachtherapie untypisch, da die aktuellen Leitlinien für Hochrisikopatienten einen rapiden Rückgang der Überlebenschancen vorsehen [
27
]. Dies wirft möglicherweise die Frage auf, ob und in welchem Ausmaß die Vorteile von Sotatercept auch auf typischere, neu diagnostizierte PAH-Patienten zutreffen. Die HYPERION-Studie (
NCT04811092
), eine multizentrische RCT der Phase III, wird diese spezielle Lücke schließen, indem sie Patienten in die Studie aufnimmt, bei denen innerhalb von 12 Monaten PAH diagnostiziert wurde; ihr Abschluss wird jedoch in 5 Jahren erwartet. In der Zwischenzeit hätte eine Untergruppenanalyse der STELLAR-Kohorte nach unterschiedlichen Zeitspannen seit der Diagnose wertvolle Informationen liefern können.Was die hämodynamische Wirkung von Sotatercept betrifft, so zeigte sich, dass dieses ein besonderes Muster aufweist, das sich von dem der pulmonalen Vasodilatatoren unterscheidet. Insbesondere ergab eine spezielle Analyse der STELLAR-Studie [
2
], dass Sotatercept den PVR nicht durch eine Erhöhung des Herzzeitvolumens, das stabil blieb, senkte, sondern durch eine Senkung des mittleren pulmonalarteriellen Drucks (mPAP). Dies steht einerseits im Einklang mit der Vorstellung, dass Sotatercept eher eine systemische vasokonstriktive als eine vasodilatatorische Wirkung hat [
28
]; andererseits stellt es die Vorstellung in Frage, dass das Herzzeitvolumen und nicht mPAP mit dem Überleben bei PAH korreliert [
29 ]. Wie Rubin und Naeije [
29
] anmerkten , ist es außerdem merkwürdig, dass sich der günstige Effekt von Sotatercept auf die Hämodynamik scheinbar in einem relativ begrenzten Zeitrahmen manifestiert und mit der Zeit nicht zunimmt [
30
]. Die Synergie zwischen Sotatercept und anderen vasodilatatorischen Medikamenten in der Hintergrundtherapie könnte die frühe Wirkung von Sotatercept erklären, auch wenn man die umfangreiche Interaktion von Sotatercept mit den NO- und ET-1-Wegen berücksichtigt (siehe Kapitel 2). Während Reverse Remodeling häufig mit pulmonalen Vasodilatatortherapien bei den verschiedenen PAH-Typen in Verbindung gebracht wurde [
31
], wurde dieser Effekt bei mit Sotatercept behandelten Patienten bisher nicht beschrieben. Weitere Informationen über das Zusammenspiel zwischen Sotatercept und verschiedenen PAH-Medikamentenklassen hätten durch eine Untergruppenanalyse der STELLAR-Kohorte nicht nur nach der Anzahl der Medikamente, sondern auch nach der Art der Medikamente gewonnen werden können. Bestimmte Kombinationen können tatsächlich wirksamer sein als andere. Es muss jedoch beachtet werden, dass die STELLAR-Studie wahrscheinlich zu schwach war, um den möglichen Nutzen der Wahl einer Medikamentenkombination gegenüber einer anderen zu erkennen. Laufende RCTs und künftige Metanalysen werden diese Möglichkeit hoffentlich untersuchen.Was die Nebenwirkungen betrifft, so hat Sotatercept eine gut charakterisierte erythropoese-stimulierende Wirkung und wurde zur Behandlung von Anämie bei verschiedenen Erkrankungen getestet [
32
,
33
]. Wie erwartet war Sotatercept in RCTs mit Patienten mit PAH mit einem moderaten Anstieg des Hämoglobinspiegels (Hb) verbunden, wobei der mittlere Hb um 1,3 mg/dL anstieg [
2
]. Bemerkenswert ist, dass sowohl PAH als auch Herzinsuffizienz mit absolutem und funktionellem Eisenmangel verbunden sind [
34
] und Anämie allgemein mit schlechteren Ergebnissen bei beiden Erkrankungen in Verbindung gebracht wurde [
35
,
36
]. Allerdings scheint Erythropoietin bei Herzinsuffizienz (HF) erhöht zu sein und positiv mit der Mortalität zu korrelieren. Darüber hinaus konnte Darpoietin bei HF keine positive Wirkung zeigen und war mit einem höheren Risiko für thromboembolische Ereignisse verbunden [
37
]. Auch Erythropoietin ist bei PAH erhöht [
38
] und hat kürzlich gezeigt, dass es einen anscheinend günstigen Effekt auf die Lungengefäße hat, indem es das Homing und die Endothelzelldifferenzierung in Knochenmarkstammzellen von Ratten fördert [
39
]. Ob die Stimulierung der Erythropoese eine Nebenwirkung oder ein Mediator der Wirksamkeit von Sotatercept ist, ist eine spannende Frage, die noch nicht beantwortet werden kann. Dennoch könnte eine Mediationsanalyse unter Verwendung der Daten der wichtigsten RCTs nützliche Informationen liefern. Angesichts des bekannten Zusammenhangs [
37
,
40
] zwischen Erythropoietin und Erythropoietin-stimulierenden Substanzen und thrombotischen Ereignissen ist zudem eine genaue Überwachung der Inzidenz kardiovaskulärer Nebenwirkungen bei mit Sotatercept behandelten Personen sicherlich gerechtfertigt. Es muss jedoch beachtet werden, dass sich aus den Studien PULSAR und STELLAR keine Hinweise auf ein erhöhtes Thrombose- oder Thromboembolierisiko ergeben haben; im Behandlungsarm der ersteren erlitt nur ein Patient einen Schlaganfall. Da Sotatercept jedoch langfristig angewendet wird, kann ein Anstieg des Thromboserisikos in der Zukunft offensichtlich werden und muss umgehend erkannt werden. Ein weiteres Problem bei randomisierten kontrollierten Studien zu Sotatercept ist die Wahl der 6MWD als primärer Endpunkt in der STELLAR-Studie, was einen Rückschritt im Vergleich zu den jüngeren randomisierten kontrollierten Studien im PAH-Bereich darstellt. In Zulassungsstudien zu PAH-Medikamenten wurde bis zur FREEDOM-C2-Studie aus dem Jahr 2013 das Abschneiden beim 6MWD-Test als primärer Endpunkt verwendet [
41
]. Ab da wurden Morbidität und Mortalität als kombinierte primäre Endpunkte gewählt. Insbesondere wurde das Konzept der Zeit bis zur klinischen Verschlechterung (TTCW) erstmals erfolgreich in einer Studie zu Macitentan [
42
] eingesetzt und später als gültiger primärer Endpunkt für Zulassungsstudien bestätigt. Tatsächlich zeigte sich, dass die TTCW einen Zusammenhang mit Krankenhausaufenthalten und Todesfällen aufweist, der konsistenter ist als der der 6MWD [
43
] und sollte der primäre Endpunkt zukünftiger randomisierter kontrollierter Studien (RCTs) sein, in denen Sotatercept getestet wird. Bemerkenswerterweise zeigte STELLAR eine Verbesserung der TTCW, die in die sekundären Endpunkte aufgenommen wurde. Dies bedeutet jedoch nicht unbedingt eine Verringerung der Mortalität [
44
], was in längerfristigen Studien und/oder Registern untersucht werden muss.6. Könnten die Vorteile einer Sotatercept-Therapie auch auf PH außerhalb der Gruppe 1 angewendet werden?PAH-Gruppe 1 macht nur einen kleinen Teil der PH-Fälle aus, die meist mit einer Linksherzerkrankung (PH-Gruppe 2) verbunden sind [
45
]. Für die mit HF verbundene PH gibt es keine effektiven speziellen Therapien, und ihre Behandlung beschränkt sich auf die optimale Behandlung der zugrunde liegenden Linksherzerkrankung [
46
]. Es wurden große Anstrengungen unternommen, um pulmonale Vasodilatatoren in diesem Zusammenhang zu testen, aber spezielle RCTs haben bestenfalls gemischte Ergebnisse erbracht [
47
], und für die PH-Gruppe 2 wird keine PAH-spezifische Arzneimittelklasse formal empfohlen. Interessanterweise wurde in mehreren Beobachtungsstudien ein Zusammenhang zwischen dem TGF-Signalweg und HF (sowohl akut als auch chronisch) nahegelegt, und zwar so sehr, dass er als zusätzliche Säule der maladaptiven Mechanismen vorgeschlagen wurde, die HF verursachen [
48
]. Es wurde gezeigt, dass Activin A während des Krankenhausaufenthalts negativ mit der linksventrikulären Ejektionsfraktion (LVEF) korreliert und die Überlebensrate nach sechs Monaten verringert. Diese klinischen Befunde werden durch zahlreiche präklinische Studien gestützt. Activin A kann durch Stress des endoplasmatischen Retikulums die Apoptose myokardialer Zellen stimulieren [
49
]. Die Hemmung des ACTRII-Rezeptors bei gealterten Mäusen und Mäusen mit nicht-ischämischem HF führte in konsistenter Weise zu einer verbesserten Herzfunktion [
50
]. Tan et al. [
51
] verwendeten einen ALK5-Hemmer in einem Rattenmodell mit HF, das durch einen Myokardinfarkt verursacht wurde. Die Behandlung war mit einer Verbesserung der systolischen Herzfunktionsstörung verbunden. Die Autoren stellten die Hypothese auf, dass die Hemmung von TGF-beta die Fibrose verringern kann, wenn sie zum richtigen Zeitpunkt verabreicht wird – weder zu früh noch zu spät nach dem auslösenden Ereignis. Eine wichtige Studie von Roh et al. [
48
] nutzte mehrere menschliche Kohorten, um zu beweisen, dass die zirkulierenden Activine mit zunehmendem Alter des Menschen und HF zunehmen. Gleichzeitig war auch die ACTRII-Signalgebung in etablierten Tiermodellen für Alterung und HF erhöht. Diese Beobachtungsergebnisse werden durch eine Interventionsstudie bestätigt, in der gezeigt wurde, dass ein Sotatercept-Analogon die Umgestaltung des Lungengefäßsystems bei Ratten mit HF, kompliziert durch kombinierte Prä- und Post-PH, rückgängig machte, ein Ergebnis, das mit Sildenafil nicht reproduziert werden konnte. Ob diese präklinischen Daten in einen klinischen Wert umgesetzt werden können, wird durch die laufende CADENCE-Studie (
NCT04945460) geklärt.
), eine doppelblinde, randomisierte, placebokontrollierte Studie der Phase II zur Bewertung der Wirksamkeit und Sicherheit von Sotatercept bei kombinierter prä- und post-PH-assoziierter HF mit erhaltener EF (HFpEF). PH-HFpEF in der kombinierten prä- und postkapillaren Form (Cpc) stellt die Form der PH-Gruppe 2 dar, die PAH am meisten ähnelt, hauptsächlich aufgrund der zugrunde liegenden Gefäßumgestaltung. Daten aus Registern legen nahe, dass mit HFpEF assoziierte CpcPH sicher mit PDE5i behandelt werden kann, sodass in den aktuellen Leitlinien keine formelle Kontraindikation für deren Verwendung in diesem Kontext (CIT) ausgesprochen wird. Diese Tatsache, zusammen mit dem gemeinsamen pathologischen Hintergrund, deutet darauf hin, dass PH-HFpEF die höchste Wahrscheinlichkeit hat, positiv auf Sotatercept zu reagieren, und stellt daher einen entscheidenden Bereich für weitere Forschung und Behandlungsstrategien dar. Sogar bestimmte Formen der PAH-Gruppe 1, wie die portopulmonale Hypertonie (deren pathogenetische Wurzel sich deutlich von den anderen Formen dieser Gruppe unterscheidet), können mit ERA oder PDEi behandelt werden, ohne dass das Risiko einer hämodynamischen Verschlechterung nach Induktion eines hepatorenalen Syndroms besteht [
31
]. Die Kombination eines Vasodilatators wie PDE5i und eines Antiremodelling-Wirkstoffs wie Sotatercept wird in laufenden Studien nicht untersucht.Activin und der TGF-Signalweg wurden auch mit Lungenerkrankungen, insbesondere COPD, in Verbindung gebracht. Eine Studie von Verhamme et al. deutete darauf hin, dass eine Dysregulation des Activin-Signalwegs in einem Mäusemodell für rauchbedingte obstruktive Lungenerkrankung eine Rolle spielt [
52
], während Zhou et al. Activin A mit Muskelschwund bei COPD in Verbindung brachten [
53
]. Darüber hinaus konnte gezeigt werden, dass der Activin-Inhibitor Bimagrumab die Skelettmuskelmasse bei COPD-Patienten sicher steigert [
54
]. Interessanterweise wurden Atrophie und Dysfunktion der Skelettmuskulatur bei PAH ausführlich beschrieben [
55
] und könnten, wie in diesem Artikel bereits angedeutet, ein bislang unerkanntes Ziel von Sotatercept sein. PH der Gruppe III ist eine mögliche und häufige Komplikation von Lungenerkrankungen [
56
] mit sehr begrenzten Therapieoptionen. Es wurden randomisierte kontrollierte Studien zu verschiedenen Medikamentenklassen bei PH der Gruppe III durchgeführt, die einzigen vielversprechenden Ergebnisse lieferte jedoch inhaliertes Treprostinil [
57
], das derzeit für Klasse IIB empfohlen wird (PMID: 36017548). Unseres Wissens nach wurde die mögliche Rolle von Sotatercept bei dieser Erkrankung nie untersucht, obwohl es Hinweise gibt, dass der TGF-Signalweg direkt an PH in Verbindung mit Lungenerkrankungen beteiligt sein könnte [
58
]. Zukünftige Studien müssen klären, ob Sotatercept eine sichere und wirksame Option für PH der Gruppe III darstellt, entweder allein oder in Kombination mit Endothelin-Rezeptorantagonisten.7. Schlussfolgerungen und ZukunftsperspektivenSotatercept ist die vierte Säule im Arsenal gegen PAH. Das Medikament verbessert zusätzlich die körperliche Leistungsfähigkeit, die hämodynamische Symptomatologie, die Lebensqualitätsmetriken und die Zeit bis zur klinischen Verschlechterung. Die günstige Wirkung von Sotatercept auf Hämodynamik und Überleben manifestiert sich in einem relativ begrenzten Zeitrahmen, ein Effekt, der wahrscheinlich auf die Synergie zwischen Sotatercept und anderen gefäßerweiternden Medikamenten in der Hintergrundtherapie zurückzuführen ist. Das Verständnis der Wechselwirkungen von Sotatercept auf molekularer Ebene mit bestehenden PAH-Therapien könnte dazu beitragen, seinen Einsatz in Kombinationstherapien zu optimieren. Was den Zeitpunkt des Therapiebeginns betrifft, ist Sotatercept nach dem derzeitigen Kenntnisstand sicherlich nicht als Monotherapie oder als anfängliche Kombinationstherapie, sondern eher als sequentielle Kombinationstherapie bei stabilen Patienten der FC-WHO-Funktionsklasse II/III indiziert. HYPERION und ZENITH werden die mögliche Indikation des Medikaments bei Hochrisikopatienten der FC-WHO-Funktionsklasse III und IV klären, während die SOTERIA-Studie Aufschluss über die langfristige Wirksamkeit und Sicherheit geben wird.Es hat jedoch einen nicht zu vernachlässigenden Effekt auf die Erythropoese und die Sicherheit und Wirksamkeit des Arzneimittels bei Komorbiditäten sind nicht bekannt. Derzeit laufen mehrere klinische Studien, um seine Wirksamkeit bei anderen PH-Gruppen wie Gruppe 2 zu bewerten. Es gibt noch keine Bewertung der Sicherheit und Wirksamkeit des Arzneimittels bei obstruktiver Lungenvenenerkrankung (PVOD) oder portopulmonaler arterieller Hypertonie. Daher sind weitere Studien erforderlich, um die Sicherheit des Arzneimittels und seine Wirksamkeit, insbesondere langfristig, besser zu definieren.
Sotatercept fungiert als Ligandenfalle für Activin. Sotatercept bindet überschüssige ActRIIA-Liganden und reduziert dadurch die ActRIIA–Smad2/3-Signalgebung, um wachstumsfördernde und wachstumshemmende Signale wieder ins Gleichgewicht zu bringen. Legende zur Abbildung: BMPR, BMP-Rezeptor Typ 2; ALK, Activin-Rezeptor-ähnliche Kinase; ActRIIA/B, Activin-Typ-II-Rezeptoren.3. Präklinische Erkenntnisse zum gezielten Ansprechen des Activin-Signalwegs in PAH-ModellenDie potenzielle therapeutische Rolle des gezielten Angriffs auf den Activin-Signalweg mittels Sotatercept bei menschlicher PAH wird durch umfangreiche präklinische Daten aus Tiermodellen gestützt, die den Sotatercept-Signalweg nachahmen. Sotatercept ist ein Activin-Rezeptor-Typ IIA-Fc (ActRIIA-Fc), ein IgGq-Fc-Fusionsprotein mit derselben extrazellulären Domäne wie ACTRIIA [
12
]. Das Sugen-Hypoxie-Rattenmodell für schwere angioobliterative PAH zeigte, dass die Behandlung mit ActRIIa-Fc die proinflammatorische und proliferative Genexpression umkehrte [
12
]. Darüber hinaus wurde die Makrophageninfiltration in den Lungen von Nagetieren gemildert [
12
]. Yung et al. testeten einen selektiven Inhibitor des transformierenden Wachstumsfaktors Beta-Rezeptor II (TGFBRII) an durch Monocrotalin und Hypoxie induzierter pulmonaler Hypertonie bei Ratten und dokumentierten Verbesserungen der pulmonalvaskulären Umgestaltung und Hämodynamik [
13
]. Diese Gruppe berichtete über ähnliche Ergebnisse bei der Verwendung von ACTRIIA-Fc sowohl prophylaktisch als auch nach Auftreten einer hämodynamisch schweren pulmonalen Hypertonie in verschiedenen Tiermodellen [
11
]. Die Blockierung von ALK5 (Activin-ähnliche Kinase 5) erwies sich in einem Rattenmodell mit durch Monocrotalin induzierter pulmonaler Hypertonie als vorteilhaft [
14
]. Histologisch wurde beobachtet, dass die günstigen Auswirkungen auf die pulmonale Gefäßumgestaltung durch eine Abnahme der frühen Gefäßzellapoptose, der Proliferation von Adventitiazellen und der Metalloproteinaseexpression vermittelt werden [
15
]. Mechanistisch gesehen schwächt die Hemmung des ALK5-Signalwegs die SMAD2-Phosphorylierung ab [
13
]. Es wurde gezeigt, dass der pro-proliferative Activin-SMAD2-Signalweg in den Lungengefäßen von PAH-Ratten hochreguliert ist [
16
], und dieser Befund konnte kürzlich bei der menschlichen idiopathischen PAH repliziert werden. Bei Patienten mit idiopathischer PAH (iPAH) war die Smad2-Signalübertragung erhöht, und die Konzentration von Activin A korrelierte signifikant mit Mortalität und Lungentransplantation [
17
]. Zusammenfassend ergibt sich ein klares pathogenetisches Modell für PAH: Die BMPR2-vermittelte antiproliferative Signalübertragung ist reduziert, während der ActRIIA-SMAD2-Signalweg an Bedeutung gewinnt und durch seine pro-proliferativen Effekte zu einer vaskulären Umgestaltung führt [
11
].4. Interventionelle Studien und laufende registrierte Studien zu Activin-Inhibitoren in der PAH-Gruppe 1Activin-Inhibitoren wurden und werden derzeit in mehreren randomisierten kontrollierten Studien (RCTs) getestet. Die PULSAR-Studie [
18
], eine RCT der Phase II, war eine 24-wöchige multizentrische Studie, in der 106 Patienten mit PAH randomisiert subkutan Sotatercept in zwei verschiedenen Dosierungen (0,3 mg/kg und eine weitere Dosis) oder ein Placebo erhielten. Die Teilnehmer hatten eine lange PAH-Vorgeschichte. Seit der Diagnose waren insgesamt 7,7 ± 5,6 Jahre vergangen, und sie wiesen leichte bis mittelschwere Funktionsstörungen auf (WHO FC II-III). Alle Patienten erhielten eine PAH-Hintergrundtherapie, wobei bis zu 53 % eine dreifache vasodilatatorische Therapie erhielten. Die Studie erreichte ihren primären Zielparameter und zeigte eine Abnahme des pulmonalvaskulären Widerstands (PVR) für beide Arzneimittelschemata sowie Verbesserungen bei der 6-Minuten-Gehstrecke (6MWD) und dem N-terminalen pro-b-Typ natriuretischen Peptid (NT-pro-BNP). Es traten keine schwerwiegenden Sicherheitsprobleme auf. Die wichtigsten Nebenwirkungen waren Thrombozytopenie und erhöhte Hämoglobinwerte. 97 Patienten setzten die Behandlung in einer 24-monatigen offenen Verlängerungsphase fort, wobei die Patienten aus der Placebogruppe auf Sotatercept umstiegen. Die Ergebnisse zur Wirksamkeit zeigten, dass die Verbesserungen bei PVR, 6MWD und NT-pro-BNP in der Crossover-Gruppe mit denen der Patienten, die weiterhin Sotatercept einnahmen, vergleichbar waren. 98 % der Teilnehmer berichteten von Nebenwirkungen, die hauptsächlich mit der Behandlung zusammenhingen. Thrombozytopenie und erhöhte Hämoglobinwerte blieben die häufigsten Nebenwirkungen, während Teleangiektasien bei 11 % der Teilnehmer auftraten. Bemerkenswert ist, dass das Medikament bei fast 10 % der Patienten abgesetzt werden musste. Sechs schwerwiegende Nebenwirkungen standen im Zusammenhang mit Sotatercept, darunter Fälle von Lupus erythematodes und ischämischem Schlaganfall.An der STELLAR-Studie [
2
], einer randomisierten kontrollierten Studie der Phase III, nahmen 323 Patienten teil und wurden randomisiert entweder mit Placebo oder Sotatercept behandelt. Die Ausgangsdosis betrug 0,3 mg/kg und wurde bis zu einem Zielwert von 0,7 mg/kg gesteigert. Die Studie erreichte ihren primären Zielparameter und zeigte eine statistisch und klinisch signifikante Verbesserung der 6MWD mit einer geschätzten Differenz vom Ausgangswert von 40,8 m (27,5 zu 54,1). Sekundäre Zielparameter wurden hierarchisch getestet und acht waren statistisch signifikant. Wichtig ist, dass die Zeit bis zum ersten Auftreten eines Todesfalls oder einer nicht tödlichen klinischen Verschlechterung in der Sotatercept-Gruppe signifikant verbessert wurde, mit einer Hazard Ratio von 0,16 (0,08 zu 0,35). Die Zeit bis zur klinischen Verschlechterung ist ein Surrogatendpunkt, dessen Beziehung zu Krankenhausaufenthalt und Tod sich als konsistenter erwiesen hat als die der 6MWD [
2
]. In Bezug auf die Verträglichkeit und Sicherheit des Arzneimittels erreichte nur ein Patient die Höchstdosis nicht, und schwere Nebenwirkungen traten in der Placebogruppe häufiger auf als in der Sotatercept-Gruppe. Blutungen, Thrombozytopenie, erhöhte Hämoglobinwerte und Teleangiektasien traten jedoch in der Behandlungsgruppe häufiger auf, was mit den Daten der PULSAR-Studie und ihrer Erweiterung übereinstimmt. Weitere Daten zur Sicherheit und Wirksamkeit von Sotatercept werden in der laufenden SOTERIA-Studie (A Long-term Follow-up Study of Sotatercept for PAH Treatment,
NCT04796337
) bereitgestellt, der offenen Erweiterung von STELLAR.Da proteinbasierte Medikamente Immunreaktionen auslösen können, die ihre Pharmakokinetik und Pharmakodynamik verändern können, wurde außerdem eine parallele Studie an der STELLAR-Kohorte durchgeführt, um das Auftreten neutralisierender Antikörper gegen Sotatercept zu untersuchen [
19
]. Ihre Prävalenz war mit 6,7 % bemerkenswert, es zeigten sich jedoch keine klaren Auswirkungen auf die Sicherheit und Wirksamkeit der Behandlung. Schließlich untersuchte die SPECTRA-Studie [
20
], eine offene explorative Phase-II-Studie, die Auswirkungen von Sotatercept auf die Herzfunktion und -struktur bei kardiopulmonalen Belastungstests und kardialer Magnetresonanz in einem einarmigen Design. Sie kam zu dem Schluss, dass die Behandlung die maximale Sauerstoffaufnahme verbesserte und das umgekehrte Remodeling des rechten Ventrikels bestimmte. Die kleine Stichprobengröße (21 Teilnehmer), das Vorher-Nachher-Studiendesign und das Fehlen eines Vergleichspräparats stellen jedoch erhebliche Einschränkungen dar.Mehrere laufende registrierte klinische Studien untersuchen die Sicherheit und Wirksamkeit von Sotatercept bei bestimmten Patientengruppen, die in früheren RCTs nicht berücksichtigt wurden. MOONBEAM (NCT05597712) wird die Sicherheit und Verträglichkeit der Activin-Hemmung bei Kindern mit PAH klären. HYPERION (Studie zu Sotatercept an Teilnehmern mit neu diagnostizierter PAH mit mittlerem und hohem Risiko,
NCT04811092
) nimmt neu diagnostizierte PAH-Patienten mit mittlerem oder hohem Progressionsrisiko auf, angezeigt durch einen REVEAL-Score ≥ 6 oder einen COMPERA-Score ≥ 2. ZENITH (Eine Studie zu Sotatercept an Teilnehmern mit PAH WHO FC III oder FC IV mit hohem Sterberisiko,
NCT04896008
) testet Sotatercept an einer PAH-Kohorte mit mittelschwerer bis schwerer Funktionsbeeinträchtigung (FC III-IV) und hohem Sterberisiko (COMPERA ≥ 9).5. Lücken in der Evidenz und Probleme mit vorhandenen RCTsTrotz der beeindruckenden Ergebnisse von PULSAR und STELLAR, die zur Zulassung als erste nicht-vasodilatatorische Therapie für PAH [
2
] geführt haben, ist die Evidenz zu Sotatercept in vielerlei Hinsicht begrenzt, und einige Fragen müssen noch weiter geklärt werden. Insbesondere wird die externe Validität von PULSAR und STELLAR durch die strengen Einschlusskriterien und die demografischen und klinischen Merkmale der eingeschlossenen Kohorte eingeschränkt, und einige Aspekte der Nebenwirkungen von Sotatercept müssen noch weiter geklärt werden.Bezüglich der Einschlusskriterien schlossen beide Studien neu diagnostizierte Patienten, Patienten mit schwerer Funktionsbeeinträchtigung (d. h. FC WHO IV) und – vielleicht am wichtigsten – Patienten mit kardialen und/oder pulmonalen Komorbiditäten aus. Darüber hinaus wendete STELLAR strenge hämodynamische Einschlusskriterien an, um PAH-Gruppe 1 mit einer rein präkapillären Komponente (präkapillärer Verschlussdruck < 15 mmHg) und fortgeschrittener pulmonaler vaskulärer Umgestaltung [pulmonaler vaskulärer Widerstand (PVR) > 5 Wood-Einheiten (WU)] auszuwählen. Es ist zu beachten, dass zwar der erste Parameter der Definition der präkapillären PAH entspricht, der zweite jedoch deutlich über dem aktuellen Grenzwert für PAH-Gruppe 1 (PVR = 2 WU) liegt. Es ist seit langem bekannt, dass kardiale und pulmonale Komorbiditäten das Ansprechen auf eine vasodilatatorische PAH-Therapie beeinflussen und insbesondere die Wirksamkeit und/oder Verträglichkeit kombinierter pulmonaler Vasodilatatoren beeinträchtigen [
21
]. Angesichts der hohen und weiter steigenden Prävalenz komorbider PAH könnte der derzeitige Mangel an Daten zu Sotatercept in diesem Zusammenhang die Auswirkungen dieses Medikaments auf die PAH-Population insgesamt stark einschränken. Während laufende Studien speziell versuchen, die Lücke in Bezug auf neue PAH-Diagnosen (
NCT04811092
) und PAH-Patienten mit fortgeschrittener Erkrankung und/oder funktionellen Einschränkungen (
NCT04896008
) zu schließen, gibt es keine registrierte interventionelle oder Beobachtungsstudie zu PAH mit Komorbiditäten. Wie dies bei pulmonalen Vasodilatatoren der Fall war [
22
], werden mit dem Einzug von Sotatercept in die klinische Praxis nützliche Daten über seine Wirksamkeit und Sicherheit im realen Umfeld mit stark komorbiden Erkrankungen aus Registern stammen. Allerdings sind solche Informationen anfällig für Verzerrungen [
23
,
24
] und können den Ausschluss komorbider PAH aus randomisierten kontrollierten Studien sicherlich nicht wettmachen. Daher werden RCTs, die sich mit dem komorbiden PAH-Phänotyp befassen, dringend benötigt.Was die demographischen und klinischen Charakteristika der Studienkohorte betrifft, waren schwarze und asiatische Patienten kaum vertreten, obwohl es Berichte gibt, dass die ethnische Zugehörigkeit einen Einfluss auf die Prognose [
25
] und das Ansprechen auf PAH-Therapien [
26
] hat. Zukünftige Beobachtungsstudien und RCTs müssen sich mit dieser Frage befassen und eine ausreichende Anzahl von Patienten für jede ethnische Gruppe einschließen, um Untergruppenanalysen durchzuführen und den Einfluss der ethnischen Zugehörigkeit auf die Wirksamkeit und Sicherheit von Sotatercept zu klären. Zudem waren die Kohorten in PULSAR und STELLAR beide von langjähriger PAH betroffen (mittlere Zeit seit der Diagnose 8,8 + −7,0 Jahre und 7,7 + −5,6 Jahre) und waren untypisch für den hohen Anteil von Patienten, die eine Doppel- oder Dreifachkombinationstherapie erhielten (94,5 % in STELLAR vs. 46,3 % im COMPERA-Register). In Anbetracht der Tatsache, dass die Überlebenswahrscheinlichkeit von PAH-Patienten in den ersten Jahren nach der Diagnose stärker abnimmt und sich in einem späteren Stadium der CIT tendenziell stabilisiert, könnten RCTs zu Sotatercept eine Kohorte mit einem hohen Anteil optimal behandelter Langzeitüberlebender erfasst haben. Darüber hinaus erscheint diese Kohorte von Langzeitüberlebenden aufgrund des hohen Anteils der Dreifachtherapie untypisch, da die aktuellen Leitlinien für Hochrisikopatienten einen rapiden Rückgang der Überlebenschancen vorsehen [
27
]. Dies wirft möglicherweise die Frage auf, ob und in welchem Ausmaß die Vorteile von Sotatercept auch auf typischere, neu diagnostizierte PAH-Patienten zutreffen. Die HYPERION-Studie (
NCT04811092
), eine multizentrische RCT der Phase III, wird diese spezielle Lücke schließen, indem sie Patienten in die Studie aufnimmt, bei denen innerhalb von 12 Monaten PAH diagnostiziert wurde; ihr Abschluss wird jedoch in 5 Jahren erwartet. In der Zwischenzeit hätte eine Untergruppenanalyse der STELLAR-Kohorte nach unterschiedlichen Zeitspannen seit der Diagnose wertvolle Informationen liefern können.Was die hämodynamische Wirkung von Sotatercept betrifft, so zeigte sich, dass dieses ein besonderes Muster aufweist, das sich von dem der pulmonalen Vasodilatatoren unterscheidet. Insbesondere ergab eine spezielle Analyse der STELLAR-Studie [
2
], dass Sotatercept den PVR nicht durch eine Erhöhung des Herzzeitvolumens, das stabil blieb, senkte, sondern durch eine Senkung des mittleren pulmonalarteriellen Drucks (mPAP). Dies steht einerseits im Einklang mit der Vorstellung, dass Sotatercept eher eine systemische vasokonstriktive als eine vasodilatatorische Wirkung hat [
28
]; andererseits stellt es die Vorstellung in Frage, dass das Herzzeitvolumen und nicht mPAP mit dem Überleben bei PAH korreliert [
29 ]. Wie Rubin und Naeije [
29
] anmerkten , ist es außerdem merkwürdig, dass sich der günstige Effekt von Sotatercept auf die Hämodynamik scheinbar in einem relativ begrenzten Zeitrahmen manifestiert und mit der Zeit nicht zunimmt [
30
]. Die Synergie zwischen Sotatercept und anderen vasodilatatorischen Medikamenten in der Hintergrundtherapie könnte die frühe Wirkung von Sotatercept erklären, auch wenn man die umfangreiche Interaktion von Sotatercept mit den NO- und ET-1-Wegen berücksichtigt (siehe Kapitel 2). Während Reverse Remodeling häufig mit pulmonalen Vasodilatatortherapien bei den verschiedenen PAH-Typen in Verbindung gebracht wurde [
31
], wurde dieser Effekt bei mit Sotatercept behandelten Patienten bisher nicht beschrieben. Weitere Informationen über das Zusammenspiel zwischen Sotatercept und verschiedenen PAH-Medikamentenklassen hätten durch eine Untergruppenanalyse der STELLAR-Kohorte nicht nur nach der Anzahl der Medikamente, sondern auch nach der Art der Medikamente gewonnen werden können. Bestimmte Kombinationen können tatsächlich wirksamer sein als andere. Es muss jedoch beachtet werden, dass die STELLAR-Studie wahrscheinlich zu schwach war, um den möglichen Nutzen der Wahl einer Medikamentenkombination gegenüber einer anderen zu erkennen. Laufende RCTs und künftige Metanalysen werden diese Möglichkeit hoffentlich untersuchen.Was die Nebenwirkungen betrifft, so hat Sotatercept eine gut charakterisierte erythropoese-stimulierende Wirkung und wurde zur Behandlung von Anämie bei verschiedenen Erkrankungen getestet [
32
,
33
]. Wie erwartet war Sotatercept in RCTs mit Patienten mit PAH mit einem moderaten Anstieg des Hämoglobinspiegels (Hb) verbunden, wobei der mittlere Hb um 1,3 mg/dL anstieg [
2
]. Bemerkenswert ist, dass sowohl PAH als auch Herzinsuffizienz mit absolutem und funktionellem Eisenmangel verbunden sind [
34
] und Anämie allgemein mit schlechteren Ergebnissen bei beiden Erkrankungen in Verbindung gebracht wurde [
35
,
36
]. Allerdings scheint Erythropoietin bei Herzinsuffizienz (HF) erhöht zu sein und positiv mit der Mortalität zu korrelieren. Darüber hinaus konnte Darpoietin bei HF keine positive Wirkung zeigen und war mit einem höheren Risiko für thromboembolische Ereignisse verbunden [
37
]. Auch Erythropoietin ist bei PAH erhöht [
38
] und hat kürzlich gezeigt, dass es einen anscheinend günstigen Effekt auf die Lungengefäße hat, indem es das Homing und die Endothelzelldifferenzierung in Knochenmarkstammzellen von Ratten fördert [
39
]. Ob die Stimulierung der Erythropoese eine Nebenwirkung oder ein Mediator der Wirksamkeit von Sotatercept ist, ist eine spannende Frage, die noch nicht beantwortet werden kann. Dennoch könnte eine Mediationsanalyse unter Verwendung der Daten der wichtigsten RCTs nützliche Informationen liefern. Angesichts des bekannten Zusammenhangs [
37
,
40
] zwischen Erythropoietin und Erythropoietin-stimulierenden Substanzen und thrombotischen Ereignissen ist zudem eine genaue Überwachung der Inzidenz kardiovaskulärer Nebenwirkungen bei mit Sotatercept behandelten Personen sicherlich gerechtfertigt. Es muss jedoch beachtet werden, dass sich aus den Studien PULSAR und STELLAR keine Hinweise auf ein erhöhtes Thrombose- oder Thromboembolierisiko ergeben haben; im Behandlungsarm der ersteren erlitt nur ein Patient einen Schlaganfall. Da Sotatercept jedoch langfristig angewendet wird, kann ein Anstieg des Thromboserisikos in der Zukunft offensichtlich werden und muss umgehend erkannt werden. Ein weiteres Problem bei randomisierten kontrollierten Studien zu Sotatercept ist die Wahl der 6MWD als primärer Endpunkt in der STELLAR-Studie, was einen Rückschritt im Vergleich zu den jüngeren randomisierten kontrollierten Studien im PAH-Bereich darstellt. In Zulassungsstudien zu PAH-Medikamenten wurde bis zur FREEDOM-C2-Studie aus dem Jahr 2013 das Abschneiden beim 6MWD-Test als primärer Endpunkt verwendet [
41
]. Ab da wurden Morbidität und Mortalität als kombinierte primäre Endpunkte gewählt. Insbesondere wurde das Konzept der Zeit bis zur klinischen Verschlechterung (TTCW) erstmals erfolgreich in einer Studie zu Macitentan [
42
] eingesetzt und später als gültiger primärer Endpunkt für Zulassungsstudien bestätigt. Tatsächlich zeigte sich, dass die TTCW einen Zusammenhang mit Krankenhausaufenthalten und Todesfällen aufweist, der konsistenter ist als der der 6MWD [
43
] und sollte der primäre Endpunkt zukünftiger randomisierter kontrollierter Studien (RCTs) sein, in denen Sotatercept getestet wird. Bemerkenswerterweise zeigte STELLAR eine Verbesserung der TTCW, die in die sekundären Endpunkte aufgenommen wurde. Dies bedeutet jedoch nicht unbedingt eine Verringerung der Mortalität [
44
], was in längerfristigen Studien und/oder Registern untersucht werden muss.6. Könnten die Vorteile einer Sotatercept-Therapie auch auf PH außerhalb der Gruppe 1 angewendet werden?PAH-Gruppe 1 macht nur einen kleinen Teil der PH-Fälle aus, die meist mit einer Linksherzerkrankung (PH-Gruppe 2) verbunden sind [
45
]. Für die mit HF verbundene PH gibt es keine effektiven speziellen Therapien, und ihre Behandlung beschränkt sich auf die optimale Behandlung der zugrunde liegenden Linksherzerkrankung [
46
]. Es wurden große Anstrengungen unternommen, um pulmonale Vasodilatatoren in diesem Zusammenhang zu testen, aber spezielle RCTs haben bestenfalls gemischte Ergebnisse erbracht [
47
], und für die PH-Gruppe 2 wird keine PAH-spezifische Arzneimittelklasse formal empfohlen. Interessanterweise wurde in mehreren Beobachtungsstudien ein Zusammenhang zwischen dem TGF-Signalweg und HF (sowohl akut als auch chronisch) nahegelegt, und zwar so sehr, dass er als zusätzliche Säule der maladaptiven Mechanismen vorgeschlagen wurde, die HF verursachen [
48
]. Es wurde gezeigt, dass Activin A während des Krankenhausaufenthalts negativ mit der linksventrikulären Ejektionsfraktion (LVEF) korreliert und die Überlebensrate nach sechs Monaten verringert. Diese klinischen Befunde werden durch zahlreiche präklinische Studien gestützt. Activin A kann durch Stress des endoplasmatischen Retikulums die Apoptose myokardialer Zellen stimulieren [
49
]. Die Hemmung des ACTRII-Rezeptors bei gealterten Mäusen und Mäusen mit nicht-ischämischem HF führte in konsistenter Weise zu einer verbesserten Herzfunktion [
50
]. Tan et al. [
51
] verwendeten einen ALK5-Hemmer in einem Rattenmodell mit HF, das durch einen Myokardinfarkt verursacht wurde. Die Behandlung war mit einer Verbesserung der systolischen Herzfunktionsstörung verbunden. Die Autoren stellten die Hypothese auf, dass die Hemmung von TGF-beta die Fibrose verringern kann, wenn sie zum richtigen Zeitpunkt verabreicht wird – weder zu früh noch zu spät nach dem auslösenden Ereignis. Eine wichtige Studie von Roh et al. [
48
] nutzte mehrere menschliche Kohorten, um zu beweisen, dass die zirkulierenden Activine mit zunehmendem Alter des Menschen und HF zunehmen. Gleichzeitig war auch die ACTRII-Signalgebung in etablierten Tiermodellen für Alterung und HF erhöht. Diese Beobachtungsergebnisse werden durch eine Interventionsstudie bestätigt, in der gezeigt wurde, dass ein Sotatercept-Analogon die Umgestaltung des Lungengefäßsystems bei Ratten mit HF, kompliziert durch kombinierte Prä- und Post-PH, rückgängig machte, ein Ergebnis, das mit Sildenafil nicht reproduziert werden konnte. Ob diese präklinischen Daten in einen klinischen Wert umgesetzt werden können, wird durch die laufende CADENCE-Studie (
NCT04945460) geklärt.
), eine doppelblinde, randomisierte, placebokontrollierte Studie der Phase II zur Bewertung der Wirksamkeit und Sicherheit von Sotatercept bei kombinierter prä- und post-PH-assoziierter HF mit erhaltener EF (HFpEF). PH-HFpEF in der kombinierten prä- und postkapillaren Form (Cpc) stellt die Form der PH-Gruppe 2 dar, die PAH am meisten ähnelt, hauptsächlich aufgrund der zugrunde liegenden Gefäßumgestaltung. Daten aus Registern legen nahe, dass mit HFpEF assoziierte CpcPH sicher mit PDE5i behandelt werden kann, sodass in den aktuellen Leitlinien keine formelle Kontraindikation für deren Verwendung in diesem Kontext (CIT) ausgesprochen wird. Diese Tatsache, zusammen mit dem gemeinsamen pathologischen Hintergrund, deutet darauf hin, dass PH-HFpEF die höchste Wahrscheinlichkeit hat, positiv auf Sotatercept zu reagieren, und stellt daher einen entscheidenden Bereich für weitere Forschung und Behandlungsstrategien dar. Sogar bestimmte Formen der PAH-Gruppe 1, wie die portopulmonale Hypertonie (deren pathogenetische Wurzel sich deutlich von den anderen Formen dieser Gruppe unterscheidet), können mit ERA oder PDEi behandelt werden, ohne dass das Risiko einer hämodynamischen Verschlechterung nach Induktion eines hepatorenalen Syndroms besteht [
31
]. Die Kombination eines Vasodilatators wie PDE5i und eines Antiremodelling-Wirkstoffs wie Sotatercept wird in laufenden Studien nicht untersucht.Activin und der TGF-Signalweg wurden auch mit Lungenerkrankungen, insbesondere COPD, in Verbindung gebracht. Eine Studie von Verhamme et al. deutete darauf hin, dass eine Dysregulation des Activin-Signalwegs in einem Mäusemodell für rauchbedingte obstruktive Lungenerkrankung eine Rolle spielt [
52
], während Zhou et al. Activin A mit Muskelschwund bei COPD in Verbindung brachten [
53
]. Darüber hinaus konnte gezeigt werden, dass der Activin-Inhibitor Bimagrumab die Skelettmuskelmasse bei COPD-Patienten sicher steigert [
54
]. Interessanterweise wurden Atrophie und Dysfunktion der Skelettmuskulatur bei PAH ausführlich beschrieben [
55
] und könnten, wie in diesem Artikel bereits angedeutet, ein bislang unerkanntes Ziel von Sotatercept sein. PH der Gruppe III ist eine mögliche und häufige Komplikation von Lungenerkrankungen [
56
] mit sehr begrenzten Therapieoptionen. Es wurden randomisierte kontrollierte Studien zu verschiedenen Medikamentenklassen bei PH der Gruppe III durchgeführt, die einzigen vielversprechenden Ergebnisse lieferte jedoch inhaliertes Treprostinil [
57
], das derzeit für Klasse IIB empfohlen wird (PMID: 36017548). Unseres Wissens nach wurde die mögliche Rolle von Sotatercept bei dieser Erkrankung nie untersucht, obwohl es Hinweise gibt, dass der TGF-Signalweg direkt an PH in Verbindung mit Lungenerkrankungen beteiligt sein könnte [
58
]. Zukünftige Studien müssen klären, ob Sotatercept eine sichere und wirksame Option für PH der Gruppe III darstellt, entweder allein oder in Kombination mit Endothelin-Rezeptorantagonisten.7. Schlussfolgerungen und ZukunftsperspektivenSotatercept ist die vierte Säule im Arsenal gegen PAH. Das Medikament verbessert zusätzlich die körperliche Leistungsfähigkeit, die hämodynamische Symptomatologie, die Lebensqualitätsmetriken und die Zeit bis zur klinischen Verschlechterung. Die günstige Wirkung von Sotatercept auf Hämodynamik und Überleben manifestiert sich in einem relativ begrenzten Zeitrahmen, ein Effekt, der wahrscheinlich auf die Synergie zwischen Sotatercept und anderen gefäßerweiternden Medikamenten in der Hintergrundtherapie zurückzuführen ist. Das Verständnis der Wechselwirkungen von Sotatercept auf molekularer Ebene mit bestehenden PAH-Therapien könnte dazu beitragen, seinen Einsatz in Kombinationstherapien zu optimieren. Was den Zeitpunkt des Therapiebeginns betrifft, ist Sotatercept nach dem derzeitigen Kenntnisstand sicherlich nicht als Monotherapie oder als anfängliche Kombinationstherapie, sondern eher als sequentielle Kombinationstherapie bei stabilen Patienten der FC-WHO-Funktionsklasse II/III indiziert. HYPERION und ZENITH werden die mögliche Indikation des Medikaments bei Hochrisikopatienten der FC-WHO-Funktionsklasse III und IV klären, während die SOTERIA-Studie Aufschluss über die langfristige Wirksamkeit und Sicherheit geben wird.Es hat jedoch einen nicht zu vernachlässigenden Effekt auf die Erythropoese und die Sicherheit und Wirksamkeit des Arzneimittels bei Komorbiditäten sind nicht bekannt. Derzeit laufen mehrere klinische Studien, um seine Wirksamkeit bei anderen PH-Gruppen wie Gruppe 2 zu bewerten. Es gibt noch keine Bewertung der Sicherheit und Wirksamkeit des Arzneimittels bei obstruktiver Lungenvenenerkrankung (PVOD) oder portopulmonaler arterieller Hypertonie. Daher sind weitere Studien erforderlich, um die Sicherheit des Arzneimittels und seine Wirksamkeit, insbesondere langfristig, besser zu definieren.
Perspektiven zu Sotatercept bei pulmonaler arterieller Hypertonie Rosalinda Madonna 1, 2, * , Filippo Biondi 1
- Autoreninformation
- Artikelnotizen
- Copyright- und Lizenzinformationen

OMNIA TEMPUS HABENT
Diagnose IPAH im Februar 2013, in Behandlung bei OA Dr. Ulrich Krüger, jetzt Dr. Fischer Herzzentrum Duisburg, Medikamente: Sildenafil, Bosentan jetzt Macitentan, Subkutane Treprostinilpumpe, seit Januar 2024 getunnelter ZVK mit externer Pumpe (Groshongkatheter), 24/7 Sauerstoff, Marcumar, Diuretika
Bitte Anmelden oder Registrieren um der Konversation beizutreten.
