- Beiträge: 1748
Sidebar
Linksherz PH
15 Sep 2024 23:31 #2209
von danny
OMNIA TEMPUS HABENT
Diagnose IPAH im Februar 2013, in Behandlung bei OA Dr. Ulrich Krüger, jetzt Dr. Fischer Herzzentrum Duisburg, Medikamente: Sildenafil, Bosentan jetzt Macitentan, Subkutane Treprostinilpumpe, seit Januar 2024 getunnelter ZVK mit externer Pumpe (Groshongkatheter), 24/7 Sauerstoff, Marcumar, Diuretika
Linksherz PH wurde erstellt von danny
www.frontiersin.org/journals/cardiovascu...cvm.2022.908215/full
Prävalenz und Überleben der pulmonalen Hypertonie aufgrund einer Linksherzinsuffizienz: Eine retrospektive Analyse einer multizentrischen prospektiven KohortenstudieHintergrund: Pulmonale Hypertonie aufgrund einer Linksherzinsuffizienz (PH-LHF) ist derzeit die häufigste Form der pulmonalen Hypertonie (PH), die in der klinischen Praxis auftritt. Trotz erheblicher Fortschritte, die unser Verständnis von PH-LHF in den letzten zwei Jahrzehnten verbessert haben, ist die Sterblichkeit in den letzten Jahrzehnten immer noch hoch. Ziel dieser Studie war es, die Prävalenz und das Überleben von Patienten mit PH-LHF zu beschreiben und die potenziellen Risikofaktoren zu untersuchen, die die Prognose von PH-LHF vorhersagen können.Methoden: Es wurde eine retrospektive Analyse einer prospektiven Kohortenstudie von Patienten mit Linksherzinsuffizienz (LHF) durchgeführt, die zwischen Januar 2013 und November 2016 einer Rechtsherzkatheterisierung (RHC) unterzogen wurden. Der Endpunkt war die Gesamtmortalität. Nachuntersuchungen wurden alle 6 Monate ± 2 Wochen durchgeführt.Ergebnisse: Insgesamt wurden 480 Patienten mit LHF in die Studie aufgenommen, davon 215 (44,8 %) mit PH-LHF. Der Anteil an PH-LHF war in der Gruppe mit koronarer Herzkrankheit (KHK) signifikant niedriger als in der Gruppe ohne KHK (41,3 vs. 57,8 %, p = 0,003). Eine multivariable logistische Regressionsanalyse ergab jedoch, dass KHK nicht mit PH-LHF assoziiert war (angepasstes OR: 1,055, 95 % KI: 0,576 – 1,935, p = 0,862). 75 von 215 (34,9 %) Patienten mit PH-LHF starben während eines medianen Nachbeobachtungszeitraums von 84,6 Monaten. Die 1-, 3-, 5- und 8-Jahres-Überlebensraten aller PH-LHF-Patienten lagen bei 94,3, 76,9, 65,8 bzw. 60,2 %. Die New York Heart Association Functional Class (NYHA FC), Hämoglobin und der systolische pulmonalarterielle Druck (sPAP) wurden in der multivarianten Cox-Analyse mit der Mortalität von PH-LHF in Zusammenhang gebracht.Schlussfolgerung: PH tritt häufig bei Patienten mit LHF auf, die Prävalenz liegt bei etwa 45 %. Die Mortalität ist bei Patienten mit PH-LHF immer noch hoch. NYHA FC, Hämoglobin und sPAP sind unabhängige Risikoprädiktoren für die Mortalität bei PH-LHF. Diese Erkenntnisse können für die Risikostratifizierung bei der Aufnahme in zukünftige klinische Studien nützlich sein. EinführungPulmonale Hypertonie (PH) hat sich weltweit zu einem zunehmend verbreiteten Gesundheitsproblem entwickelt. Sie betrifft schätzungsweise 1 % der Weltbevölkerung und steigt bei Personen über 65 Jahren auf bis zu 10 % an ( 1 ). Klinisch wird PH in fünf Gruppen eingeteilt: PH aufgrund einer Linksherzinsuffizienz (PH-LHF) wird der Gruppe 2 zugeordnet und ist definiert als postkapilläre PH [mittlerer pulmonalarterieller Druck (mPAP) ≥ 25 mmHg und pulmonalarterieller Verschlussdruck (PAWP) > 15 mmHg] ( 2 ). Die Gesamtinzidenz der Linksherzinsuffizienz (LHF) nimmt aufgrund des rapiden weltweiten Anstiegs der Zahl der über 65-Jährigen zu. LHF entwickelt sich zu einer der Hauptursachen von PH und betrifft etwa 5 % aller Personen im Alter von 65 Jahren und älter ( 1 , 3 , 4 ).Pulmonale Hypertonie aufgrund einer Linksherzinsuffizienz ist eine häufige Komorbidität einer diastolischen Dysfunktion des linken Ventrikels – Herzinsuffizienz mit erhaltener Ejektionsfraktion (HFpEF) oder Herzinsuffizienz mit reduzierter Ejektionsfraktion (HFrEF). Die in früheren Studien berichtete Prävalenz liegt zwischen 40 und 75 % für PH-HFrEF und zwischen 36 und 83 % für PH-HFpEF ( 1 , 5 ). Diese Prävalenz ist jedoch das Ergebnis einer uneinheitlichen Anwendung des Golddiagnosestandards (RHC). Einige Berichte beispielsweise stützen sich auf den per Echokardiographie gemessenen systolischen Pulmonalarteriendruck (PASP) oder verwenden andere Diagnosekriterien ( 6 , 7 ). Daher ist die wahre Prävalenz der PH-LHF unklar.Die Mortalität von Patienten mit LHF ist in den letzten zwei Jahrzehnten deutlich gesunken ( 8 ). Allerdings ist die Mortalität von PH-LHF in den letzten Jahren immer noch hoch ( 3 , 9 ). Die Überlebensrate bei PH-LHF ist im Vergleich zu Patienten mit pulmonaler arterieller Hypertonie (PAH) geringer ( 3 ). Für PAH gibt es mehrere praktische Risikotabellen zur Stratifizierung der Prognose, die Behandlungsziele und Nachsorgestrategien vorgeben ( 2 , 10 ). Für PH-LHF ist jedoch keine praktische und verlässliche Risikotabelle verfügbar. Die Identifizierung potenzieller Risikofaktoren kann hilfreich sein, um das Problem der hohen Mortalität bei PH-LHF-Patienten zu lindern. Dementsprechend waren die Ziele dieser Studie: (1) die Prävalenz von PH bei Patienten mit LHF zu beschreiben; (2) eine langfristige Nachbeobachtung von Patienten mit PH-LHF zu planen und durchzuführen, um die Überlebensrate abzuschätzen und (3) die potenziellen Risikofaktoren zu untersuchen, die den Tod von PH-LHF vorhersagen können.Materialen und MethodenStudiendesign und TeilnehmerWir haben eine retrospektive Analyse einer prospektiven, multizentrischen Registerstudie mit LHF-Patienten durchgeführt, die zwischen Januar 2013 und November 2016 einer Rechtsherzkatheterisierung unterzogen wurden. Das Studiendesign und das Flussdiagramm zur Patientenauswahl sind in Abbildung 1 dargestellt . Das Studienprotokoll wurde vom Institutional Review Board des Fuwai Hospital genehmigt (Genehmigungsnummer 2012-401), gemäß der Deklaration von Helsinki durchgeführt und auf ClinicalTrials.gov registriert (Kennung: NCT02164526). Von allen aufgenommenen Patienten wurde eine schriftliche Einverständniserklärung eingeholt. ABILDUNG 1
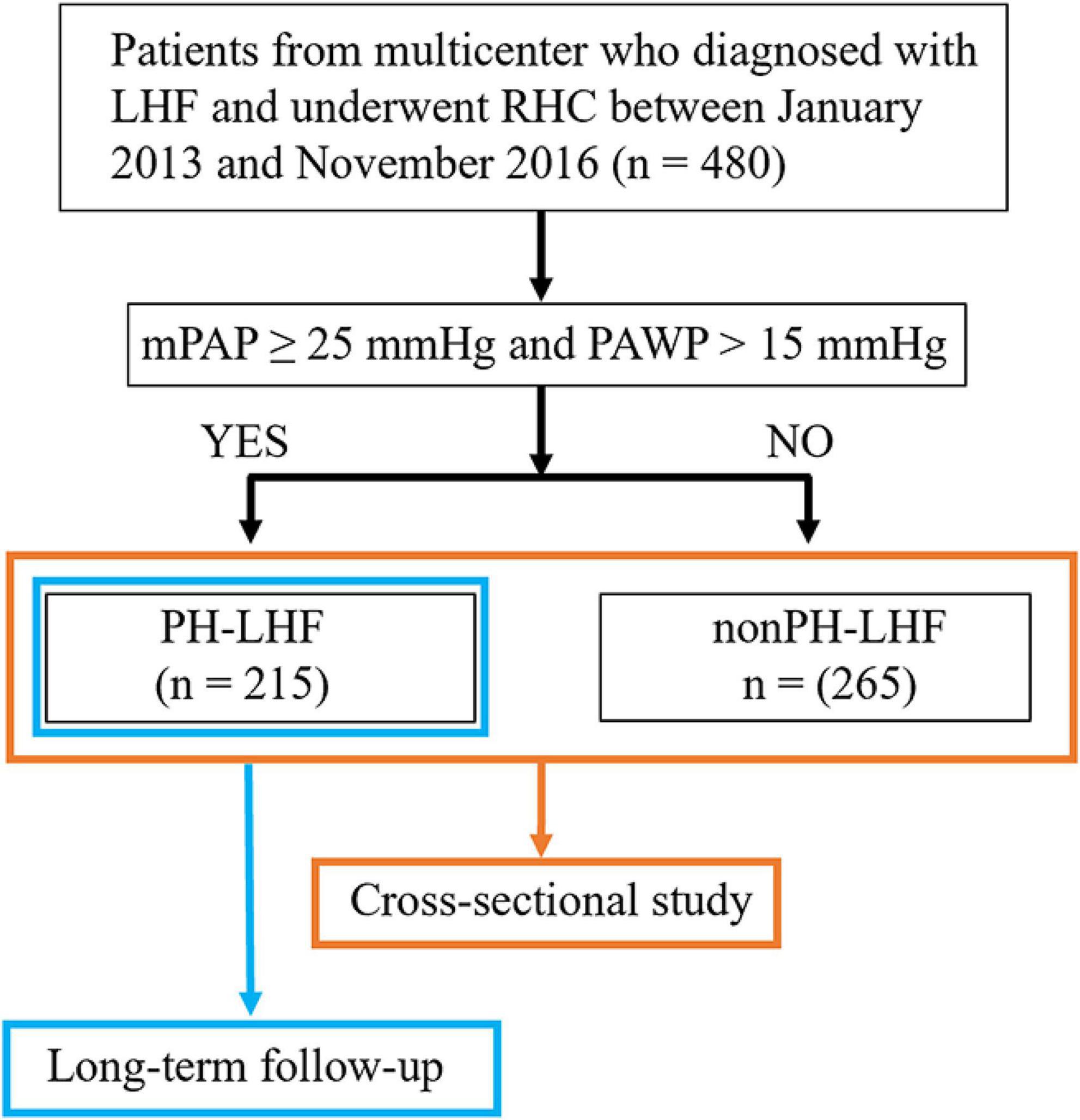 Abbildung 1. Studiendesign und Flussdiagramm zur Patientenauswahl. LHF, Linksherzinsuffizienz; RHC, Rechtsherzkatheterisierung; mPAP, mittlerer pulmonalarterieller Druck; PAWP, pulmonalarterieller Verschlussdruck; PH-LHF, pulmonale Hypertonie aufgrund von Linksherzinsuffizienz. Die Patienten wurden gemäß den folgenden Kriterien in die Studie eingeschlossen: (1) bestätigte Diagnose eines Linksherzinsuffizienz entsprechend der damaligen Leitlinie zur Herzinsuffizienz (
11
). (2) Patienten, die zwischen Januar 2013 und November 2016 einer rechtsventrikulären Herzinsuffizienz unterzogen wurden. Patienten mit einem der folgenden Kriterien wurden ausgeschlossen: (1) hypertrophe obstruktive Kardiomyopathie, (2) Stenose des rechtsventrikulären Ausflusstrakts, (3) Perikarderkrankung, (4) Patienten mit chronischer Lungenerkrankung und (5) Herzinsuffizienz aufgrund einer Herzklappenerkrankung.Messungen und DatenerfassungUm PH in anderen Gruppen auszuschließen, wurden Echokardiographie, Elektrokardiographie, Lungenfunktionstests, Ventilations-/Perfusionsszintigraphie, Röntgenaufnahme des Brustkorbs, hochauflösende CT des Brustkorbs, Pulmonalisangiographie (falls erforderlich), RHC, Anamnese, klinische Symptome, Anzeichen und Laborergebnisse bewertet. Biochemische Blutuntersuchungen wurden innerhalb von 24 Stunden nach der Aufnahme durchgeführt. Blutdruck, Herzfrequenz, Echokardiographie und biochemische Parameter wurden ab der ersten Messung bei der Aufnahme erhoben. RHC wurde durchgeführt, um die ärztliche Diagnose eines vermuteten PH-LHF mit erhöhtem systolischen pulmonalarteriellen Druck, gemessen per Echokardiographie, zu bestätigen oder um die Hämodynamik zu bewerten und zu überwachen, oder bei Patienten, deren körperliche Belastbarkeit trotz optimaler leitliniengerechter Behandlung abgenommen hatte. RHC und Linksherzkatheterisierung wurden verwendet, um hämodynamische Parameter zu erhalten, während eine quantitative Koronarangiographie verwendet wurde, um angiographische Parameter zu messen.Als pulmonale Hypertonie bezeichnet man einen Anstieg des mittleren pulmonalarteriellen Drucks (mPAP) ≥ 25 mmHg im Ruhezustand, und PH-LHF ist definiert als postkapilläre PH mit mPAP ≥ 25 mmHg und pulmonalarteriellem Verschlussdruck (PAWP) > 15 mmHg im Ruhezustand gemäß Beurteilung durch RHC, präkapilläre PH ist definiert als mPAP ≥ 25 mmHg und PAWP ≤ 15 mmHg (
2
). Als koronare Herzkrankheit (KHK) gilt das Vorliegen von mindestens einem Koronarstenoseherd von über 50 % oder eine ärztlich dokumentierte KHK-Anamnese (Daten von in anderen Krankenhäusern durchgeführten Koronarangiographien liegen nicht vor). Der Schweregrad der KHK wurde anhand des Gensini-Scores beurteilt (
12
). Bei der ischämischen Kardiomyopathie (ICM) handelt es sich um eine Funktionsstörung des linken Ventrikels (LV) mit einer linksventrikulären Ejektionsfraktion (LVEF) ≤ 40 % aufgrund einer KHK (
13
). HFpEF ist definiert als LVEF ≥ 50 % und HFrEF als LVEF < 50 %. Die geschätzte glomeruläre Filtrationsrate (eGFR) wurde mit der Cockcroft-Gault-Gleichung berechnet (
14
).Alle aufgenommenen Patienten verfügten über zweidimensionale Echokardiographie- und RHC-Daten. Anamnese, demografische Daten, klinische und radiologische Basisdaten, Laborergebnisse und Behandlungen wurden aus unseren Datenbankaufzeichnungen der Registerstudie überprüft.Endpunkt und Follow-upDer Endpunkt dieser Studie war die Gesamtmortalität. Die Nachuntersuchungen erfolgten per Telefon, Nachrichten und ambulanten Besuchen alle 6 Monate ± 2 Wochen. Die Patienten wurden vom Zeitpunkt der Diagnose PH-LHF bis zum Endpunkt (Tod) oder bis zum Stichtag dieser Studie (Oktober 2021) nachbeobachtet. Patienten, die nicht nachbeobachtet werden konnten, wurden bei den letzten bekannten Nachuntersuchungsdaten zensiert.Fehlende und extreme DatenDie verbleibenden Variablen wurden mithilfe mehrerer Imputationen interpoliert, bevor sie zur Analyse in das multivariable Modell eingegeben wurden. Fehlende Daten wurden als das gleichzeitige Fehlen beider Werte für Variablen mit gleicher klinischer Bedeutung, wie BNP und NT-proBNP, definiert. Biomarkerwerte unterhalb der Nachweisgrenze wurden auf die Hälfte dieses Wertes festgelegt, während Werte oberhalb der Nachweisgrenze auf den oberen Grenzwert festgelegt wurden.Statistische AnalyseDie statistische Analyse erfolgte mit der Software R (Version 4.0.2) und SPSS (Version 24.0). Kontinuierliche Variablen wurden als Mittelwert ± Standardabweichung für normalverteilte Daten ausgedrückt. Bei schiefen Verteilungen wurden Median und Interquartilsabstand (IQR, 25.–75. Perzentil) und ihre Unterschiede zwischen den Gruppen mit dem ungepaarten zweiseitigen t- Test oder dem Mann-Whitney- U -Test verglichen. Kategoriale Variablen wurden als Anzahlen und Prozentsätze (%) dargestellt. Die Unterschiede zwischen den Gruppen wurden entweder mit Pearsons Chi-Quadrat-Test (alle Erwartungswerte nicht kleiner als 5) oder Fishers exaktem Test (alle Erwartungswerte kleiner als 5) verglichen. Zur Beurteilung der mit PH-LHF verbundenen Faktoren wurde eine logistische Regressionsanalyse verwendet. Die durch univariate Regressionsmodelle ( p < 0,10) ermittelten Variablen wurden dann in das multivariable logistische Regressionsmodell aufgenommen, um festzustellen, ob sie PH-LHF unabhängig beeinflussen könnten. Die kontinuierlichen Variablen wurden in kategorische Variablen umgewandelt, die in einer logistischen Regressionsanalyse durch einen Median oder Mittelwert bestimmt wurden. Wir verwendeten die Kaplan-Meier-Methode, um die kumulative Inzidenz des Endpunkts zu schätzen, indem wir die Daten von Patienten zensierten, deren Nachbeobachtung verloren ging. Die Überlebensanalyse wurde mithilfe der Kaplan-Meier-Überlebensanalysemethode mit dem Log-Rank-Test beschrieben. Eine multivariante proportionale Cox-Risiko-Regression mit der Vorwärts-LR-Analysemethode (vorwärts schrittweise Regression basierend auf der Maximum-Likelihood-Schätzung) wurde verwendet, um die Wirkung der Variablen auf die Überlebenszeit zu bewerten, was Daten als Hazard Ratio (HR) mit einem 95%-KI ergab. Die Variablen wurden auf Grundlage klinischer Expertise, früherer Literatur und univariater Analysen in das multivariante Cox-Modell aufgenommen. Die Proportionalität der Gefahren wurde für jede Variable bewertet. Wir überprüften die Annahme der proportionalen Gefahren, indem wir die statistische Signifikanz der Wechselwirkungen zwischen Nachbeobachtungszeit und Variablen testeten. Die statistische Signifikanz wurde auf einen zweiseitigen p -Wert < 0,05 festgelegt.ErgebnisseBasismerkmale von Patienten mit LinksherzinsuffizienzInsgesamt wurden 480 Patienten mit LHF aufgenommen, von denen 106 (22,1 %) eine HFrEF und 374 (77,9 %) eine HFpEF aufwiesen. Diese LHF-Patienten waren überwiegend männlich ( n = 357, 74,4 %) und litten an CAD ( n = 378, 78,8 %). Von diesen CAD-Patienten wurde bei 283 (74,9 %) eine Angiographie und bei 95 (25,1 %) eine ärztlich dokumentierte CAD-Anamnese bestätigt. Die PH-LHF-Patientengruppe hatte einen höheren BMI, Harnsäure, NT-proBNP und einen höheren Prozentsatz an HFrEF sowie Funktionsklasse (FC) III/IV als die Nicht-PH-LHF-Gruppe (
Tabelle 1
). Der linksatriale anteriorposteriore Durchmesser (LAAPD), der linksventrikuläre enddiastolische Durchmesser (LVEDD), der rechtsventrikuläre anteriorposteriore Ventrikeldurchmesser (RVAPD), mPAP und der linksventrikuläre enddiastolische Druck (LVEDP) waren bei PH-LHF-Patienten alle höher. Weitere Ausgangswerte sowie demografische, klinische und hämodynamische Merkmale von Patienten mit PH-LHF und Nicht-PH-LHF sind in
Tabelle 1
aufgeführt . Fehlende Werte für die Kovariatenvariablen lagen zwischen 0,2 % für LAAPD und 11,5 % für natriuretische Peptide (
Tabelle 1
). TBELLE 1
Abbildung 1. Studiendesign und Flussdiagramm zur Patientenauswahl. LHF, Linksherzinsuffizienz; RHC, Rechtsherzkatheterisierung; mPAP, mittlerer pulmonalarterieller Druck; PAWP, pulmonalarterieller Verschlussdruck; PH-LHF, pulmonale Hypertonie aufgrund von Linksherzinsuffizienz. Die Patienten wurden gemäß den folgenden Kriterien in die Studie eingeschlossen: (1) bestätigte Diagnose eines Linksherzinsuffizienz entsprechend der damaligen Leitlinie zur Herzinsuffizienz (
11
). (2) Patienten, die zwischen Januar 2013 und November 2016 einer rechtsventrikulären Herzinsuffizienz unterzogen wurden. Patienten mit einem der folgenden Kriterien wurden ausgeschlossen: (1) hypertrophe obstruktive Kardiomyopathie, (2) Stenose des rechtsventrikulären Ausflusstrakts, (3) Perikarderkrankung, (4) Patienten mit chronischer Lungenerkrankung und (5) Herzinsuffizienz aufgrund einer Herzklappenerkrankung.Messungen und DatenerfassungUm PH in anderen Gruppen auszuschließen, wurden Echokardiographie, Elektrokardiographie, Lungenfunktionstests, Ventilations-/Perfusionsszintigraphie, Röntgenaufnahme des Brustkorbs, hochauflösende CT des Brustkorbs, Pulmonalisangiographie (falls erforderlich), RHC, Anamnese, klinische Symptome, Anzeichen und Laborergebnisse bewertet. Biochemische Blutuntersuchungen wurden innerhalb von 24 Stunden nach der Aufnahme durchgeführt. Blutdruck, Herzfrequenz, Echokardiographie und biochemische Parameter wurden ab der ersten Messung bei der Aufnahme erhoben. RHC wurde durchgeführt, um die ärztliche Diagnose eines vermuteten PH-LHF mit erhöhtem systolischen pulmonalarteriellen Druck, gemessen per Echokardiographie, zu bestätigen oder um die Hämodynamik zu bewerten und zu überwachen, oder bei Patienten, deren körperliche Belastbarkeit trotz optimaler leitliniengerechter Behandlung abgenommen hatte. RHC und Linksherzkatheterisierung wurden verwendet, um hämodynamische Parameter zu erhalten, während eine quantitative Koronarangiographie verwendet wurde, um angiographische Parameter zu messen.Als pulmonale Hypertonie bezeichnet man einen Anstieg des mittleren pulmonalarteriellen Drucks (mPAP) ≥ 25 mmHg im Ruhezustand, und PH-LHF ist definiert als postkapilläre PH mit mPAP ≥ 25 mmHg und pulmonalarteriellem Verschlussdruck (PAWP) > 15 mmHg im Ruhezustand gemäß Beurteilung durch RHC, präkapilläre PH ist definiert als mPAP ≥ 25 mmHg und PAWP ≤ 15 mmHg (
2
). Als koronare Herzkrankheit (KHK) gilt das Vorliegen von mindestens einem Koronarstenoseherd von über 50 % oder eine ärztlich dokumentierte KHK-Anamnese (Daten von in anderen Krankenhäusern durchgeführten Koronarangiographien liegen nicht vor). Der Schweregrad der KHK wurde anhand des Gensini-Scores beurteilt (
12
). Bei der ischämischen Kardiomyopathie (ICM) handelt es sich um eine Funktionsstörung des linken Ventrikels (LV) mit einer linksventrikulären Ejektionsfraktion (LVEF) ≤ 40 % aufgrund einer KHK (
13
). HFpEF ist definiert als LVEF ≥ 50 % und HFrEF als LVEF < 50 %. Die geschätzte glomeruläre Filtrationsrate (eGFR) wurde mit der Cockcroft-Gault-Gleichung berechnet (
14
).Alle aufgenommenen Patienten verfügten über zweidimensionale Echokardiographie- und RHC-Daten. Anamnese, demografische Daten, klinische und radiologische Basisdaten, Laborergebnisse und Behandlungen wurden aus unseren Datenbankaufzeichnungen der Registerstudie überprüft.Endpunkt und Follow-upDer Endpunkt dieser Studie war die Gesamtmortalität. Die Nachuntersuchungen erfolgten per Telefon, Nachrichten und ambulanten Besuchen alle 6 Monate ± 2 Wochen. Die Patienten wurden vom Zeitpunkt der Diagnose PH-LHF bis zum Endpunkt (Tod) oder bis zum Stichtag dieser Studie (Oktober 2021) nachbeobachtet. Patienten, die nicht nachbeobachtet werden konnten, wurden bei den letzten bekannten Nachuntersuchungsdaten zensiert.Fehlende und extreme DatenDie verbleibenden Variablen wurden mithilfe mehrerer Imputationen interpoliert, bevor sie zur Analyse in das multivariable Modell eingegeben wurden. Fehlende Daten wurden als das gleichzeitige Fehlen beider Werte für Variablen mit gleicher klinischer Bedeutung, wie BNP und NT-proBNP, definiert. Biomarkerwerte unterhalb der Nachweisgrenze wurden auf die Hälfte dieses Wertes festgelegt, während Werte oberhalb der Nachweisgrenze auf den oberen Grenzwert festgelegt wurden.Statistische AnalyseDie statistische Analyse erfolgte mit der Software R (Version 4.0.2) und SPSS (Version 24.0). Kontinuierliche Variablen wurden als Mittelwert ± Standardabweichung für normalverteilte Daten ausgedrückt. Bei schiefen Verteilungen wurden Median und Interquartilsabstand (IQR, 25.–75. Perzentil) und ihre Unterschiede zwischen den Gruppen mit dem ungepaarten zweiseitigen t- Test oder dem Mann-Whitney- U -Test verglichen. Kategoriale Variablen wurden als Anzahlen und Prozentsätze (%) dargestellt. Die Unterschiede zwischen den Gruppen wurden entweder mit Pearsons Chi-Quadrat-Test (alle Erwartungswerte nicht kleiner als 5) oder Fishers exaktem Test (alle Erwartungswerte kleiner als 5) verglichen. Zur Beurteilung der mit PH-LHF verbundenen Faktoren wurde eine logistische Regressionsanalyse verwendet. Die durch univariate Regressionsmodelle ( p < 0,10) ermittelten Variablen wurden dann in das multivariable logistische Regressionsmodell aufgenommen, um festzustellen, ob sie PH-LHF unabhängig beeinflussen könnten. Die kontinuierlichen Variablen wurden in kategorische Variablen umgewandelt, die in einer logistischen Regressionsanalyse durch einen Median oder Mittelwert bestimmt wurden. Wir verwendeten die Kaplan-Meier-Methode, um die kumulative Inzidenz des Endpunkts zu schätzen, indem wir die Daten von Patienten zensierten, deren Nachbeobachtung verloren ging. Die Überlebensanalyse wurde mithilfe der Kaplan-Meier-Überlebensanalysemethode mit dem Log-Rank-Test beschrieben. Eine multivariante proportionale Cox-Risiko-Regression mit der Vorwärts-LR-Analysemethode (vorwärts schrittweise Regression basierend auf der Maximum-Likelihood-Schätzung) wurde verwendet, um die Wirkung der Variablen auf die Überlebenszeit zu bewerten, was Daten als Hazard Ratio (HR) mit einem 95%-KI ergab. Die Variablen wurden auf Grundlage klinischer Expertise, früherer Literatur und univariater Analysen in das multivariante Cox-Modell aufgenommen. Die Proportionalität der Gefahren wurde für jede Variable bewertet. Wir überprüften die Annahme der proportionalen Gefahren, indem wir die statistische Signifikanz der Wechselwirkungen zwischen Nachbeobachtungszeit und Variablen testeten. Die statistische Signifikanz wurde auf einen zweiseitigen p -Wert < 0,05 festgelegt.ErgebnisseBasismerkmale von Patienten mit LinksherzinsuffizienzInsgesamt wurden 480 Patienten mit LHF aufgenommen, von denen 106 (22,1 %) eine HFrEF und 374 (77,9 %) eine HFpEF aufwiesen. Diese LHF-Patienten waren überwiegend männlich ( n = 357, 74,4 %) und litten an CAD ( n = 378, 78,8 %). Von diesen CAD-Patienten wurde bei 283 (74,9 %) eine Angiographie und bei 95 (25,1 %) eine ärztlich dokumentierte CAD-Anamnese bestätigt. Die PH-LHF-Patientengruppe hatte einen höheren BMI, Harnsäure, NT-proBNP und einen höheren Prozentsatz an HFrEF sowie Funktionsklasse (FC) III/IV als die Nicht-PH-LHF-Gruppe (
Tabelle 1
). Der linksatriale anteriorposteriore Durchmesser (LAAPD), der linksventrikuläre enddiastolische Durchmesser (LVEDD), der rechtsventrikuläre anteriorposteriore Ventrikeldurchmesser (RVAPD), mPAP und der linksventrikuläre enddiastolische Druck (LVEDP) waren bei PH-LHF-Patienten alle höher. Weitere Ausgangswerte sowie demografische, klinische und hämodynamische Merkmale von Patienten mit PH-LHF und Nicht-PH-LHF sind in
Tabelle 1
aufgeführt . Fehlende Werte für die Kovariatenvariablen lagen zwischen 0,2 % für LAAPD und 11,5 % für natriuretische Peptide (
Tabelle 1
). TBELLE 1
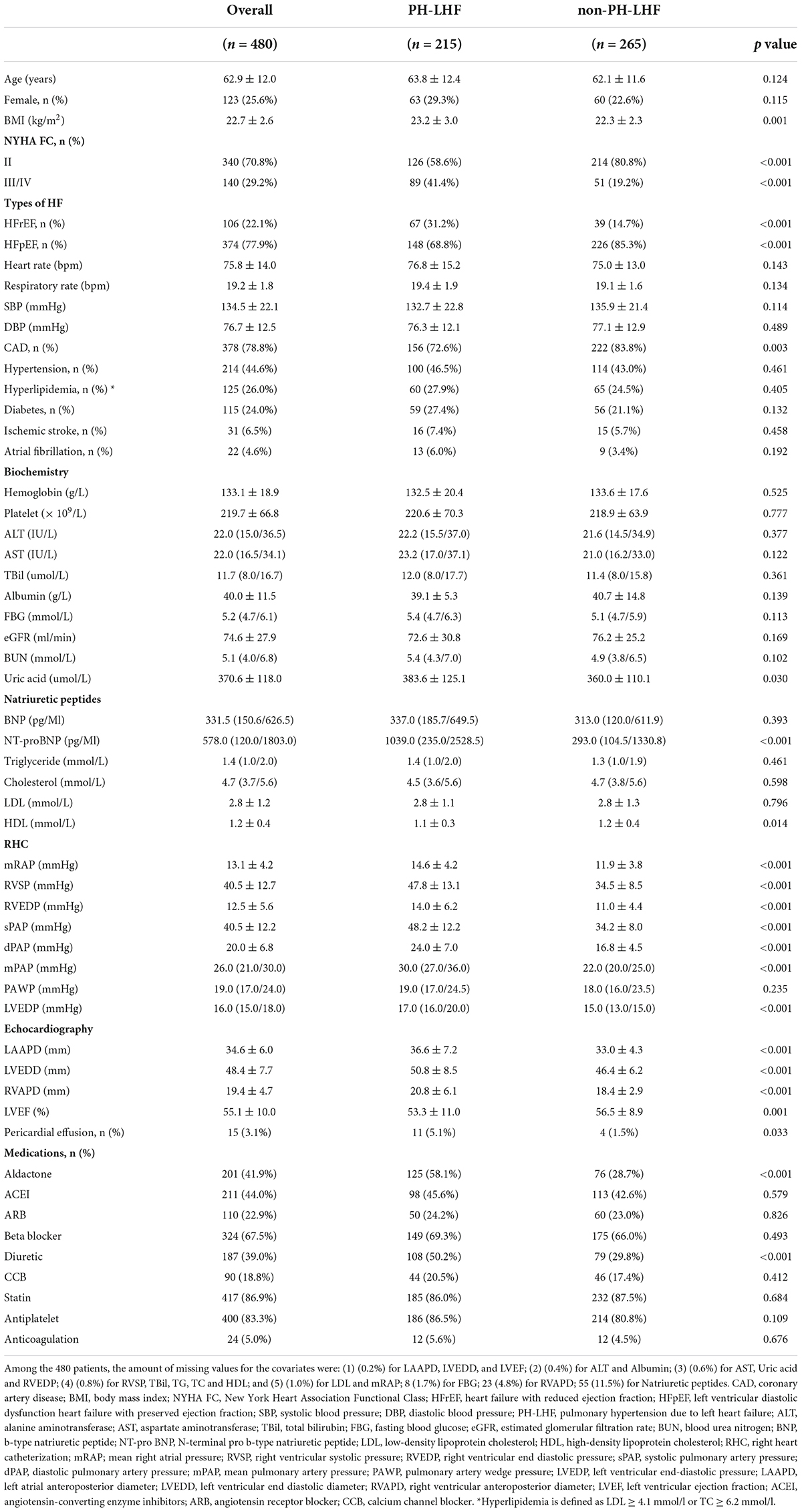 Tabelle 1. Demografische, klinische und hämodynamische Basismerkmale aller aufgenommenen Patienten, Patienten mit PH-LHF und Nicht-PH-LHF. Anteil der pulmonalen Hypertonie aufgrund von Linksherzinsuffizienz in Gruppen mit koronarer Herzkrankheit und ohne koronarer HerzkrankheitBei diesen LHF-Patienten war der Anteil der mit PH-LHF diagnostizierten Patienten in der CAD-Gruppe signifikant niedriger als bei den Patienten ohne CAD (41,3 vs. 57,8 %, p = 0,003). Es gab keine signifikanten Unterschiede zwischen den Gruppen bei der präkapillären PH (15,1 vs. 14,7 %, p = 0,925). Eine univariate logistische Regressionsanalyse zeigte, dass CAD mit einem geringeren Risiko für die Entwicklung von PH-LHF verbunden ist (OR: 0,512, 95 % CI: 0,329 – 0,798, p = 0,003) (
Abbildung 2
). Eine multivariable logistische Regressionsanalyse zeigte jedoch, dass CAD nicht mit PH-LHF verbunden ist (angepasstes OR: 1,055, 95 % CI: 0,576 – 1,935, p = 0,862). Nur HFrEF und RVAPD waren unabhängig mit PH-LHF verbunden (
Abbildung 2
). Die Ergebnisse zu den unabhängigen prädiktiven Faktoren für PH-LHF bei LHF-Patienten blieben im logistischen Regressionsmodell stabil, einschließlich des Zentrums als Zufallseffekt (
Ergänzende Tabelle 1
). ABILDUNG 2
Tabelle 1. Demografische, klinische und hämodynamische Basismerkmale aller aufgenommenen Patienten, Patienten mit PH-LHF und Nicht-PH-LHF. Anteil der pulmonalen Hypertonie aufgrund von Linksherzinsuffizienz in Gruppen mit koronarer Herzkrankheit und ohne koronarer HerzkrankheitBei diesen LHF-Patienten war der Anteil der mit PH-LHF diagnostizierten Patienten in der CAD-Gruppe signifikant niedriger als bei den Patienten ohne CAD (41,3 vs. 57,8 %, p = 0,003). Es gab keine signifikanten Unterschiede zwischen den Gruppen bei der präkapillären PH (15,1 vs. 14,7 %, p = 0,925). Eine univariate logistische Regressionsanalyse zeigte, dass CAD mit einem geringeren Risiko für die Entwicklung von PH-LHF verbunden ist (OR: 0,512, 95 % CI: 0,329 – 0,798, p = 0,003) (
Abbildung 2
). Eine multivariable logistische Regressionsanalyse zeigte jedoch, dass CAD nicht mit PH-LHF verbunden ist (angepasstes OR: 1,055, 95 % CI: 0,576 – 1,935, p = 0,862). Nur HFrEF und RVAPD waren unabhängig mit PH-LHF verbunden (
Abbildung 2
). Die Ergebnisse zu den unabhängigen prädiktiven Faktoren für PH-LHF bei LHF-Patienten blieben im logistischen Regressionsmodell stabil, einschließlich des Zentrums als Zufallseffekt (
Ergänzende Tabelle 1
). ABILDUNG 2
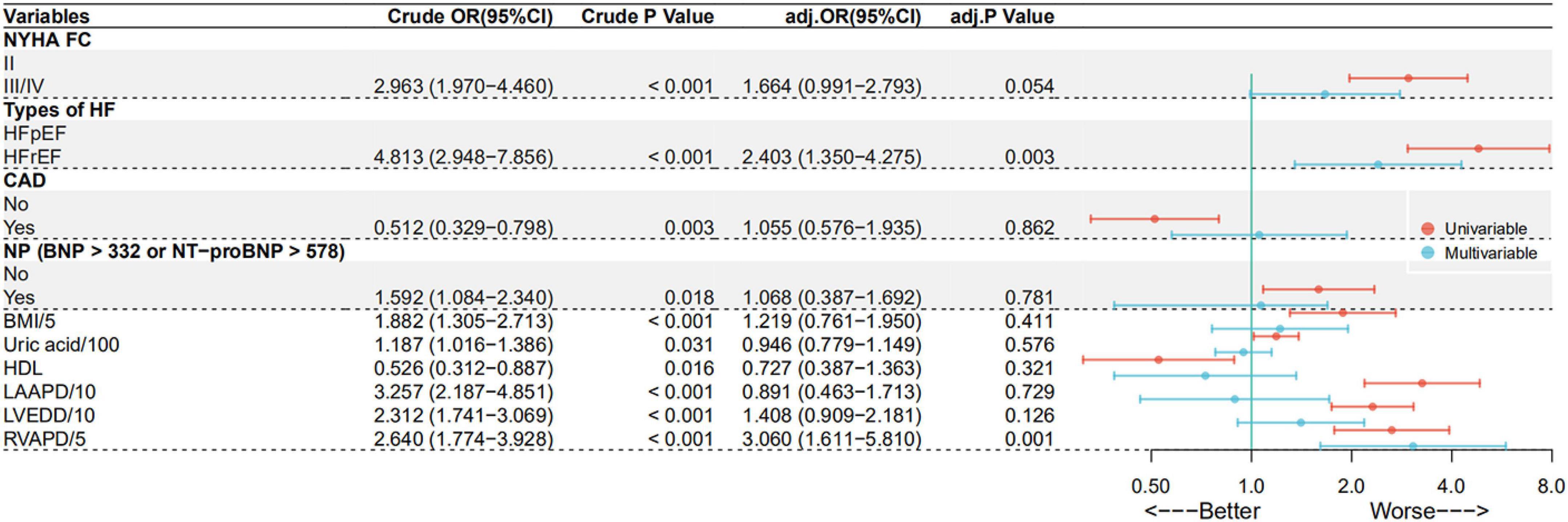 Abbildung 2. Vorhersagefaktoren für PH-LHF bei LHF-Patienten in univariater und multivariater logistischer Regressionsanalyse. Langfristige NachbeobachtungGrundlegende Charakteristika der pulmonalen Hypertonie bei Patienten mit LinksherzinsuffizienzVon allen aufgenommenen LHF-Patienten wurden 215 Patienten durch RHC mit PH-LHF diagnostiziert, mit einem Gesamtanteil von 44,8 %. Von diesen PH-LHF-Patienten hatten 156 (72,6 %) CAD. Das Durchschnittsalter und die LVEF waren bei CAD-Patienten höher. Zudem hatte die CAD-Gruppe einen höheren FC II- und HFpEF-Prozentsatz als die Patienten ohne CAD (
Tabelle 2
). Herzfrequenz, NT-proBNP, mPAP, LVEDP, LAAPD und RVAPD waren bei den Patienten mit CAD signifikant niedriger (
Tabelle 2 ). Weitere Basisdaten sowie demografische, klinische und hämodynamische Merkmale von PH-LHF-Patienten mit und ohne CAD sind in
Tabelle 2
aufgeführt . TBELLE 2
Abbildung 2. Vorhersagefaktoren für PH-LHF bei LHF-Patienten in univariater und multivariater logistischer Regressionsanalyse. Langfristige NachbeobachtungGrundlegende Charakteristika der pulmonalen Hypertonie bei Patienten mit LinksherzinsuffizienzVon allen aufgenommenen LHF-Patienten wurden 215 Patienten durch RHC mit PH-LHF diagnostiziert, mit einem Gesamtanteil von 44,8 %. Von diesen PH-LHF-Patienten hatten 156 (72,6 %) CAD. Das Durchschnittsalter und die LVEF waren bei CAD-Patienten höher. Zudem hatte die CAD-Gruppe einen höheren FC II- und HFpEF-Prozentsatz als die Patienten ohne CAD (
Tabelle 2
). Herzfrequenz, NT-proBNP, mPAP, LVEDP, LAAPD und RVAPD waren bei den Patienten mit CAD signifikant niedriger (
Tabelle 2 ). Weitere Basisdaten sowie demografische, klinische und hämodynamische Merkmale von PH-LHF-Patienten mit und ohne CAD sind in
Tabelle 2
aufgeführt . TBELLE 2
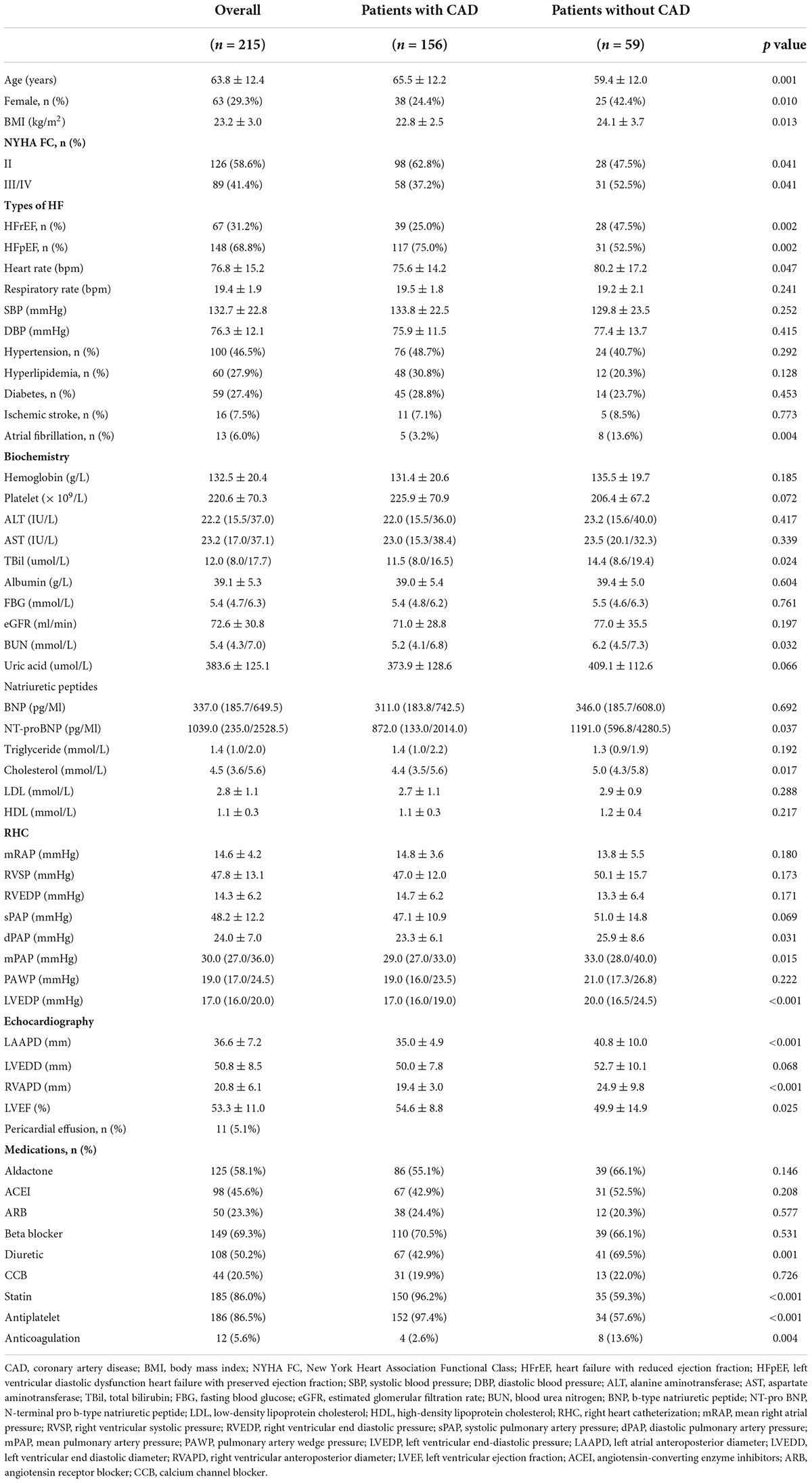 Tabelle 2. Demografische, klinische und hämodynamische Basismerkmale aller Patienten mit PH-LHF, Patienten mit CAD und ohne CAD. Die Häufigkeit von EndpunktereignissenWir haben eine Langzeitnachbeobachtung von Patienten mit PH-LHF durchgeführt. Während einer medianen Nachbeobachtungszeit von 84,6 Monaten (Bereich: 0,1 bis 106,8 Monate) verstarben 75 Patienten (34,9 %), darunter 35 Patienten mit plötzlichem Tod, 39 Patienten mit fortgeschrittener Herzinsuffizienz und ein Patient mit septischem Schock. Zudem erhielten fünf Patienten während der Nachbeobachtung eine perkutane Koronarintervention. Kein Patient unterzog sich einer Transplantation, einem Koronararterien-Bypass oder einer Implantation eines implantierbaren Kardioverter-Defibrillators oder erhielt andere Unterstützungsgeräte. Insgesamt 202 Patienten (94,0 %) wurden mindestens 3 Jahre lang nachbeobachtet (von der Aufnahme in die Studie bis zum Todesdatum oder für mindestens 3 Jahre). Insgesamt 32 Patienten (14,9 %) gingen verloren. Diese Patienten konnten mehr als dreimal weder per Telefon, Nachricht, über das Krankenhaussystem noch auf andere Weise erreicht werden. Die kumulative Gesamtgefahrenkurve ist in
Abbildung 3A
dargestellt . Die 1-, 3-, 5- und 8-Jahres-Überlebensraten aller PH-LHF-Patienten betrugen 94,3, 76,9, 65,8 bzw. 60,2 %. ABILDUNG 3
Tabelle 2. Demografische, klinische und hämodynamische Basismerkmale aller Patienten mit PH-LHF, Patienten mit CAD und ohne CAD. Die Häufigkeit von EndpunktereignissenWir haben eine Langzeitnachbeobachtung von Patienten mit PH-LHF durchgeführt. Während einer medianen Nachbeobachtungszeit von 84,6 Monaten (Bereich: 0,1 bis 106,8 Monate) verstarben 75 Patienten (34,9 %), darunter 35 Patienten mit plötzlichem Tod, 39 Patienten mit fortgeschrittener Herzinsuffizienz und ein Patient mit septischem Schock. Zudem erhielten fünf Patienten während der Nachbeobachtung eine perkutane Koronarintervention. Kein Patient unterzog sich einer Transplantation, einem Koronararterien-Bypass oder einer Implantation eines implantierbaren Kardioverter-Defibrillators oder erhielt andere Unterstützungsgeräte. Insgesamt 202 Patienten (94,0 %) wurden mindestens 3 Jahre lang nachbeobachtet (von der Aufnahme in die Studie bis zum Todesdatum oder für mindestens 3 Jahre). Insgesamt 32 Patienten (14,9 %) gingen verloren. Diese Patienten konnten mehr als dreimal weder per Telefon, Nachricht, über das Krankenhaussystem noch auf andere Weise erreicht werden. Die kumulative Gesamtgefahrenkurve ist in
Abbildung 3A
dargestellt . Die 1-, 3-, 5- und 8-Jahres-Überlebensraten aller PH-LHF-Patienten betrugen 94,3, 76,9, 65,8 bzw. 60,2 %. ABILDUNG 3
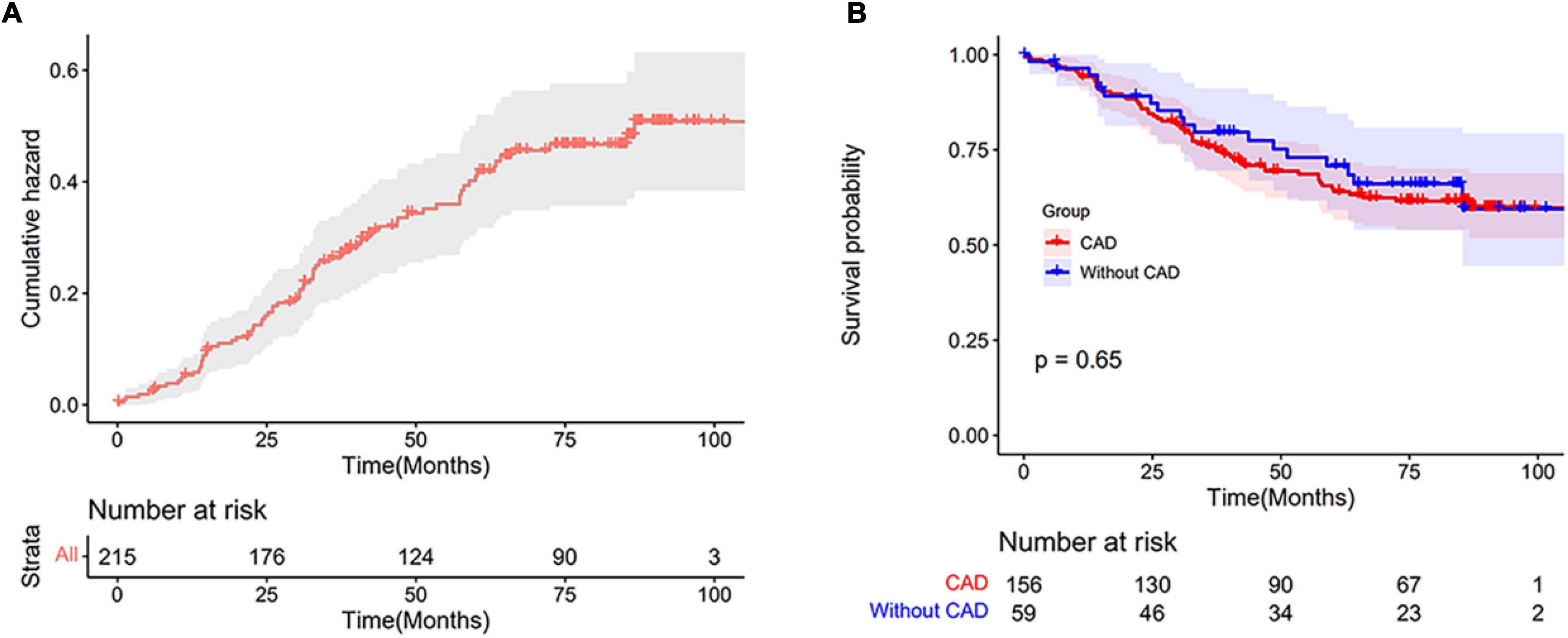 Abbildung 3. (A) Die kumulative Gefahrenkurve von Patienten mit PH-LHF. (
Abbildung 3. (A) Die kumulative Gefahrenkurve von Patienten mit PH-LHF. ( Kaplan-Meier-Schätzungen des Überlebens bei PH-LHF-Patienten mit CAD und ohne CAD. Eine Kaplan-Meier-Überlebensanalyse ergab keine Unterschiede in der Mortalität zwischen den Gruppen mit und ohne CAD (
Abbildung 3B
). Die HFpEF- und HFrEF-Untergruppenanalyse ergab ebenfalls keine Unterschiede in der Mortalität zwischen den Gruppen mit und ohne CAD (
Ergänzende Abbildung 1
). Es wurden Sensitivitätsanalysen durchgeführt, um die Auswirkungen des fehlenden Ergebnisses auf das Überleben zu untersuchen. Diese Analyse geht davon aus, dass Patienten, deren Nachbeobachtung verloren ging, verstorben sind oder am Leben waren. Die Ergebnisse ergaben keinen signifikanten Unterschied in der Mortalität zwischen Patienten mit und ohne CAD (
Ergänzende Abbildung 2
). Die 1-, 3-, 5- und 8-Jahres-Überlebensraten von PH-LHF-Patienten mit CAD lagen bei 94,2, 75,9, 64,0 bzw. 59,8 %. Die 1-, 3-, 5- und 8-Jahres-Überlebensraten von PH-LHF-Patienten ohne CAD lagen bei 94,6, 79,7, 70,8 bzw. 59,5 %. Anhand der Anzahl der Gefäße mit Koronarstenosen, der Gensini-Scores und des ICM zur Definition der CAD-Untergruppen konnten wir keine Unterschiede hinsichtlich der Mortalität zwischen diesen Untergruppen und der Gruppe ohne CAD feststellen (
Ergänzende Abbildung 3
).Es wurde eine Untergruppenanalyse nach den Basismerkmalen zwischen den Gruppen mit und ohne CAD durchgeführt. In diesen Untergruppen gab es keinen Trend zu einem erhöhten Endpunktrisiko in der CAD-Gruppe. Die Analyse ergab keine signifikanten Wechselwirkungen zwischen dem Endpunkt und den Stratifizierungsvariablen (
Abbildung 4
). ABILDUNG 4
Kaplan-Meier-Schätzungen des Überlebens bei PH-LHF-Patienten mit CAD und ohne CAD. Eine Kaplan-Meier-Überlebensanalyse ergab keine Unterschiede in der Mortalität zwischen den Gruppen mit und ohne CAD (
Abbildung 3B
). Die HFpEF- und HFrEF-Untergruppenanalyse ergab ebenfalls keine Unterschiede in der Mortalität zwischen den Gruppen mit und ohne CAD (
Ergänzende Abbildung 1
). Es wurden Sensitivitätsanalysen durchgeführt, um die Auswirkungen des fehlenden Ergebnisses auf das Überleben zu untersuchen. Diese Analyse geht davon aus, dass Patienten, deren Nachbeobachtung verloren ging, verstorben sind oder am Leben waren. Die Ergebnisse ergaben keinen signifikanten Unterschied in der Mortalität zwischen Patienten mit und ohne CAD (
Ergänzende Abbildung 2
). Die 1-, 3-, 5- und 8-Jahres-Überlebensraten von PH-LHF-Patienten mit CAD lagen bei 94,2, 75,9, 64,0 bzw. 59,8 %. Die 1-, 3-, 5- und 8-Jahres-Überlebensraten von PH-LHF-Patienten ohne CAD lagen bei 94,6, 79,7, 70,8 bzw. 59,5 %. Anhand der Anzahl der Gefäße mit Koronarstenosen, der Gensini-Scores und des ICM zur Definition der CAD-Untergruppen konnten wir keine Unterschiede hinsichtlich der Mortalität zwischen diesen Untergruppen und der Gruppe ohne CAD feststellen (
Ergänzende Abbildung 3
).Es wurde eine Untergruppenanalyse nach den Basismerkmalen zwischen den Gruppen mit und ohne CAD durchgeführt. In diesen Untergruppen gab es keinen Trend zu einem erhöhten Endpunktrisiko in der CAD-Gruppe. Die Analyse ergab keine signifikanten Wechselwirkungen zwischen dem Endpunkt und den Stratifizierungsvariablen (
Abbildung 4
). ABILDUNG 4
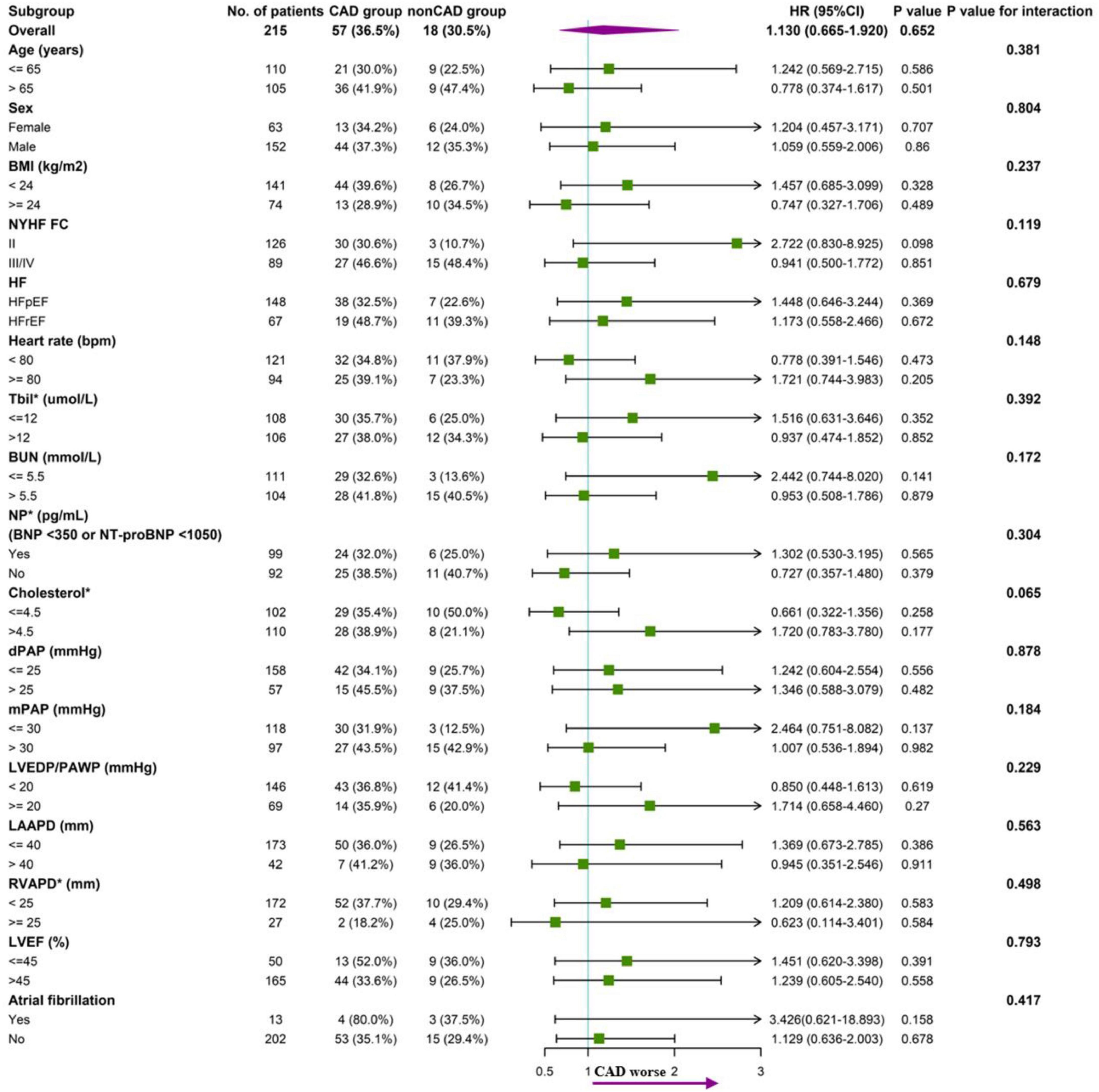 Abbildung 4. Forest-Plot der Untergruppenanalyse des Zusammenhangs zwischen CAD und Endpunkt (Gesamtmortalität) mit p- Wert für die Interaktion. Prädiktoren der Mortalität bei Patienten mit pulmonaler Hypertonie aufgrund einer LinksherzinsuffizienzEine univariate Cox-proportionale Risiko-Regressionsanalyse zeigte, dass Alter, NYHA-FC, HF-Typ (HFpEF oder HFrEF), Hämoglobin, BUN, RVSP, sPAP, dPAP und mPAP signifikante Prädiktoren der Mortalität bei PH-LHF-Patienten sind. Allerdings waren nur NYHA-FC, Hämoglobin und sPAP signifikante Prädiktoren der Mortalität in der multivariaten Cox-proportionalen Risiko-Regressionsanalyse (
Abbildung 5
). Die Prädiktoren der Mortalität für PH-LHF blieben auch im Cox-proportionalen Risiko-Regressionsmodell signifikant, einschließlich des Zentrums als Zufallseffekt (
Ergänzende Tabelle 2
). ABILDUNG 5
Abbildung 4. Forest-Plot der Untergruppenanalyse des Zusammenhangs zwischen CAD und Endpunkt (Gesamtmortalität) mit p- Wert für die Interaktion. Prädiktoren der Mortalität bei Patienten mit pulmonaler Hypertonie aufgrund einer LinksherzinsuffizienzEine univariate Cox-proportionale Risiko-Regressionsanalyse zeigte, dass Alter, NYHA-FC, HF-Typ (HFpEF oder HFrEF), Hämoglobin, BUN, RVSP, sPAP, dPAP und mPAP signifikante Prädiktoren der Mortalität bei PH-LHF-Patienten sind. Allerdings waren nur NYHA-FC, Hämoglobin und sPAP signifikante Prädiktoren der Mortalität in der multivariaten Cox-proportionalen Risiko-Regressionsanalyse (
Abbildung 5
). Die Prädiktoren der Mortalität für PH-LHF blieben auch im Cox-proportionalen Risiko-Regressionsmodell signifikant, einschließlich des Zentrums als Zufallseffekt (
Ergänzende Tabelle 2
). ABILDUNG 5
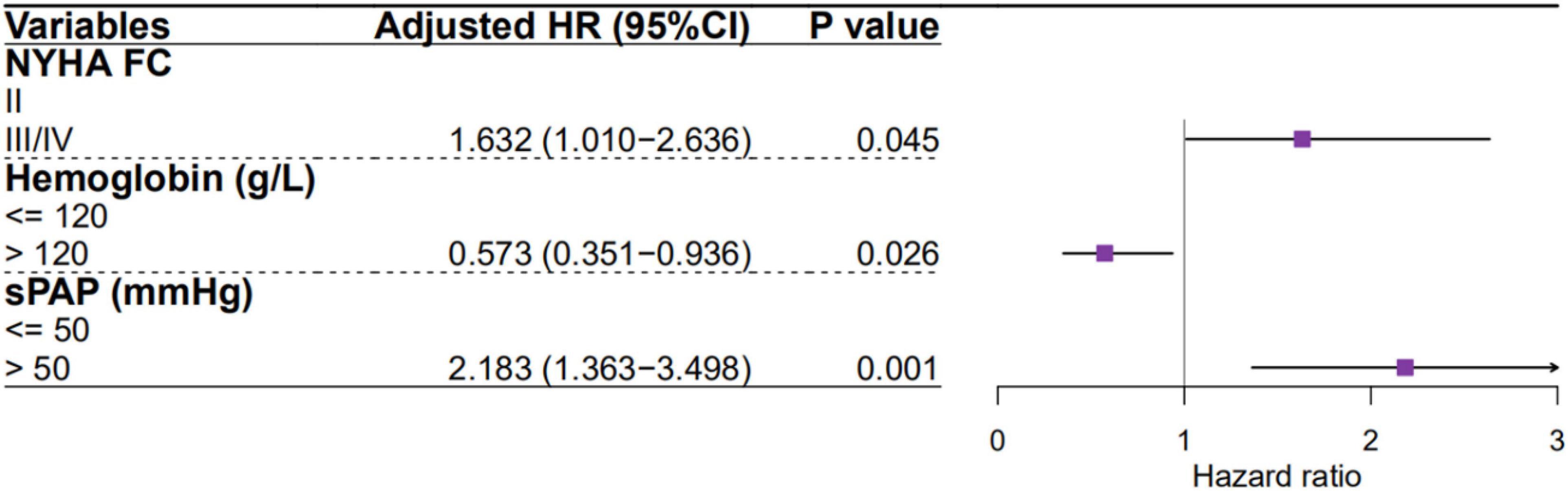 Abbildung 5. Prädiktoren der Mortalität für PH-LHF-Patienten in der multivariaten Cox-proportionalen Gefahren-Regressionsanalyse. DiskussionDiese Studie zur Analyse invasiver hämodynamischer Daten aus einer relativ großen Kohorte zeigt eine hohe Prävalenz von PH bei Patienten mit LHF und dass Patienten mit PH-LHF weiterhin eine schlechte Prognose haben. Wir fanden heraus, dass etwa 45 % der LHF-Patienten die Studienkriterien für PH-LHF erfüllten, wenn sie sich einer RHC unterzogen (39,6 % für PH-HFpEF, 63,2 % für HFrEF) und ein höherer Anteil (57,8 %) in der Gruppe ohne CAD im Vergleich zur CAD-Gruppe (41,3 %).In Studien, die auf dem Goldstandard (RHC) als Diagnosekriterium für PH-LHF bei Patienten basierten, betrug die Prävalenz von PH-HFpEF und PH-HFrEF 46 bzw. 73 % (
3
,
15
), was den in unserer Studie berichteten Werten (39,6 bzw. 63,2 %) relativ ähnlich war. Unsere Studie liefert wichtige und zuverlässige Daten, um die Prävalenz von PH-LHF bei Patienten mit LHF aufzuzeigen.Die Pathogenese von PH als Komorbidität von LHF ist kompliziert und höchst heterogen und ist noch immer nur teilweise verstanden. Einfach ausgedrückt ist der primäre hämodynamische Treiber von PH-LHF eine beeinträchtigte systolische oder diastolische Funktion des linken Ventrikels (LV). Eine Funktionsstörung des LV führt zu einer Vergrößerung des linken Vorhofs (LA) und verringert die Kontraktilität und Compliance des LA. Der LA verliert allmählich seine Fähigkeit als Pufferreservoir vor dem Lungenkreislauf (PC) zu dienen, was letztendlich zu einer erhöhten Pulsation des PC führt und zu PH führt (
16
). Bei ähnlichem mittleren LA-Druck waren die LA-Volumina höher und die systolische Funktion bei HFrEF stärker beeinträchtigt als bei HFpEF und die allgemeine LA-Funktion (korreliert mit erhöhtem pulmonalvaskulären Widerstand und verringerter pulmonalarterieller Compliance) war bei HFrEF stärker beeinträchtigt als bei HFpEF (
17
). Wir vermuten, dass dies bei HFrEF stärker zur Entwicklung von PH-LHF beiträgt als bei HFpEF. Die aktuelle Studie zeigt, dass HFrEF ein unabhängiger prädiktiver Faktor für PH-LHF ist (angepasstes OR: 2,403, 95% CI: 1,350 – 4,275, p = 0,003). CAD, Hypertonie und dilatative Kardiomyopathie (DCM) sind die häufigsten Ursachen von LHF (
18
). CAD kommt sowohl bei HFpEF als auch bei HFrEF häufig vor (
19
). DCM war in den Ätiologien von HFpEF nicht enthalten, da der Begriff DCM als LVEF < 50 % definiert war (
20
). LHF-Patienten ohne CAD haben ein höheres Risiko für DCM und damit auch für HFrEF. Unsere Studie zeigte, dass die Gruppe ohne CAD einen höheren Prozentsatz an HFrEF aufwies als die Gruppe mit CAD (37,3 vs. 18,0 %, p < 0,001). Daher kann die höhere Prävalenz von PH-LHF in der Gruppe ohne CAD in dieser Studie auf den höheren Prozentsatz an HFrEF zurückzuführen sein.Wenn sich bei Patienten mit LHF eine PH entwickelt, verringert dies ihre körperliche Belastbarkeit dramatisch, verstärkt die Symptomlast und verschlechtert die Prognose. Selbst ein leichter Anstieg des pulmonalarteriellen Drucks innerhalb des akzeptierten Normbereichs ist mit einer höheren Sterblichkeit verbunden (
21
–
23
). Frühere Studien berichteten, dass die 5-Jahres-Gesamtmortalität bei PH-LHF zwischen 48,5 und 52,0 % lag (
3
,
24
). Unsere Studie berichtete von einer niedrigeren 5-Jahres-Gesamtmortalität von 34,2 % bei Patienten mit PH-LHF. Wir vermuten, dass dies an der relativ hohen Rate verlorener Nachuntersuchungen (14,9 %) in unserer Studie liegt, wodurch die Sterblichkeit unterschätzt wird. Dennoch untermauern unsere Ergebnisse die insgesamt schlechte Prognose von PH-LHF. Es ist allgemein anerkannt, dass die verschiedenen Ätiologien oder Komorbiditäten bei LHF-Patienten eine unterschiedliche Mortalität aufweisen. Frühere Studien berichteten, dass HFrEF ischämischen Ursprungs eine höhere Mortalität aufwies als HFrEF aufgrund nicht-ischämischer Ursachen (
25
,
26
). Eine Studie zur Prognose von Patienten mit HFpEF berichtete, dass eine spezielle Phänogruppe, die alle Patienten mit CAD umfasste, eine signifikant andere Mortalität aufwies als andere Phänogruppen (
27
). Unsere Studie ergab jedoch keine signifikanten Unterschiede in der Mortalität zwischen den Gruppen mit CAD und ohne CAD bei HFrEF und HFpEF (
Ergänzende Abbildung 2
). Die Wiederholung der Analyse mit ICM und ohne CAD ergab nahezu identische Ergebnisse. Darüber hinaus blieben die Ergebnisse in der Untergruppenanalyse stabil (
Abbildung 4
). Daher spekulieren wir, dass der Effekt von CAD auf den Langzeitverlauf von Patienten mit LHF verschwinden könnte, sobald sich bei ihnen ein PH-LHF entwickelt.Bei Herzinsuffizienz mit reduzierter Ejektionsfraktion wird allgemein eine schlechtere Überlebenschance angenommen als bei HFpEF. Mehrere Beobachtungsstudien zeigen jedoch, dass dieser Unterschied vernachlässigbar ist (
28
,
29
). Eine kürzlich durchgeführte Studie zur Untersuchung der Langzeitergebnisse bei LHF-Patienten berichtete, dass die Mortalität unabhängig von der HF (HFrEF oder HFpEF) war, während die NYHA-FC ein signifikanter Prädiktor der Gesamtmortalität war (
30
). Ebenso zeigt unsere Studie, dass die Art der HF kein unabhängiger Prädiktor der Mortalität bei PH-LHF-Patienten war, die NYHA-FC jedoch schon (
Abbildung 5
). Agarwal et al. berichteten auch, dass die FC ein unabhängig vorhergesagter Mortalitätsfaktor bei PH-LHF war (
31
). Dies weist darauf hin, dass wir während der Nachbeobachtung von PH-LHF-Patienten der FC mehr Aufmerksamkeit schenken sollten als der Art der HF.Anämie ist eine sehr häufige Komorbidität bei Patienten mit LHF, sie betrifft etwa ein Drittel der LHF-Patienten (
32
). Ebenso lag die Prävalenz von Anämie bei LHF-Patienten in unserer Studie bei 32,9 %. Das Vorhandensein von Anämie ist unabhängig mit schlechter FC und erhöhter Gesamtmortalität bei Patienten mit LHF verbunden (
33
,
34
). Die vorliegende Studie berichtete auch, dass die Verringerung des Hämoglobinspiegels mit einem deutlich erhöhten Mortalitätsrisiko bei PH-LHF-Patienten einhergeht (
Abbildung 5
). Der Mechanismus der erhöhten Mortalität bei LHF-Patienten mit Anämie könnte auf chronische Gewebehypoxie zurückzuführen sein (
33
). Daher empfehlen wir, alle PH-LHF-Patienten mit Anämie auf die zugrunde liegenden Ursachen zu untersuchen und entsprechend der aktuellen Leitlinien zu behandeln.Wir fanden heraus, dass sPAP der stärkste Risikofaktor für die Mortalität bei Patienten mit PH-LHF ist (
Abbildung 5
). Frühere Studien haben auch berichtet, dass sPAP mit der Mortalität bei PH-LHF in Zusammenhang stand (
9
,
15
). Dies deutet darauf hin, dass der pulmonalarterielle Druck bei Patienten mit PH-LHF genau überwacht werden sollte, während das zugrunde liegende LHF aktiv behandelt wird. Obwohl selektive pulmonale Vasodilatatoren bei PH-HF nach wie vor nicht empfohlen werden (
2
,
35
), profitieren einige bestimmte Untergruppen immer noch von den selektiven pulmonalen Vasodilatatoren (
36
). Zukünftige Studien sollten sich auf Patienten konzentrieren, deren Linksherzfunktion sich nach der Behandlung des LHF verbessert hat (PAWP ≤ 15 mmHg), der pulmonalarterielle Druck aber weiterhin erhöht ist, um PH-LHF-Patienten auszusortieren, die empfindlich auf selektive pulmonale Vasodilatatoren reagieren.Einschränkungen der StudieBei der Interpretation dieser Ergebnisse müssen mehrere Aspekte berücksichtigt werden. Erstens handelt es sich um eine retrospektive Analyse einer prospektiven Kohortenstudie mit vererbten Einschränkungen, einschließlich einer möglichen Auswahlverzerrung. Zweitens betrug die Rate verlorener Nachuntersuchungen in unserer Studie 14,9 %. Die Ergebnisse blieben jedoch in der Sensitivitätsanalyse stabil. Schließlich ist der Parameter des pulmonal-vaskulären Widerstands nicht verfügbar. Daher konnten die beiden Formen der PH-LHF (isolierte postkapilläre PH und kombinierte postkapilläre und präkapilläre PH) nicht unterschieden werden.AbschlussPH der Gruppe 2 wird häufig bei Patienten mit LHF festgestellt und seine Prävalenz ist bei Patienten mit CAD niedriger als bei Patienten ohne CAD. Die Mortalität ist bei Patienten mit PH-LHF immer noch hoch, was zeigt, dass die Entwicklung einer Risikotabelle zur Untersuchung von Hochrisikopatienten für eine genauere Überwachung und Intensivierung der Behandlung die Prognose verbessern kann. FC, Hämoglobin und sPAP sind unabhängige Risikoprädiktoren der Mortalität bei PH-LHF. Diese Erkenntnisse können für die Risikostratifizierung bei der Aufnahme in zukünftige klinische Studien nützlich sein.
Abbildung 5. Prädiktoren der Mortalität für PH-LHF-Patienten in der multivariaten Cox-proportionalen Gefahren-Regressionsanalyse. DiskussionDiese Studie zur Analyse invasiver hämodynamischer Daten aus einer relativ großen Kohorte zeigt eine hohe Prävalenz von PH bei Patienten mit LHF und dass Patienten mit PH-LHF weiterhin eine schlechte Prognose haben. Wir fanden heraus, dass etwa 45 % der LHF-Patienten die Studienkriterien für PH-LHF erfüllten, wenn sie sich einer RHC unterzogen (39,6 % für PH-HFpEF, 63,2 % für HFrEF) und ein höherer Anteil (57,8 %) in der Gruppe ohne CAD im Vergleich zur CAD-Gruppe (41,3 %).In Studien, die auf dem Goldstandard (RHC) als Diagnosekriterium für PH-LHF bei Patienten basierten, betrug die Prävalenz von PH-HFpEF und PH-HFrEF 46 bzw. 73 % (
3
,
15
), was den in unserer Studie berichteten Werten (39,6 bzw. 63,2 %) relativ ähnlich war. Unsere Studie liefert wichtige und zuverlässige Daten, um die Prävalenz von PH-LHF bei Patienten mit LHF aufzuzeigen.Die Pathogenese von PH als Komorbidität von LHF ist kompliziert und höchst heterogen und ist noch immer nur teilweise verstanden. Einfach ausgedrückt ist der primäre hämodynamische Treiber von PH-LHF eine beeinträchtigte systolische oder diastolische Funktion des linken Ventrikels (LV). Eine Funktionsstörung des LV führt zu einer Vergrößerung des linken Vorhofs (LA) und verringert die Kontraktilität und Compliance des LA. Der LA verliert allmählich seine Fähigkeit als Pufferreservoir vor dem Lungenkreislauf (PC) zu dienen, was letztendlich zu einer erhöhten Pulsation des PC führt und zu PH führt (
16
). Bei ähnlichem mittleren LA-Druck waren die LA-Volumina höher und die systolische Funktion bei HFrEF stärker beeinträchtigt als bei HFpEF und die allgemeine LA-Funktion (korreliert mit erhöhtem pulmonalvaskulären Widerstand und verringerter pulmonalarterieller Compliance) war bei HFrEF stärker beeinträchtigt als bei HFpEF (
17
). Wir vermuten, dass dies bei HFrEF stärker zur Entwicklung von PH-LHF beiträgt als bei HFpEF. Die aktuelle Studie zeigt, dass HFrEF ein unabhängiger prädiktiver Faktor für PH-LHF ist (angepasstes OR: 2,403, 95% CI: 1,350 – 4,275, p = 0,003). CAD, Hypertonie und dilatative Kardiomyopathie (DCM) sind die häufigsten Ursachen von LHF (
18
). CAD kommt sowohl bei HFpEF als auch bei HFrEF häufig vor (
19
). DCM war in den Ätiologien von HFpEF nicht enthalten, da der Begriff DCM als LVEF < 50 % definiert war (
20
). LHF-Patienten ohne CAD haben ein höheres Risiko für DCM und damit auch für HFrEF. Unsere Studie zeigte, dass die Gruppe ohne CAD einen höheren Prozentsatz an HFrEF aufwies als die Gruppe mit CAD (37,3 vs. 18,0 %, p < 0,001). Daher kann die höhere Prävalenz von PH-LHF in der Gruppe ohne CAD in dieser Studie auf den höheren Prozentsatz an HFrEF zurückzuführen sein.Wenn sich bei Patienten mit LHF eine PH entwickelt, verringert dies ihre körperliche Belastbarkeit dramatisch, verstärkt die Symptomlast und verschlechtert die Prognose. Selbst ein leichter Anstieg des pulmonalarteriellen Drucks innerhalb des akzeptierten Normbereichs ist mit einer höheren Sterblichkeit verbunden (
21
–
23
). Frühere Studien berichteten, dass die 5-Jahres-Gesamtmortalität bei PH-LHF zwischen 48,5 und 52,0 % lag (
3
,
24
). Unsere Studie berichtete von einer niedrigeren 5-Jahres-Gesamtmortalität von 34,2 % bei Patienten mit PH-LHF. Wir vermuten, dass dies an der relativ hohen Rate verlorener Nachuntersuchungen (14,9 %) in unserer Studie liegt, wodurch die Sterblichkeit unterschätzt wird. Dennoch untermauern unsere Ergebnisse die insgesamt schlechte Prognose von PH-LHF. Es ist allgemein anerkannt, dass die verschiedenen Ätiologien oder Komorbiditäten bei LHF-Patienten eine unterschiedliche Mortalität aufweisen. Frühere Studien berichteten, dass HFrEF ischämischen Ursprungs eine höhere Mortalität aufwies als HFrEF aufgrund nicht-ischämischer Ursachen (
25
,
26
). Eine Studie zur Prognose von Patienten mit HFpEF berichtete, dass eine spezielle Phänogruppe, die alle Patienten mit CAD umfasste, eine signifikant andere Mortalität aufwies als andere Phänogruppen (
27
). Unsere Studie ergab jedoch keine signifikanten Unterschiede in der Mortalität zwischen den Gruppen mit CAD und ohne CAD bei HFrEF und HFpEF (
Ergänzende Abbildung 2
). Die Wiederholung der Analyse mit ICM und ohne CAD ergab nahezu identische Ergebnisse. Darüber hinaus blieben die Ergebnisse in der Untergruppenanalyse stabil (
Abbildung 4
). Daher spekulieren wir, dass der Effekt von CAD auf den Langzeitverlauf von Patienten mit LHF verschwinden könnte, sobald sich bei ihnen ein PH-LHF entwickelt.Bei Herzinsuffizienz mit reduzierter Ejektionsfraktion wird allgemein eine schlechtere Überlebenschance angenommen als bei HFpEF. Mehrere Beobachtungsstudien zeigen jedoch, dass dieser Unterschied vernachlässigbar ist (
28
,
29
). Eine kürzlich durchgeführte Studie zur Untersuchung der Langzeitergebnisse bei LHF-Patienten berichtete, dass die Mortalität unabhängig von der HF (HFrEF oder HFpEF) war, während die NYHA-FC ein signifikanter Prädiktor der Gesamtmortalität war (
30
). Ebenso zeigt unsere Studie, dass die Art der HF kein unabhängiger Prädiktor der Mortalität bei PH-LHF-Patienten war, die NYHA-FC jedoch schon (
Abbildung 5
). Agarwal et al. berichteten auch, dass die FC ein unabhängig vorhergesagter Mortalitätsfaktor bei PH-LHF war (
31
). Dies weist darauf hin, dass wir während der Nachbeobachtung von PH-LHF-Patienten der FC mehr Aufmerksamkeit schenken sollten als der Art der HF.Anämie ist eine sehr häufige Komorbidität bei Patienten mit LHF, sie betrifft etwa ein Drittel der LHF-Patienten (
32
). Ebenso lag die Prävalenz von Anämie bei LHF-Patienten in unserer Studie bei 32,9 %. Das Vorhandensein von Anämie ist unabhängig mit schlechter FC und erhöhter Gesamtmortalität bei Patienten mit LHF verbunden (
33
,
34
). Die vorliegende Studie berichtete auch, dass die Verringerung des Hämoglobinspiegels mit einem deutlich erhöhten Mortalitätsrisiko bei PH-LHF-Patienten einhergeht (
Abbildung 5
). Der Mechanismus der erhöhten Mortalität bei LHF-Patienten mit Anämie könnte auf chronische Gewebehypoxie zurückzuführen sein (
33
). Daher empfehlen wir, alle PH-LHF-Patienten mit Anämie auf die zugrunde liegenden Ursachen zu untersuchen und entsprechend der aktuellen Leitlinien zu behandeln.Wir fanden heraus, dass sPAP der stärkste Risikofaktor für die Mortalität bei Patienten mit PH-LHF ist (
Abbildung 5
). Frühere Studien haben auch berichtet, dass sPAP mit der Mortalität bei PH-LHF in Zusammenhang stand (
9
,
15
). Dies deutet darauf hin, dass der pulmonalarterielle Druck bei Patienten mit PH-LHF genau überwacht werden sollte, während das zugrunde liegende LHF aktiv behandelt wird. Obwohl selektive pulmonale Vasodilatatoren bei PH-HF nach wie vor nicht empfohlen werden (
2
,
35
), profitieren einige bestimmte Untergruppen immer noch von den selektiven pulmonalen Vasodilatatoren (
36
). Zukünftige Studien sollten sich auf Patienten konzentrieren, deren Linksherzfunktion sich nach der Behandlung des LHF verbessert hat (PAWP ≤ 15 mmHg), der pulmonalarterielle Druck aber weiterhin erhöht ist, um PH-LHF-Patienten auszusortieren, die empfindlich auf selektive pulmonale Vasodilatatoren reagieren.Einschränkungen der StudieBei der Interpretation dieser Ergebnisse müssen mehrere Aspekte berücksichtigt werden. Erstens handelt es sich um eine retrospektive Analyse einer prospektiven Kohortenstudie mit vererbten Einschränkungen, einschließlich einer möglichen Auswahlverzerrung. Zweitens betrug die Rate verlorener Nachuntersuchungen in unserer Studie 14,9 %. Die Ergebnisse blieben jedoch in der Sensitivitätsanalyse stabil. Schließlich ist der Parameter des pulmonal-vaskulären Widerstands nicht verfügbar. Daher konnten die beiden Formen der PH-LHF (isolierte postkapilläre PH und kombinierte postkapilläre und präkapilläre PH) nicht unterschieden werden.AbschlussPH der Gruppe 2 wird häufig bei Patienten mit LHF festgestellt und seine Prävalenz ist bei Patienten mit CAD niedriger als bei Patienten ohne CAD. Die Mortalität ist bei Patienten mit PH-LHF immer noch hoch, was zeigt, dass die Entwicklung einer Risikotabelle zur Untersuchung von Hochrisikopatienten für eine genauere Überwachung und Intensivierung der Behandlung die Prognose verbessern kann. FC, Hämoglobin und sPAP sind unabhängige Risikoprädiktoren der Mortalität bei PH-LHF. Diese Erkenntnisse können für die Risikostratifizierung bei der Aufnahme in zukünftige klinische Studien nützlich sein.
Prävalenz und Überleben der pulmonalen Hypertonie aufgrund einer Linksherzinsuffizienz: Eine retrospektive Analyse einer multizentrischen prospektiven KohortenstudieHintergrund: Pulmonale Hypertonie aufgrund einer Linksherzinsuffizienz (PH-LHF) ist derzeit die häufigste Form der pulmonalen Hypertonie (PH), die in der klinischen Praxis auftritt. Trotz erheblicher Fortschritte, die unser Verständnis von PH-LHF in den letzten zwei Jahrzehnten verbessert haben, ist die Sterblichkeit in den letzten Jahrzehnten immer noch hoch. Ziel dieser Studie war es, die Prävalenz und das Überleben von Patienten mit PH-LHF zu beschreiben und die potenziellen Risikofaktoren zu untersuchen, die die Prognose von PH-LHF vorhersagen können.Methoden: Es wurde eine retrospektive Analyse einer prospektiven Kohortenstudie von Patienten mit Linksherzinsuffizienz (LHF) durchgeführt, die zwischen Januar 2013 und November 2016 einer Rechtsherzkatheterisierung (RHC) unterzogen wurden. Der Endpunkt war die Gesamtmortalität. Nachuntersuchungen wurden alle 6 Monate ± 2 Wochen durchgeführt.Ergebnisse: Insgesamt wurden 480 Patienten mit LHF in die Studie aufgenommen, davon 215 (44,8 %) mit PH-LHF. Der Anteil an PH-LHF war in der Gruppe mit koronarer Herzkrankheit (KHK) signifikant niedriger als in der Gruppe ohne KHK (41,3 vs. 57,8 %, p = 0,003). Eine multivariable logistische Regressionsanalyse ergab jedoch, dass KHK nicht mit PH-LHF assoziiert war (angepasstes OR: 1,055, 95 % KI: 0,576 – 1,935, p = 0,862). 75 von 215 (34,9 %) Patienten mit PH-LHF starben während eines medianen Nachbeobachtungszeitraums von 84,6 Monaten. Die 1-, 3-, 5- und 8-Jahres-Überlebensraten aller PH-LHF-Patienten lagen bei 94,3, 76,9, 65,8 bzw. 60,2 %. Die New York Heart Association Functional Class (NYHA FC), Hämoglobin und der systolische pulmonalarterielle Druck (sPAP) wurden in der multivarianten Cox-Analyse mit der Mortalität von PH-LHF in Zusammenhang gebracht.Schlussfolgerung: PH tritt häufig bei Patienten mit LHF auf, die Prävalenz liegt bei etwa 45 %. Die Mortalität ist bei Patienten mit PH-LHF immer noch hoch. NYHA FC, Hämoglobin und sPAP sind unabhängige Risikoprädiktoren für die Mortalität bei PH-LHF. Diese Erkenntnisse können für die Risikostratifizierung bei der Aufnahme in zukünftige klinische Studien nützlich sein. EinführungPulmonale Hypertonie (PH) hat sich weltweit zu einem zunehmend verbreiteten Gesundheitsproblem entwickelt. Sie betrifft schätzungsweise 1 % der Weltbevölkerung und steigt bei Personen über 65 Jahren auf bis zu 10 % an ( 1 ). Klinisch wird PH in fünf Gruppen eingeteilt: PH aufgrund einer Linksherzinsuffizienz (PH-LHF) wird der Gruppe 2 zugeordnet und ist definiert als postkapilläre PH [mittlerer pulmonalarterieller Druck (mPAP) ≥ 25 mmHg und pulmonalarterieller Verschlussdruck (PAWP) > 15 mmHg] ( 2 ). Die Gesamtinzidenz der Linksherzinsuffizienz (LHF) nimmt aufgrund des rapiden weltweiten Anstiegs der Zahl der über 65-Jährigen zu. LHF entwickelt sich zu einer der Hauptursachen von PH und betrifft etwa 5 % aller Personen im Alter von 65 Jahren und älter ( 1 , 3 , 4 ).Pulmonale Hypertonie aufgrund einer Linksherzinsuffizienz ist eine häufige Komorbidität einer diastolischen Dysfunktion des linken Ventrikels – Herzinsuffizienz mit erhaltener Ejektionsfraktion (HFpEF) oder Herzinsuffizienz mit reduzierter Ejektionsfraktion (HFrEF). Die in früheren Studien berichtete Prävalenz liegt zwischen 40 und 75 % für PH-HFrEF und zwischen 36 und 83 % für PH-HFpEF ( 1 , 5 ). Diese Prävalenz ist jedoch das Ergebnis einer uneinheitlichen Anwendung des Golddiagnosestandards (RHC). Einige Berichte beispielsweise stützen sich auf den per Echokardiographie gemessenen systolischen Pulmonalarteriendruck (PASP) oder verwenden andere Diagnosekriterien ( 6 , 7 ). Daher ist die wahre Prävalenz der PH-LHF unklar.Die Mortalität von Patienten mit LHF ist in den letzten zwei Jahrzehnten deutlich gesunken ( 8 ). Allerdings ist die Mortalität von PH-LHF in den letzten Jahren immer noch hoch ( 3 , 9 ). Die Überlebensrate bei PH-LHF ist im Vergleich zu Patienten mit pulmonaler arterieller Hypertonie (PAH) geringer ( 3 ). Für PAH gibt es mehrere praktische Risikotabellen zur Stratifizierung der Prognose, die Behandlungsziele und Nachsorgestrategien vorgeben ( 2 , 10 ). Für PH-LHF ist jedoch keine praktische und verlässliche Risikotabelle verfügbar. Die Identifizierung potenzieller Risikofaktoren kann hilfreich sein, um das Problem der hohen Mortalität bei PH-LHF-Patienten zu lindern. Dementsprechend waren die Ziele dieser Studie: (1) die Prävalenz von PH bei Patienten mit LHF zu beschreiben; (2) eine langfristige Nachbeobachtung von Patienten mit PH-LHF zu planen und durchzuführen, um die Überlebensrate abzuschätzen und (3) die potenziellen Risikofaktoren zu untersuchen, die den Tod von PH-LHF vorhersagen können.Materialen und MethodenStudiendesign und TeilnehmerWir haben eine retrospektive Analyse einer prospektiven, multizentrischen Registerstudie mit LHF-Patienten durchgeführt, die zwischen Januar 2013 und November 2016 einer Rechtsherzkatheterisierung unterzogen wurden. Das Studiendesign und das Flussdiagramm zur Patientenauswahl sind in Abbildung 1 dargestellt . Das Studienprotokoll wurde vom Institutional Review Board des Fuwai Hospital genehmigt (Genehmigungsnummer 2012-401), gemäß der Deklaration von Helsinki durchgeführt und auf ClinicalTrials.gov registriert (Kennung: NCT02164526). Von allen aufgenommenen Patienten wurde eine schriftliche Einverständniserklärung eingeholt. ABILDUNG 1







OMNIA TEMPUS HABENT
Diagnose IPAH im Februar 2013, in Behandlung bei OA Dr. Ulrich Krüger, jetzt Dr. Fischer Herzzentrum Duisburg, Medikamente: Sildenafil, Bosentan jetzt Macitentan, Subkutane Treprostinilpumpe, seit Januar 2024 getunnelter ZVK mit externer Pumpe (Groshongkatheter), 24/7 Sauerstoff, Marcumar, Diuretika
Bitte Anmelden oder Registrieren um der Konversation beizutreten.
