- Beiträge: 1727
Sidebar
- Forum
- PH-Forum
- Forschung und Wissen
- Dünne Luft, dicke Gefäße: Historische und aktuelle Perspektiven zur hypoxischen
Dünne Luft, dicke Gefäße: Historische und aktuelle Perspektiven zur hypoxischen
16 Jul 2024 20:18 #2157
von danny
OMNIA TEMPUS HABENT
Diagnose IPAH im Februar 2013, in Behandlung bei OA Dr. Ulrich Krüger, jetzt Dr. Fischer Herzzentrum Duisburg, Medikamente: Sildenafil, Bosentan jetzt Macitentan, Subkutane Treprostinilpumpe, seit Januar 2024 getunnelter ZVK mit externer Pumpe (Groshongkatheter), 24/7 Sauerstoff, Marcumar, Diuretika
Dünne Luft, dicke Gefäße: Historische und aktuelle Perspektiven zur hypoxischen wurde erstellt von danny
www.frontiersin.org/journals/medicine/ar...fmed.2019.00093/full
Dünne Luft, dicke Gefäße: Historische und aktuelle Perspektiven zur hypoxischen pulmonalen HypertonieDer Zusammenhang zwischen pulmonaler Hypertonie (PH) und Hypoxie ist gut belegt. Zwei wichtige mechanistische Prozesse – hypoxische pulmonale Vasokonstriktion und durch Hypoxie induzierte Gefäßumgestaltung – führen zu Veränderungen des pulmonalarteriellen Drucks. Im Gegensatz zu anderen Formen der pulmonalen Hypertonie sind die durch Hypoxie induzierten Gefäßveränderungen reversibel, sowohl bei Menschen, die aus großer Höhe auf Meereshöhe zurückkehren, als auch bei Tiermodellen. Dies wirft die faszinierende Möglichkeit auf, dass die molekularen Treiber dieser hypoxischen Prozesse gezielt eingesetzt werden könnten, um die pulmonale Gefäßumgestaltung in anderen Zusammenhängen zu verändern. In dieser Übersicht skizzieren wir die Geschichte der Forschung zu PH und Hypoxie, bevor wir die jüngsten Fortschritte in unserem Verständnis dieser Beziehung auf molekularer Ebene diskutieren und uns auf die Rolle der sauerstoffempfindlichen Transkriptionsfaktoren, Hypoxie-induzierbaren Faktoren (HIFs), konzentrieren. Neue Verbindungen zwischen HIF und Gefäßumbau unterstreichen den potenziellen Nutzen einer Hemmung dieses Signalwegs bei pulmonaler Hypertonie und weisen auf mögliche Risiken einer Aktivierung dieses Signalwegs durch HIF-stabilisierende Medikamente hin. EinführungPulmonale Hypertonie (PH) ist ein Merkmal mehrerer verschiedener klinischer Phänotypen, die auf unterschiedliche Weise zu einem erhöhten Druck in den Lungengefäßen führen. Trotz einiger Fortschritte in der Behandlung in den letzten Jahren ( 1 ) sind die meisten Formen der PH progressiv und lebensbegrenzend. In der aktuellen Klassifikation der PH-Ätiologie ist Gruppe III (PH aufgrund von Lungenerkrankungen und/oder Hypoxie) nach Herzerkrankungen die zweithäufigste Ursache für erhöhten pulmonalarteriellen Druck ( 2 ). Gruppe III umfasst ein breites Spektrum von Erkrankungen wie chronisch obstruktive Lungenerkrankung (COPD), interstitielle Lungenerkrankung (ILD) und Schlafapnoe ( 3 ). Neben Parenchymveränderungen tragen zwei wichtige pathologische Prozesse zur Entstehung von PH bei dieser Patientengruppe bei: pulmonale Gefäßumbau und Vasokonstriktion, aber die Behandlung mit pulmonalen Vasodilatatoren war bisher enttäuschend. Neue Ansätze in der Behandlung dieser Patienten sind daher dringend erforderlich, um die Ergebnisse zu verbessern, da die 3-Jahres-Überlebensrate bei COPD-Patienten mit einem mittleren Pulmonalarteriendruck von >40 mmHg nach wie vor bei nur 33 % liegt ( 1 , 2 , 4 ). Während die pathologischen Mechanismen je nach Grunderkrankung oder Phänotyp unterschiedlich sein können, kann ein besseres Verständnis der entscheidenden Komponente von Erkrankungen der Gruppe III, der Hypoxie, dazu beitragen, neue Ziele für Therapien zu finden.Ein kausaler Zusammenhang zwischen Hypoxie und PH ist gut belegt; Hypoxie wird häufig verwendet, um sowohl PH in Tiermodellen auszulösen ( 5 ) als auch um abweichende Zellphänotypen in vitro zu induzieren ( 6 ). Diese Ansätze haben unser Verständnis der zugrunde liegenden physiologischen Mechanismen, die die Pathologie vorantreiben, erheblich verbessert. Überzeugende Beweise für die Auswirkungen von Hypoxie auf den Lungengefäßtonus und die Umgestaltung bei Menschen stammen aus Studien, die in großen Höhen durchgeführt wurden, wo die damit verbundene Verringerung des Luftdrucks zu hypobarer Hypoxie führt. Dieser Ansatz ist vorteilhaft für die Bewertung der Auswirkungen von Hypoxie auf das Lungengefäßsystem in relativer Isolation, ohne die komplizierenden Faktoren der Krankheit. In dieser Übersicht skizzieren wir den historischen Kontext der Forschung zu PH und Hypoxie und diskutieren neue molekulare Mechanismen für diesen Zusammenhang. Wir konzentrieren uns auf die Rolle der sauerstoffempfindlichen Transkriptionsfaktoren, der Hypoxie-induzierbaren Faktoren (HIFs) und der Verbindungen zwischen HIFs und der Gefäßumgestaltung.Wichtige DefinitionenBevor wir mit dieser Übersichtsarbeit beginnen, ist es wichtig, die in diesem und anderen Manuskripten verwendeten Definitionen von PH zu beachten. Der Begriff PH wird verwendet, um eine Erhöhung des mittleren pulmonalarteriellen Drucks (mPAP) jeglicher Ursache zu beschreiben. PH wurde erstmals auf dem 1. Weltsymposium für pulmonale Hypertonie (WSPH) im Jahr 1973 als ein mPAP über 25 mmHg klassifiziert ( 7 ). Bemerkenswert ist, dass beim kürzlich stattgefundenen 6. WSPH die obere Normgrenze für mPAP auf 20 mmHg festgelegt wurde. Dies wurde teilweise mit neueren Hinweisen auf eine geringere Überlebensrate bei Patienten mit mPAPs von 21 bis 24 mmHg und teilweise mit der Verteilung der Werte in Daten gesunder Bevölkerung begründet ( 8 ). Für die Diagnose einer präkapillären pulmonalen Hypertonie jeglicher Ursache ist auch ein erhöhter pulmonaler Gefäßwiderstand (PVR > 3 WU) erforderlich ( 8 ). Präkapilläre Hämodynamik, die der obigen Definition entspricht, ist bei Patienten mit Lungenerkrankungen nicht ungewöhnlich ( 4 , 9 ). Die Prävalenz eines erhöhten PVR bei gesunden Personen mit Hypoxie ohne Lungenerkrankung, z. B. bei Menschen in Höhenlagen und bei Personen mit Schlafapnoe, ist jedoch weniger klar und wird später erörtert ( 10 ). Um Verwirrungen zu vermeiden, haben wir, soweit möglich, Werte (±SD) aus der zitierten Literatur einbezogen, die den aufgezeichneten pulmonalarteriellen Druck und/oder PVR angeben.Pulmonale Hypertonie: Eine GeschichtePathologische Veränderungen der Pulmonalarterien zusammen mit einer rechtsventrikulären Hypertrophie (RVH) wurden erstmals gegen Ende des 19. Jahrhunderts von dem deutschen Arzt Ernst von Romberg beobachtet, der den Begriff „pulmonalvaskuläre Sklerose“ prägte ( 11 ). Die Ätiologie der PH war zu diesem Zeitpunkt jedoch noch unklar, und sie wurde viele Jahre lang fälschlicherweise der Syphilis zugeschrieben ( 12 , 13 ). Obwohl der britische Kardiologe Oscar Brenner diesen Zusammenhang im Jahr 1935 schließlich widerlegte, konnte er keine Erklärung für das Zusammentreffen von Lungengefäßveränderungen und RVH liefern ( 14 ). Erst mit der Einführung der Rechtsherzkatheterisierung Mitte des 20. Jahrhunderts wurden diese Beobachtungen untrennbar mit einem erhöhten pulmonalarteriellen Druck (PAP) verknüpft. Trotz umfangreicher Anwendung bei Tieren im frühen 20. Jahrhundert galt die Herzkatheterisierung beim Menschen allgemein als unsicher, bis Werner Forssman im Jahr 1929 einen mutigen Selbstkatheterismus seines rechten Herzens beging ( 15 , 16 ). Während dieser mutige Akt der Tapferkeit in der medizinischen Gemeinschaft zunächst schlecht aufgenommen und weitgehend ignoriert wurde, erkannten die amerikanischen Ärzte Dickinson Richards und Andrew Cournard in den 40er Jahren die Bedeutung von Forssmans Arbeit. Ihre bahnbrechende Forschung charakterisierte erstmals mPAP bei Herz- und Lungenerkrankungen, eine Leistung, für die sie 1956 gemeinsam mit Forssman mit einem Nobelpreis ausgezeichnet wurden ( 17 , 18 ).In weiteren Arbeiten in den 1950er Jahren wurden die klinischen und pathologischen Merkmale der PH ermittelt. Eine der ersten detaillierten Beschreibungen der hämodynamischen Profile der Krankheit wurde 1951 von David Dresdale geliefert. Er beobachtete auch Zyanose, Orthopnoe und Hämoptyse bei Patienten mit idiopathischer PH. Dresdale und andere bezeichneten ihre Befunde als „primäre pulmonale Hypertonie“ ( 19 , 20 ); diese Terminologie lieferte eine wichtige Nomenklatur für die damals entstehende Forschungsgemeinschaft. Darüber hinaus wurde eine umfassende Charakterisierung der histologischen Veränderungen bei PH von Donald Heath vorgenommen. In Zusammenarbeit mit William Whitaker beschrieb er 1953 erstmals eine ausgedehnte Verdickung der Pulmonalarterienwand in Verbindung mit einer Fibrose bei Personen mit angeborenem Herzfehler, Mitralstenose und idiopathischer PH ( 21 , 22 ). Heath und Jesse Edwards entwickelten anschließend ein detailliertes histologisches Klassifikationssystem, das mit dem Schweregrad der PH beim Eisenmenger-Syndrom korrelierte und von einer frühen vaskulären Mediahypertrophie bei leichter PH bis zur späten Intimafibrose bei schwerer Erkrankung reichte ( 23 ).Frühe Zusammenhänge zwischen akuter Hypoxie und pulmonaler HypertonieObwohl erhöhter PAP erstmals 1852 mit Atemversagen in Zusammenhang gebracht wurde ( 24 ), wurde ein kausaler Zusammenhang zwischen Hypoxie und PH erst 1946 festgestellt, als von Euler und Kollegen erhöhte mPAP-Werte nachwiesen, wenn Katzen sowohl Hypoxie als auch Hyperkapnie ausgesetzt wurden ( 25 ); 1947 berichtete Dresdale über ähnliche Befunde bei Menschen ( 26 ). Diese Berichte stellten die ersten Messungen einer Verengung der pulmonalarteriolen durch Hypoxie bzw. einer hypoxischen pulmonalen Vasokonstriktion (HPV) dar, eines Phänotyps, der den vasodilatatorischen Eigenschaften der Hypoxie auf den Systemkreislauf gegenübersteht ( 27 ). Damals stellte von Euler zutreffend die Hypothese auf, dass diese physiologische Reaktion vorteilhaft sei, um Blut aus Bereichen regionaler Lungenhypoxie, die auf eine verringerte Ventilation zurückzuführen ist, abzuleiten und so die Sauerstoffsättigung des Blutes aufrechtzuerhalten (ein Konzept, das heute als Ventilations-Perfusions-Matching bezeichnet wird).Die negativen Auswirkungen dieser Reaktion im Kontext einer allgemeineren alveolären Hypoxie wurden jedoch bald offensichtlich, insbesondere in Bezug auf das Höhenlungenödem (HAPE). Während schon früher bei Höhenreisenden ein Syndrom mit Husten, blutigem Auswurf und schwerer Atemnot festgestellt worden war, war Hurtado 1937 der Erste, der dies einem Lungenödem zuschrieb ( 28 ). Eine gleichzeitige PH und HAPE wurde erstmals 1962 von Fred et al. ( 29 ) bei einem Patienten mit einem mPAP von 46 mmHg festgestellt , obwohl Hultgren und Spickard diesen Zusammenhang bereits 1960 vorgeschlagen hatten, als sie in 41 Fällen von HAPE in Peru klinisch einen lauten zweiten Herzton und elektrographische Veränderungen beschrieben, die mit einer PH übereinstimmten ( 30 ). Hultgren et al. bestätigten dies anschließend bei sieben Personen nach akuter Höhenexposition im Jahr 1964, bei denen mPAP-Werte zwischen 33 und 117 mmHg lagen (PVR wurde bei 2 Patienten berichtet; 8 und 36 WU). Wichtig ist, dass die Autoren auch eine gewisse Reversibilität des Lungenödems und des erhöhten mPAP bei Gabe von 100% Sauerstoff nachweisen konnten ( 31 ). Weitere Arbeiten dieser und anderer Gruppen ( 32 ) ergaben eine Prädisposition für ein Lungenödem bei fünf Personen mit mPAP-Werten von 38,8 ± 10,3 mmHg beim Aufstieg auf 3.100 m ( 33 ).Obwohl PH schon früh als Faktor in der Pathogenese von HAPE identifiziert wurde, ist weiterhin unklar, wie dies zur Ödembildung führt. Hultgren schlug vor, dass aufgrund der Heterogenität von HPV Bereiche der Lunge überdurchblutet werden, was zu einem Versagen der pulmonalkapillaren Stressbelastung bei HAPE führt ( 34 ). Tatsächlich haben nachfolgende Studien an HAPE-anfälligen Personen Hinweise auf eine übertriebene Heterogenität der Durchblutung erbracht ( 35 ), während hämodynamische Studien auch erhöhte pulmonalkapillare Drücke (19 ± 1 mmHg vs. 13 ± 1 mmHg bei den Kontrollen) und arterielle Drücke (mPAP 37 ± 2 mmHg vs. 26 ± 1 mmHg bei den Kontrollen) bei solchen Personen in großen Höhen gezeigt haben ( 36 ). Weitere Faktoren in der Pathogenese von HAPE sind eine beeinträchtigte Stickoxid-(NO)-Biosynthese und eine verringerte Reabsorption von Alveolarflüssigkeit, wie hier besprochen ( 37 , 38 ).Chronische Hypoxie und Umbau des LungengefäßsystemsGleichzeitig begann man mit der Untersuchung der Auswirkungen chronischer Hypoxie auf die Lungengefäße von Höhenpopulationen. Dies begann zunächst bei Rindern, die in großen Höhen häufig erhebliche Ödeme im unteren Brustbereich entwickelten, die sogenannte „Brisket Disease“, eine Erkrankung, die beim Aufstieg eine erhebliche Sterblichkeitsrate verursachte. In den 40er Jahren stellte Rue Jensen erstmals eine Dilatation und Insuffizienz des rechten Ventrikels zusammen mit einer Brisket Disease bei Höhenrinderpopulationen in Colorado fest ( 39 ); in weiteren Arbeiten mit Grover, Reeves und Will wurde eine positive Korrelation zwischen der Schwere der RVH und dem Grad des erhöhten PAP-Werts festgestellt ( 40 ). Weitere Zuchtexperimente unter der Leitung von Grover und Reeves deuteten auf einen autosomal-dominanten Erbgang der HAPH bei diesen Rindern hin ( 41 , 42 ). Im Gegensatz zu Hultgrens späteren Befunden bei Patienten mit HAPE ( 31 ) kehrte 100 % Sauerstoff die PH bei Rindern nicht vollständig um ( 40 ), was auf eine geringere Rolle von HPV in der PH-Pathogenese im Rahmen von chronischer Hypoxie hindeutet. Interessanterweise wurden ähnliche Befunde bei einer menschlichen Population von Anand et al. dokumentiert, die Hinweise auf periphere Ödeme und Kurzatmigkeit bei indischen Soldaten beschrieben, die sich 18 Wochen lang in Höhen über 5.800 m aufgehalten hatten. Obwohl in der Höhe keine Messungen durchgeführt wurden, lieferten Rechtsherzkatheteruntersuchungen dieser Patienten kurz nach der Rückkehr auf Meereshöhe Hinweise auf eine leichte präkapilläre pulmonale Hypertonie mit mPAP- und PVR-Werten von 26,1 ± 4,5 mmHg bzw. 3,41 ± 2,46 WU ( 43 ).Über erhöhte PAP-Werte bei Menschen in großen Höhen wurde erstmals 1956 von Canepa in einem der ersten Berichte über eine Rechtsherzkatheterisierung bei Peruanern aus Morochoca (4.540 m) berichtet. Bei 7 Hochlandbewohnern betrugen die Werte 25 (Bereich 18–29) mmHg und bei zwei Patienten mit chronischer Bergkrankheit 34 bzw. 35 mmHg. Diese Befunde wurden jedoch zunächst auf Polyzythämie, abnorme Ventilation und erhöhte Herzleistung zurückgeführt ( 44 ). Erst die Arbeiten unserer peruanischen Landsleute Dante Peñaloza und Javier Arias-Stella in den 1960er Jahren zeigten, dass PH bei Menschen in großen Höhen mit einer Umgestaltung der Lungengefäße einherging ( 45 – 47 ). Frühere Arbeiten von Peñaloza bestätigten erhöhten mPAP (23 ± 5,1 mmHg) in Zusammenhang mit RVH bei Peruanern in großen Höhen ( 48 , 49 ) und stellten interessanterweise auch PH bei Neugeborenen sowohl auf Meereshöhe als auch in großen Höhen fest, mit einer raschen Rückbildung auf Meereshöhe, die bei peruanischen Säuglingen nicht beobachtet wurde ( 50 ). Wichtig ist, dass die Autoren keinen Unterschied bei PAWP und CO zwischen Bewohnern auf Meereshöhe und in großen Höhen feststellten, wobei der PVR bei Bewohnern großer Höhen um 4,15 ± 2,66 WU erhöht war ( 46 , 49 ). Die Gabe von Sauerstoff an peruanische Erwachsene führte zu geringfügigen mPAP-Senkungen von 15-20 % ( 45 , 47 ), was früheren Ergebnissen bei der Brisket-Krankheit entspricht ( 40 ) und darauf hindeutet, dass die pulmonalvaskuläre Umgestaltung hauptsächlich für PH bei chronischer Hypoxie verantwortlich ist. Diese Hypothese wurde durch Jensen und Alexander weiter untermauert, die später eine lineare Beziehung zwischen medialer Hypertrophie der Pulmonalarterien und PAP bei Rindern nachwiesen ( 51 ). Obwohl eine sofortige Besserung durch Sauerstoff nicht möglich war, stellte Peñaloza insbesondere bei Höhenpopulationen nach 2 Jahren auf Meereshöhe eine Normalisierung von mPAP (12 ± 1,9 mmHg) und PVR (1,81 ± 0,44 WU) fest. Dies zeigte, dass Veränderungen infolge chronischer Hypoxie nicht dauerhaft sind ( 52 ). Ergänzend zu diesem Befund erholten sich die von Anand et al. untersuchten indischen Soldaten, die während ihres Höhenaufenthaltes Anzeichen einer Rechtsherzinsuffizienz entwickelt hatten, 12–16 Wochen nach dem Abstieg aus der großen Höhe vollständig. Dabei kam es zu einer Umkehrung der Kardiomegalie und einer Normalisierung des mPAP (16,3 ± 2,9 mmHg) und des pulmonal-vaskulären Widerstandes (PVR) (1,34 ± 0,48 WU) ( 43 ).Während die obigen Studien an gesunden Personen nahelegen, dass erhöhter pulmonalarterieller Druck in Höhenlagen überall anzutreffen ist, bleibt unklar, ob das Ausmaß der Erhöhung bei gesunden Menschen in Höhenlagen den Wert erreicht, der eine präkapilläre PH definiert. Eine aktuelle Metaanalyse von Soria et al. ergab einen durchschnittlichen systolischen PAP von 25,3 mmHg bei Bevölkerungen in großen Höhen mit einer größeren Verbreitung als unter Flachlandbewohnern, was selbst nach den neuen WHO-Kriterien auf eine geringe Prävalenz von PH hindeutet ( 8 , 10 ). Außerdem wird über PVR selten berichtet, und eine bemerkenswerte Beschränkung der berichteten PVRs bei historischen Katheterisierungsstudien in Höhenlagen ist die fehlende Korrektur für den Hämatokrit. Der Widerstand gegen den Blutfluss hängt von der Viskosität sowie den Gefäßdimensionen ab [überprüft von Vanderpool und Naeije ( 53 )], wobei Gleichungen die Beziehung beschreiben, die aus isolierten perfundierten Lungenexperimenten mit Veränderungen des Hämatokrits abgeleitet wurden ( 54 ). Die Angabe des Hämatokritwertes ist daher für die Ermittlung des wahren PVR wichtig ( 53 , 55 ) und kann zu falschen Annahmen über das Ausmaß der vaskulären Umgestaltung bei gesunden Personen nach hypoxischer Exposition führen.Ähnlich wie bei Patienten mit Lungenerkrankungen gibt es jedoch auch bei Höhenbewohnern eine Untergruppe, die eine schwerere PH entwickelt. Im Jahr 2005 wurde eine Konsensdefinition für Höhenkrankheit (HAPH) veröffentlicht, die Personen in Höhenlagen mit übertriebener Erhöhung des PAP sowie Anzeichen von RVH und Rechtsherzinsuffizienz umfasst ( 56 ). HAPH wurde definiert als ein mittlerer PAP von >30 mmHg (oder systolischer PAP > 50 mmHg) ohne übermäßige Erythrozytose (Hämoglobinkonzentration > 19 g/dl für Frauen, > 21 g/dl für Männer). Diese Definition ermöglichte die Unterscheidung zwischen HAPH und der chronischen Bergkrankheit (CMS), bei der eine übermäßige Erythrozytose vorliegt ( 57 , 58 ). Obwohl die oben genannten epidemiologischen Studien darauf hinweisen, dass HAPH gemäß der obigen Definition unter Menschen in großen Höhen selten ist ( 10 ), kann die Untersuchung dieser Personen wichtige Erkenntnisse über molekulare Mechanismen liefern, die vasokonstriktive und Umbauprozesse sowohl bei hypoxischer PH als auch möglicherweise bei anderen Formen von PAH steuern. Man könnte jedoch argumentieren, dass eine Überarbeitung der aktuellen Definition von HAPH, um den Hämatokrit-korrigierten PVR einzubeziehen, diese Forschung erleichtern würde.Artenspezifische Unterschiede in großen HöhenAufgrund dieser Ergebnisse bei Menschen und Rindern begann Donald Heath sich für die Variabilität der Lungengefäße bei Populationen in großen Höhen zwischen Arten zu interessieren. Heath reiste 1965 zusammen mit Peter Harris zum Cerro de Pasco in Peru (4.330 m). Dies war die erste von vielen Höhenexpeditionen zur PH-Erforschung. Einer der Autoren dieses Artikels gibt in Kasten 1 einen beschreibenden Überblick über diese Arbeit . 1974 veröffentlichte Heath seine Forschung an Lamas ( Lama glama ), die einen Mangel an Pulmonalarteriolenmuskularisierung bzw. RVH in großen Höhen zeigte, was im Widerspruch zu früheren Befunden bei Menschen und Rindern ( Bos taurus ) stand ( 59 ). Ein ähnlich dünnwandiges Lungengefäßsystem wurde auch beim Himalaya-Yak ( Bos grunniens ) festgestellt ( 60 ), was darauf hindeutet, dass die natürliche Selektion beim Verlust der dickwandigen, reaktiven Lungenarterien, die typischerweise für die Gattung Bos charakteristisch sind, eine Rolle gespielt hat. Kasten 1. Anpassung an chronische Hypoxie in den Anden.Die Unterscheidung zwischen den verschiedenen biologischen Klassen von Menschen und Säugetieren in großen Höhen lässt sich am besten durch einen gedanklichen Spaziergang durch die Straßen und die umliegende Landschaft einer beliebigen Kleinstadt in den Hochanden veranschaulichen. Die durchgeführten Studien zeigten, dass es in großen Höhen keinen einzelnen stereotypen Menschen oder Säugetiere gibt .Cerro de Pasco ist eine Bergbaugemeinde mit 70.000 Einwohnern und liegt auf einer Höhe von 4.330 m in den zentralen Anden Perus. Auf den Straßen tummeln sich viele Tieflandbewohner, die in wenigen Stunden von Lima an der Küste in große Höhen gelangt sind. Etwa 50 % leiden an einer leichten, akuten Höhenkrankheit, die hauptsächlich durch Kopfschmerzen, Schlaflosigkeit, Appetitlosigkeit, Übelkeit und Schwindel gekennzeichnet ist. Diese Symptome sind die Folge einer hypobaren Hypoxie und können als physiologische Komponenten der frühen Akklimatisierung angesehen werden .Im Gegensatz dazu sind die meisten Menschen einheimische Quechua-Indianer, die in den Hochanden geboren und aufgewachsen sind. Diese Nachkommen des Inka-Volkes haben sehr charakteristische körperliche Merkmale wie Hautfarbe, stark polyzythämische und geschwollene Bindehaut und Lippen. Viele haben einen großen Brustkorb, der im Vergleich zu ihrem kleinen, gedrungenen Körperbau hervorsteht und in keinem Verhältnis steht. Diese einheimischen Hochlandbewohner führen ein normales, geschäftiges Leben in großer Höhe. Sie spielen in Höhen, die höher sind als der Gipfel des Matterhorns in den Schweizer Alpen, spannende Fußballspiele .Auf den Weiden rund um den Cerro de Pasco leben einheimische Bergtiere wie Lamas, Alpakas, Vikunjas und Guanakos. Diese Tiere leben seit vielen tausend Jahren auf dem Andenhochland. Die Vitalität und Aktivität dieser Tiere in einer Atmosphäre, die von schwerer hypobarer Hypoxie geprägt ist, ist einfach beeindruckend . Eine interessante biologische Fragestellung ergibt sich, wenn sich Arten innerhalb der gleichen Gattung kreuzen; ein Beispiel dafür ist die Kreuzung von Rindern, aus der Arten wie Dzo (Kuh x Yak) und Stol (Dzo x Stier) hervorgegangen sind ( 61 ). Im Jahr 1986 haben Arbeiten der Forschergruppe um Peter Harris ergeben, dass der Schutz vor PH mit dem Grad der Yak-Abstammung korreliert; während Dzos und Yaks nur eine minimale PH zeigten, hatte die Hälfte der Stols deutlich erhöhte PAP-Werte, die denen von Rindern ähnelten ( 62 ), was auf ein gewisses Maß an Vererbung hindeutet. Diese Beobachtungen stützen die Theorie, dass Tiere, die in großen Höhen heimisch sind, sich genetisch an ihre hypoxische Umgebung angepasst haben, im Gegensatz zu einer Akklimatisierung, wie sie bei anderen Arten zu beobachten ist.Molekulare Mechanismen der PH bei akuter und chronischer hypoxischer ExpositionWährend die obigen Belege die Verbindungen zwischen hypoxischer Exposition und pulmonaler Hypertonie klar veranschaulichen, sind die zugrundeliegenden genetischen, molekularen und zellulären Mechanismen, die diese Phänotypen regulieren, nach wie vor unklar und zum Teil umstritten. Dennoch haben die grundlagenwissenschaftlichen Arbeiten der letzten 25 Jahre unser Verständnis der gemeinsamen Signalwege erweitert, die sowohl die Höhenanpassung als auch die durch Hypoxie induzierte PH steuern. Die pulmonale Vasokonstriktion bei akuter Hypoxie, die anderswo ausführlich besprochen wurde ( 63 – 65 ), umfasst mindestens zwei Phasen mit unterschiedlichen Mechanismen. Zunächst vermitteln Veränderungen des Redoxstatus in den Mitochondrien der glatten Muskelzellen Änderungen des Kalium- und spannungsgesteuerten Kalziumkanalflusses und fördern so die Kontraktion ( 63 ). Anschließend wird die Vasokonstriktion durch Mechanismen aufrechterhalten, zu denen eine verringerte Bioverfügbarkeit von NO ( 66 ), die Freisetzung endothelialer Vasokonstriktoren ( 67 ) und eine erhöhte Kalziumsensitivität der Myofilamente ( 68 ) gehören. Der Schwerpunkt dieses Artikels liegt auf der Rolle der Hypoxie-induzierbaren Faktoren (HIFs) bei der Gefäßumgestaltung aufgrund chronischer hypoxischer Exposition.Hypoxie-induzierbare Faktoren (HIFs) und pulmonale vaskuläre UmgestaltungHIFs sind eine Familie heterodimerer Transkriptionsfaktoren, die 1995 entdeckt wurden ( 69 ), deren α-Untereinheiten bei Hypoxie durch die Hemmung der sauerstoffabhängigen Enzymaktivität der Prolylhydroxylase (PHD) stabilisiert werden ( 70 ); unter normoxischen Bedingungen führt die Hydroxylierung von HIF-α durch PHDs zur Ubiquitinierung durch den VHL-Komplex, was zum anschließenden proteasomalen Abbau führt ( Abbildung 1 ) ( 71 ). Während HIF-1α im gesamten Körpergewebe ubiquitär exprimiert wird ( 72 ), ist die Expression von HIF-2α gewebespezifisch mit einer Tendenz zum Endothel ( 73 , 74 ). Bei Hypoxie induziert die Stabilisierung der HIF-α-Untereinheiten die Transkription von Zielen mit einer breiten Palette von Funktionen. Abbildung 1
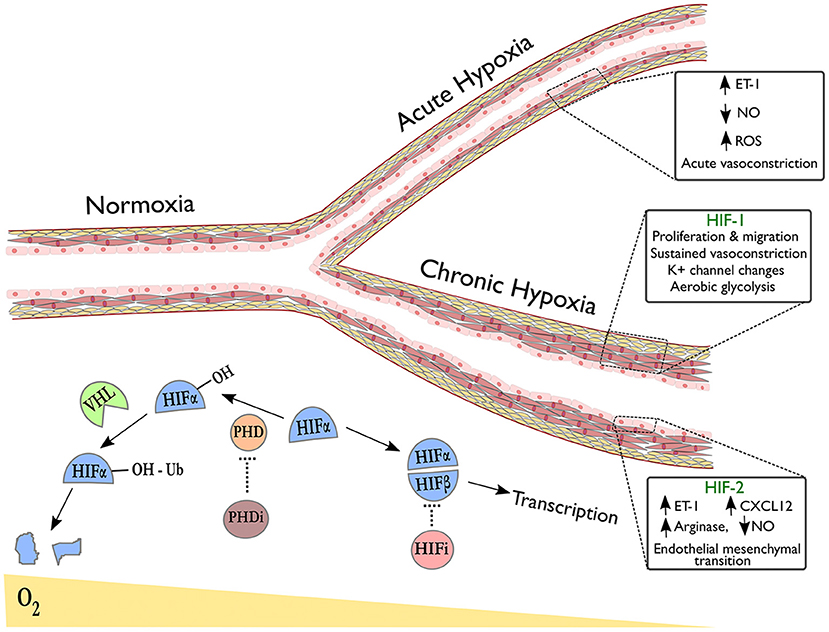 Abbildung 1. Pulmonalvaskuläre Reaktionen auf Hypoxie mit Schwerpunkt auf der Rolle von HIF-Isoformen bei der Umgestaltung. Der rechte obere Ast dieses Gefäßes zeigt eine Vasokonstriktion bei akuter Hypoxie, die aufgrund von Veränderungen der Redox- und NO-Signalgebung und der Freisetzung vasoaktiver Mediatoren auftritt. Der untere Ast weist auf eine Umgestaltung im Kontext anhaltender hypoxischer Exposition hin und illustriert HIF-abhängige Prozesse, die durch gewebespezifische Deletion von HIF-Isoformen in Endothelzellen (HIF-2α) oder glatten Muskelzellen (HIF-1α) sichtbar werden. Unter dem Gefäß zeigt eine schematische Darstellung den Abbau hydroxylierter HIF-α-Untereinheiten bei Normoxie über den Von-Hippel-Lindau-Weg (VHL). Bei Hypoxie oder nach einer Behandlung mit Prolylhydroxylase-Hemmern (PHDi) kommt es zur Stabilisierung und Dimerisierung von HIF-α mit HIF-β, was zur Transkription von Zielgenen führt. HIF-Inhibitoren (HIFi) mit spezifischer Aktivität gegen HIF-2α befinden sich in der klinischen Entwicklung. Es ist vielleicht nicht überraschend, dass bei einheimischen Höhenbewohnern genetische Variationen des HIF-Signalwegs festgestellt wurden. Insbesondere haben genomweite Assoziationsstudien in der tibetischen Bevölkerung Einzelnukleotid-Polymorphismen (SNPs) in EPAS1 (kodiert HIF-2α) und ELGN1 (kodiert PHD2) identifiziert, die bei Tieflandbewohnern nicht angereichert waren (
75
–
77
). EPAS1- Varianten wurden mit niedrigerem PAP in Zusammenhang gebracht (
78
), und eine häufige ELGN1- Mutation wurde mit einer verringerten Proliferation erythroider Vorläufer als Reaktion auf EPO in Verbindung gebracht, wodurch die durch Hypoxie induzierte Erythrozytose gedämpft wurde (
79
). Diese Erkenntnisse belegen, dass über 25.000 Jahre in Höhenlagen ein Selektionsdruck für spezifische Polymorphismen des HIF-Signalwegs bestand, der der tibetischen Bevölkerung bei der Anpassung geholfen hat. Interessanterweise sind derartige Unterschiede bei den Andenbewohnern nicht zu beobachten, einer Bevölkerung, die seit 15.000 Jahren in Höhenlagen lebt und anfälliger für PH (
80
,
81
) und Erythrozytose (
82
) ist.Der Hinweis darauf, dass Polymorphismen des HIF-Signalwegs Umbauprozesse beeinflussen, wird jedoch durch die Beobachtung geschwächt, dass eine Korrektur der Erythrozytose den mPAP bei der Andenbevölkerung auf Werte senkt, die denen der Tibeter nahe kommen (
57
). Somit spricht die Korrektur der Erythrozytose gegen eine Anfälligkeit der Andenbevölkerung für HIF-vermittelte Umbauprozesse. Im Lichte der neuen PH-Definition (
8
) bleibt der korrigierte mPAP in den Anden jedoch im Ruhezustand konstant über 20 mmHg, und der Anstieg des mPAP mit der Herzleistung ist steiler als bei Tieflandbewohnern (
57
).Darüber hinaus deuten Erkenntnisse aus Mausmodellen stark darauf hin, dass der HIF-Signalweg an der durch Hypoxie induzierten Gefäßumgestaltung beteiligt ist. Bald nach der Entdeckung des Signalwegs zeigten frühe Arbeiten an Hif1a- und Hif2a- Heterozygoten eine deutliche Verringerung der PH und der Gefäßumgestaltung nach chronischer Exposition gegenüber 10 % Sauerstoff (
83
,
84
). Umgekehrt können HIF2A ( EPAS1 )-Gain-of-Function-Mutationen zu PH prädisponieren; eine Hif2a- Variante bei Höhenrindern erhöht die Anfälligkeit für Brisket Disease (
85
), während eine HIF2A- Mutation, die familiäre Erythrozytose verursacht, auch mit erhöhtem systolischen PAP beim Menschen verbunden ist (
86
). Eine Maus mit derselben G536W-Gain-of-Function-Mutation im Hif2a- Gen entwickelte ebenfalls Erythrozytose und PH, was einen weiteren Beweis für die artenübergreifende Erhaltung dieser HIF-2α-Rolle liefert (
87
). Darüber hinaus weisen sowohl Tiermodelle als auch Patienten mit Chuvash-Polyzythämie (CP), die durch eine VHL-Mutation charakterisiert ist, eine ausgeprägte Erythrozytose und erhöhte PAP auf, die bei Mäusen durch Deletion von Hif2a , nicht jedoch von Hif1a, behoben werden konnten (
88
–
90
). Während die Beschreibungen erhöhter PAP bei Menschen mit CP keine Daten von Rechtsherzkathetern oder hämatokritkorrigierten PVR enthielten, ist anzumerken, dass Erhöhungen des systolischen PAP und der Gefäßmuskularisierung bei jungen Mäusen mit homozygoten VHL-Mutationen dem Beginn der Polyzythämie vorausgingen (
90
).Gewebespezifische Manipulation der HIF-Expression offenbart unterschiedliche Rollen von HIF-Isoformen bei der pulmonalen GefäßumgestaltungMittlerweile deuten sich Erkenntnisse darüber an, wie die HIF-Isoformen die Funktion pulmonaler Gefäßzellen regulieren. Fortschritte wurden durch die Verwendung muriner gewebespezifischer Deletionsmodelle erzielt, siehe
Abbildung 1.
So wurde HIF-1α sowohl mit der Vasokonstriktion als auch mit der Gefäßzellproliferation in Verbindung gebracht, den beiden Hauptkomponenten der hypoxischen pulmonalen Hypertonie. Ball et al. zeigten, dass die induzierbare Deletion von Hif1a in PASMCs den rechtsventrikulären systolischen Druck, die Dicke der Arterienwände und die Gefäßmuskularisierung bei chronischer Hypoxie verringerte (
91 ), während Shiekh et al. eine Abhängigkeit von
Hif1a in PASMC-Vorläuferzellen für die distale Migration und Expansion berichteten (
92
). Zu den vorgeschlagenen Mechanismen, die diese Ergebnisse erklären könnten, gehören eine erhöhte intrazelluläre Kalziumproduktion durch Hif1a- abhängige Herunterregulierung von K + -Kanälen (
93
) und eine Hochregulierung von Transient-Receptor-Potential-Calciumkanälen (
94
), die bekanntermaßen die Vasokonstriktion sowie die Proliferation und Migration von PASMCs verstärken (
95
). HIF-1α vermittelt außerdem proproliferative Stoffwechselveränderungen in PASMCs und Fibroblasten, die zu einer hypoxieinduzierten Umgestaltung beitragen könnten. Eine allgemein anerkannte Folge der HIF-Signalgebung bei Krebszellen ist die Bevorzugung der Glykolyse gegenüber der oxidativen Phosphorylierung unter aeroben Bedingungen, der als „Warburg-Effekt“ bezeichnet wird und glykolytische Enzyme dazu veranlasst, die ATP-Produktion zu steigern und das Tumorwachstum zu fördern (
96
,
97
). Interessanterweise führt die HIF-Signalisierung zwischen pulmonalarteriellen glatten Muskelzellen (PASMCs) und Fibroblasten zu einer ähnlichen Verschiebung hin zur aeroben Glykolyse, wie sie in Tumoren zu beobachten ist (
98
–
100
), wobei in den Lungen von Ratten mit hypoxieinduzierter PH und bei PAH-Patienten eine erhöhte Glukoseaufnahme beobachtet wurde (
101
,
102
). Diese metabolische Umprogrammierung pulmonaler Gefäßzellen hat sich ex vivo als stabil erwiesen , mit Hinweisen auf eine zugrunde liegende epigenetische Regulation (
103
,
104
). Das gezielte Ansprechen dieser Mechanismen könnte die hypoxieinduzierte PASMC-Proliferation im pulmonalen Gefäßsystem begrenzen.In Übereinstimmung mit seinem überwiegend endothelialen Expressionsprofil deuten zunehmende Hinweise darauf hin, dass die HIF-2α-Expression in Endothelzellen (EC) über verschiedene biologische Mechanismen für die pulmonale vaskuläre Umgestaltung wichtig ist, siehe
Abbildung 1.
Zwei Studien haben eine schwere und spontane PH nach Phd2- Knockdown in murinen ECs gezeigt (
105
,
106
). Doppelte Knockouts von Phd2 und beiden HIF-Isoformen zeigten, dass dies ein Hif2a -vermittelter Phänotyp war (
105
,
106
), aber die Studien zeigten unterschiedliche Mechanismen auf: Einer assoziiert die HIF-2α-Expression mit einer verringerten Expression des potenten Vasokonstriktors Endothelin-1 (ET-1) (
106
) und der andere zeigte eine Beteiligung von HIF-2α an der CXCL12-vermittelten PASMC-Proliferation (
105
). Eine reduzierte EC- Phd2- Expression wurde auch bei okklusiven Gefäßen bei IPAH beobachtet (
105
), was auf eine Relevanz für die menschliche Pathologie hindeutet. Bemerkenswerterweise entwickelten diese Phd2- Knockout-Mäuse vor der Entwicklung von PH keine Polyzythämie.Der NO-Syntheseweg wurde außerdem mit der durch HIF-2α vermittelten Umgestaltung von ECs in Verbindung gebracht. Cowburn et al. beobachteten einen ähnlichen Schutz vor Hypoxie-induzierter PH wie Hif2a- Knockdown nach EC-spezifischer Deletion von Arginase-1 ( Arg1 ), einem nachgeschalteten HIF-2α-Ziel und negativen Regulator der NO-Synthese (
107
). Darüber hinaus zeigten ECs von PH-Patienten in vitro eine beeinträchtigte NO-Produktion , die durch Arginasehemmung wiederhergestellt wurde (
107
). Ein weiterer Mechanismus, durch den HIF-2α zur Umgestaltung beitragen könnte, ist die Regulierung des endothelialen-mesenchymalen Übergangs (EMT), ein Prozess, der an der pathogenen Umgestaltung beteiligt ist (
108
). Tang et al. zeigten, dass Marker der EMT in endothelialen Zellen durch HIF-2α reguliert werden und dass die endothelspezifische Deletion von Hif2a die Mäuse vor Hypoxie-induzierter PH schützte, die Deletion von Hif2a in vaskulären glatten Muskelzellen jedoch nicht (
109
).In der Literatur gibt es weiterhin erhebliche Kontroversen bezüglich der HIF-vermittelten Regulierung der Umgestaltung. Während Ball et al. durch eine Tamoxifen-induzierbare bedingte Deletion eine Rolle von PASMC- Hif1a bei der chronischen hypoxischen Umgestaltung nachwiesen (
91
), berichteten Kim et al. über einen verbesserten pulmonalarteriellen Tonus in Abwesenheit einer arteriellen Muskularisierung nach konstitutiver PASMC-spezifischer Hif1a- Deletion (
110
). Ebenso stellten drei Autoren fest , dass die konstitutive EC- Hif1a- Deletion keinen Schutz vor PH bietet (
105-107
), während Shiekh et al. die PH nach Tamoxifen-induzierbarer bedingter EC - Hif1a- Deletion lindern konnten , wodurch
die
Expansion und distale Migration von PASMC verhindert wurde (
92
). Neben Belegen für die Bedeutung der embryonalen HIF-Signalgebung für die Entwicklung der Gefäße (
111
) deuten diese beobachteten Unterschiede auf eine Rolle der frühen HIF-1α-Signalgebung bei der Entwicklung der Lungengefäße hin.Aufgrund der entscheidenden Rolle der HIF-Isoformen bei Hypoxie-induzierter PH hat sich die Hemmung dieser Moleküle als wichtige Strategie zur gezielten Eindämmung von Umbauprozessen herausgestellt. Obwohl sich die Entwicklung von Inhibitoren des HIF-Signalwegs aufgrund mangelnder Wirksamkeit, HIF-Isoform-Spezifität und Nebenwirkungen bisher als schwierig erwiesen hat (
112
,
113
), hat ein spezifischer niedermolekularer HIF-2α-Inhibitor, der zur Behandlung von Nierenkrebs entwickelt wurde, in einer kürzlich durchgeführten Phase-I-Studie ein günstiges Sicherheitsprofil gezeigt (
114
). Erfreulicherweise konnte kürzlich gezeigt werden, dass der Einsatz eines anderen HIF-2α-Inhibitors, C76, den Umbau in drei murinen PH-Modellen abschwächt, ohne dass eine nennenswerte Hemmung von HIF-1α beobachtet wurde (
115
).Aufgrund der pleiotropen Natur der HIF-Signalgebung wurden mehrere andere Wege als mögliche therapeutische Ziele identifiziert. Mithilfe einer kongenen Kopplungsanalyse entdeckten Zhao et al. eine Abhängigkeit des hypoxieinduzierten Umbaus von intrazellulärem Zink. Die homozygote Deletion des Zinktransporters ZIP12, ein Ziel sowohl von HIF-1α als auch von HIF-2α, schwächt PAP, RVH und den vaskulären Umbau bei chronischer Hypoxie ab (
116
). Darüber hinaus wurde auch eine Induktion von ZIP12 im Lungengewebe bei Patienten mit Brisket-Krankheit und menschlichen Hochlandpopulationen beobachtet (
116
). Wie intrazelluläres Zink den hypoxieinduzierten Umbau beeinflusst, ist noch unklar; die gezielte Beeinflussung der intrazellulären Zinkhomöostase könnte jedoch eine weitere therapeutische Strategie darstellen.SchlussfolgerungenIn diesem Artikel wurden historische Beobachtungen zum Zusammenhang zwischen Hypoxie und pulmonaler Hypertonie besprochen und neuere Erkenntnisse über die molekularen Mechanismen der hypoxieinduzierten Umgestaltung beschrieben. Insbesondere die Hinweise auf eine Verbindung zwischen der HIF-Expression und Prozessen der Gefäßumgestaltung lassen eine HIF-Hemmung, insbesondere eine HIF-2α-Hemmung, als Strategie zur Linderung der Gefäßpathologie bei chronischer Hypoxie in Erwägung ziehen. Der jüngste Erfolg eines HIF-2α-Hemmers in mehreren Mausmodellen spricht für eine solche Strategie und könnte in Zukunft dazu führen, dass klinische Studien mit PH-Patienten in Betracht gezogen werden. Die mechanistischen Zusammenhänge zwischen der Aktivierung des HIF-Signalwegs und PH, insbesondere die Entwicklung einer spontanen PH nach Deletion von Phd2 , sollten jedoch auch zu Vorsicht bei der Verwendung von PHD-Hemmern mahnen, die sich derzeit in klinischen Phase-II/III-Studien zur Behandlung von renaler Anämie befinden (
117
).Genetische Erkenntnisse, die durch die Untersuchung von Hochgebirgspopulationen gewonnen wurden, legen nahe, dass ein besseres Verständnis der Faktoren, die der Höhenanpassung zugrunde liegen, weitere Mechanismen aufzeigen könnte, die an der Regulierung der Gefäßumgestaltung beteiligt sind. Obwohl es Ähnlichkeiten zwischen den pathologischen Merkmalen der hypoxiebedingten PH und anderen Formen der Krankheit gibt, bleibt das Ausmaß der Überschneidung der pathologischen Mechanismen, selbst bei Patienten mit chronischer Atemwegserkrankung, unklar. Darüber hinaus wirft der bemerkenswerte Mangel an Korrekturen für den Hämatokrit in früheren Arbeiten, die über PVR in der Höhe berichten, Zweifel an einigen der offensichtlichen Unterschiede zwischen Höhenpopulationen auf, die tatsächlich auf Unterschiede im Hämatokrit zurückzuführen sein könnten. Dennoch bietet eine Umkehrung der PH bei der Rückkehr auf Meereshöhe die verlockende Möglichkeit, dass die Ausnutzung endogener Mechanismen Wirkstoffe liefern könnte, die die Gefäßumgestaltung bei hypoxischen Erkrankungen umkehren. Daher besteht immer noch Hoffnung, dass die Erkenntnisse aus der Untersuchung hypoxiebedingter Erkrankungen die Suche nach Wirkstoffen beeinflussen könnten, die auf die umfassende Gefäßumgestaltung bei anderen Formen der PH abzielen.AutorenbeiträgeJY hat das Manuskript geschrieben. DW und AART haben zusätzlichen Text verfasst und das Manuskript bearbeitet. Alle Autoren haben die endgültige Version genehmigt.
Abbildung 1. Pulmonalvaskuläre Reaktionen auf Hypoxie mit Schwerpunkt auf der Rolle von HIF-Isoformen bei der Umgestaltung. Der rechte obere Ast dieses Gefäßes zeigt eine Vasokonstriktion bei akuter Hypoxie, die aufgrund von Veränderungen der Redox- und NO-Signalgebung und der Freisetzung vasoaktiver Mediatoren auftritt. Der untere Ast weist auf eine Umgestaltung im Kontext anhaltender hypoxischer Exposition hin und illustriert HIF-abhängige Prozesse, die durch gewebespezifische Deletion von HIF-Isoformen in Endothelzellen (HIF-2α) oder glatten Muskelzellen (HIF-1α) sichtbar werden. Unter dem Gefäß zeigt eine schematische Darstellung den Abbau hydroxylierter HIF-α-Untereinheiten bei Normoxie über den Von-Hippel-Lindau-Weg (VHL). Bei Hypoxie oder nach einer Behandlung mit Prolylhydroxylase-Hemmern (PHDi) kommt es zur Stabilisierung und Dimerisierung von HIF-α mit HIF-β, was zur Transkription von Zielgenen führt. HIF-Inhibitoren (HIFi) mit spezifischer Aktivität gegen HIF-2α befinden sich in der klinischen Entwicklung. Es ist vielleicht nicht überraschend, dass bei einheimischen Höhenbewohnern genetische Variationen des HIF-Signalwegs festgestellt wurden. Insbesondere haben genomweite Assoziationsstudien in der tibetischen Bevölkerung Einzelnukleotid-Polymorphismen (SNPs) in EPAS1 (kodiert HIF-2α) und ELGN1 (kodiert PHD2) identifiziert, die bei Tieflandbewohnern nicht angereichert waren (
75
–
77
). EPAS1- Varianten wurden mit niedrigerem PAP in Zusammenhang gebracht (
78
), und eine häufige ELGN1- Mutation wurde mit einer verringerten Proliferation erythroider Vorläufer als Reaktion auf EPO in Verbindung gebracht, wodurch die durch Hypoxie induzierte Erythrozytose gedämpft wurde (
79
). Diese Erkenntnisse belegen, dass über 25.000 Jahre in Höhenlagen ein Selektionsdruck für spezifische Polymorphismen des HIF-Signalwegs bestand, der der tibetischen Bevölkerung bei der Anpassung geholfen hat. Interessanterweise sind derartige Unterschiede bei den Andenbewohnern nicht zu beobachten, einer Bevölkerung, die seit 15.000 Jahren in Höhenlagen lebt und anfälliger für PH (
80
,
81
) und Erythrozytose (
82
) ist.Der Hinweis darauf, dass Polymorphismen des HIF-Signalwegs Umbauprozesse beeinflussen, wird jedoch durch die Beobachtung geschwächt, dass eine Korrektur der Erythrozytose den mPAP bei der Andenbevölkerung auf Werte senkt, die denen der Tibeter nahe kommen (
57
). Somit spricht die Korrektur der Erythrozytose gegen eine Anfälligkeit der Andenbevölkerung für HIF-vermittelte Umbauprozesse. Im Lichte der neuen PH-Definition (
8
) bleibt der korrigierte mPAP in den Anden jedoch im Ruhezustand konstant über 20 mmHg, und der Anstieg des mPAP mit der Herzleistung ist steiler als bei Tieflandbewohnern (
57
).Darüber hinaus deuten Erkenntnisse aus Mausmodellen stark darauf hin, dass der HIF-Signalweg an der durch Hypoxie induzierten Gefäßumgestaltung beteiligt ist. Bald nach der Entdeckung des Signalwegs zeigten frühe Arbeiten an Hif1a- und Hif2a- Heterozygoten eine deutliche Verringerung der PH und der Gefäßumgestaltung nach chronischer Exposition gegenüber 10 % Sauerstoff (
83
,
84
). Umgekehrt können HIF2A ( EPAS1 )-Gain-of-Function-Mutationen zu PH prädisponieren; eine Hif2a- Variante bei Höhenrindern erhöht die Anfälligkeit für Brisket Disease (
85
), während eine HIF2A- Mutation, die familiäre Erythrozytose verursacht, auch mit erhöhtem systolischen PAP beim Menschen verbunden ist (
86
). Eine Maus mit derselben G536W-Gain-of-Function-Mutation im Hif2a- Gen entwickelte ebenfalls Erythrozytose und PH, was einen weiteren Beweis für die artenübergreifende Erhaltung dieser HIF-2α-Rolle liefert (
87
). Darüber hinaus weisen sowohl Tiermodelle als auch Patienten mit Chuvash-Polyzythämie (CP), die durch eine VHL-Mutation charakterisiert ist, eine ausgeprägte Erythrozytose und erhöhte PAP auf, die bei Mäusen durch Deletion von Hif2a , nicht jedoch von Hif1a, behoben werden konnten (
88
–
90
). Während die Beschreibungen erhöhter PAP bei Menschen mit CP keine Daten von Rechtsherzkathetern oder hämatokritkorrigierten PVR enthielten, ist anzumerken, dass Erhöhungen des systolischen PAP und der Gefäßmuskularisierung bei jungen Mäusen mit homozygoten VHL-Mutationen dem Beginn der Polyzythämie vorausgingen (
90
).Gewebespezifische Manipulation der HIF-Expression offenbart unterschiedliche Rollen von HIF-Isoformen bei der pulmonalen GefäßumgestaltungMittlerweile deuten sich Erkenntnisse darüber an, wie die HIF-Isoformen die Funktion pulmonaler Gefäßzellen regulieren. Fortschritte wurden durch die Verwendung muriner gewebespezifischer Deletionsmodelle erzielt, siehe
Abbildung 1.
So wurde HIF-1α sowohl mit der Vasokonstriktion als auch mit der Gefäßzellproliferation in Verbindung gebracht, den beiden Hauptkomponenten der hypoxischen pulmonalen Hypertonie. Ball et al. zeigten, dass die induzierbare Deletion von Hif1a in PASMCs den rechtsventrikulären systolischen Druck, die Dicke der Arterienwände und die Gefäßmuskularisierung bei chronischer Hypoxie verringerte (
91 ), während Shiekh et al. eine Abhängigkeit von
Hif1a in PASMC-Vorläuferzellen für die distale Migration und Expansion berichteten (
92
). Zu den vorgeschlagenen Mechanismen, die diese Ergebnisse erklären könnten, gehören eine erhöhte intrazelluläre Kalziumproduktion durch Hif1a- abhängige Herunterregulierung von K + -Kanälen (
93
) und eine Hochregulierung von Transient-Receptor-Potential-Calciumkanälen (
94
), die bekanntermaßen die Vasokonstriktion sowie die Proliferation und Migration von PASMCs verstärken (
95
). HIF-1α vermittelt außerdem proproliferative Stoffwechselveränderungen in PASMCs und Fibroblasten, die zu einer hypoxieinduzierten Umgestaltung beitragen könnten. Eine allgemein anerkannte Folge der HIF-Signalgebung bei Krebszellen ist die Bevorzugung der Glykolyse gegenüber der oxidativen Phosphorylierung unter aeroben Bedingungen, der als „Warburg-Effekt“ bezeichnet wird und glykolytische Enzyme dazu veranlasst, die ATP-Produktion zu steigern und das Tumorwachstum zu fördern (
96
,
97
). Interessanterweise führt die HIF-Signalisierung zwischen pulmonalarteriellen glatten Muskelzellen (PASMCs) und Fibroblasten zu einer ähnlichen Verschiebung hin zur aeroben Glykolyse, wie sie in Tumoren zu beobachten ist (
98
–
100
), wobei in den Lungen von Ratten mit hypoxieinduzierter PH und bei PAH-Patienten eine erhöhte Glukoseaufnahme beobachtet wurde (
101
,
102
). Diese metabolische Umprogrammierung pulmonaler Gefäßzellen hat sich ex vivo als stabil erwiesen , mit Hinweisen auf eine zugrunde liegende epigenetische Regulation (
103
,
104
). Das gezielte Ansprechen dieser Mechanismen könnte die hypoxieinduzierte PASMC-Proliferation im pulmonalen Gefäßsystem begrenzen.In Übereinstimmung mit seinem überwiegend endothelialen Expressionsprofil deuten zunehmende Hinweise darauf hin, dass die HIF-2α-Expression in Endothelzellen (EC) über verschiedene biologische Mechanismen für die pulmonale vaskuläre Umgestaltung wichtig ist, siehe
Abbildung 1.
Zwei Studien haben eine schwere und spontane PH nach Phd2- Knockdown in murinen ECs gezeigt (
105
,
106
). Doppelte Knockouts von Phd2 und beiden HIF-Isoformen zeigten, dass dies ein Hif2a -vermittelter Phänotyp war (
105
,
106
), aber die Studien zeigten unterschiedliche Mechanismen auf: Einer assoziiert die HIF-2α-Expression mit einer verringerten Expression des potenten Vasokonstriktors Endothelin-1 (ET-1) (
106
) und der andere zeigte eine Beteiligung von HIF-2α an der CXCL12-vermittelten PASMC-Proliferation (
105
). Eine reduzierte EC- Phd2- Expression wurde auch bei okklusiven Gefäßen bei IPAH beobachtet (
105
), was auf eine Relevanz für die menschliche Pathologie hindeutet. Bemerkenswerterweise entwickelten diese Phd2- Knockout-Mäuse vor der Entwicklung von PH keine Polyzythämie.Der NO-Syntheseweg wurde außerdem mit der durch HIF-2α vermittelten Umgestaltung von ECs in Verbindung gebracht. Cowburn et al. beobachteten einen ähnlichen Schutz vor Hypoxie-induzierter PH wie Hif2a- Knockdown nach EC-spezifischer Deletion von Arginase-1 ( Arg1 ), einem nachgeschalteten HIF-2α-Ziel und negativen Regulator der NO-Synthese (
107
). Darüber hinaus zeigten ECs von PH-Patienten in vitro eine beeinträchtigte NO-Produktion , die durch Arginasehemmung wiederhergestellt wurde (
107
). Ein weiterer Mechanismus, durch den HIF-2α zur Umgestaltung beitragen könnte, ist die Regulierung des endothelialen-mesenchymalen Übergangs (EMT), ein Prozess, der an der pathogenen Umgestaltung beteiligt ist (
108
). Tang et al. zeigten, dass Marker der EMT in endothelialen Zellen durch HIF-2α reguliert werden und dass die endothelspezifische Deletion von Hif2a die Mäuse vor Hypoxie-induzierter PH schützte, die Deletion von Hif2a in vaskulären glatten Muskelzellen jedoch nicht (
109
).In der Literatur gibt es weiterhin erhebliche Kontroversen bezüglich der HIF-vermittelten Regulierung der Umgestaltung. Während Ball et al. durch eine Tamoxifen-induzierbare bedingte Deletion eine Rolle von PASMC- Hif1a bei der chronischen hypoxischen Umgestaltung nachwiesen (
91
), berichteten Kim et al. über einen verbesserten pulmonalarteriellen Tonus in Abwesenheit einer arteriellen Muskularisierung nach konstitutiver PASMC-spezifischer Hif1a- Deletion (
110
). Ebenso stellten drei Autoren fest , dass die konstitutive EC- Hif1a- Deletion keinen Schutz vor PH bietet (
105-107
), während Shiekh et al. die PH nach Tamoxifen-induzierbarer bedingter EC - Hif1a- Deletion lindern konnten , wodurch
die
Expansion und distale Migration von PASMC verhindert wurde (
92
). Neben Belegen für die Bedeutung der embryonalen HIF-Signalgebung für die Entwicklung der Gefäße (
111
) deuten diese beobachteten Unterschiede auf eine Rolle der frühen HIF-1α-Signalgebung bei der Entwicklung der Lungengefäße hin.Aufgrund der entscheidenden Rolle der HIF-Isoformen bei Hypoxie-induzierter PH hat sich die Hemmung dieser Moleküle als wichtige Strategie zur gezielten Eindämmung von Umbauprozessen herausgestellt. Obwohl sich die Entwicklung von Inhibitoren des HIF-Signalwegs aufgrund mangelnder Wirksamkeit, HIF-Isoform-Spezifität und Nebenwirkungen bisher als schwierig erwiesen hat (
112
,
113
), hat ein spezifischer niedermolekularer HIF-2α-Inhibitor, der zur Behandlung von Nierenkrebs entwickelt wurde, in einer kürzlich durchgeführten Phase-I-Studie ein günstiges Sicherheitsprofil gezeigt (
114
). Erfreulicherweise konnte kürzlich gezeigt werden, dass der Einsatz eines anderen HIF-2α-Inhibitors, C76, den Umbau in drei murinen PH-Modellen abschwächt, ohne dass eine nennenswerte Hemmung von HIF-1α beobachtet wurde (
115
).Aufgrund der pleiotropen Natur der HIF-Signalgebung wurden mehrere andere Wege als mögliche therapeutische Ziele identifiziert. Mithilfe einer kongenen Kopplungsanalyse entdeckten Zhao et al. eine Abhängigkeit des hypoxieinduzierten Umbaus von intrazellulärem Zink. Die homozygote Deletion des Zinktransporters ZIP12, ein Ziel sowohl von HIF-1α als auch von HIF-2α, schwächt PAP, RVH und den vaskulären Umbau bei chronischer Hypoxie ab (
116
). Darüber hinaus wurde auch eine Induktion von ZIP12 im Lungengewebe bei Patienten mit Brisket-Krankheit und menschlichen Hochlandpopulationen beobachtet (
116
). Wie intrazelluläres Zink den hypoxieinduzierten Umbau beeinflusst, ist noch unklar; die gezielte Beeinflussung der intrazellulären Zinkhomöostase könnte jedoch eine weitere therapeutische Strategie darstellen.SchlussfolgerungenIn diesem Artikel wurden historische Beobachtungen zum Zusammenhang zwischen Hypoxie und pulmonaler Hypertonie besprochen und neuere Erkenntnisse über die molekularen Mechanismen der hypoxieinduzierten Umgestaltung beschrieben. Insbesondere die Hinweise auf eine Verbindung zwischen der HIF-Expression und Prozessen der Gefäßumgestaltung lassen eine HIF-Hemmung, insbesondere eine HIF-2α-Hemmung, als Strategie zur Linderung der Gefäßpathologie bei chronischer Hypoxie in Erwägung ziehen. Der jüngste Erfolg eines HIF-2α-Hemmers in mehreren Mausmodellen spricht für eine solche Strategie und könnte in Zukunft dazu führen, dass klinische Studien mit PH-Patienten in Betracht gezogen werden. Die mechanistischen Zusammenhänge zwischen der Aktivierung des HIF-Signalwegs und PH, insbesondere die Entwicklung einer spontanen PH nach Deletion von Phd2 , sollten jedoch auch zu Vorsicht bei der Verwendung von PHD-Hemmern mahnen, die sich derzeit in klinischen Phase-II/III-Studien zur Behandlung von renaler Anämie befinden (
117
).Genetische Erkenntnisse, die durch die Untersuchung von Hochgebirgspopulationen gewonnen wurden, legen nahe, dass ein besseres Verständnis der Faktoren, die der Höhenanpassung zugrunde liegen, weitere Mechanismen aufzeigen könnte, die an der Regulierung der Gefäßumgestaltung beteiligt sind. Obwohl es Ähnlichkeiten zwischen den pathologischen Merkmalen der hypoxiebedingten PH und anderen Formen der Krankheit gibt, bleibt das Ausmaß der Überschneidung der pathologischen Mechanismen, selbst bei Patienten mit chronischer Atemwegserkrankung, unklar. Darüber hinaus wirft der bemerkenswerte Mangel an Korrekturen für den Hämatokrit in früheren Arbeiten, die über PVR in der Höhe berichten, Zweifel an einigen der offensichtlichen Unterschiede zwischen Höhenpopulationen auf, die tatsächlich auf Unterschiede im Hämatokrit zurückzuführen sein könnten. Dennoch bietet eine Umkehrung der PH bei der Rückkehr auf Meereshöhe die verlockende Möglichkeit, dass die Ausnutzung endogener Mechanismen Wirkstoffe liefern könnte, die die Gefäßumgestaltung bei hypoxischen Erkrankungen umkehren. Daher besteht immer noch Hoffnung, dass die Erkenntnisse aus der Untersuchung hypoxiebedingter Erkrankungen die Suche nach Wirkstoffen beeinflussen könnten, die auf die umfassende Gefäßumgestaltung bei anderen Formen der PH abzielen.AutorenbeiträgeJY hat das Manuskript geschrieben. DW und AART haben zusätzlichen Text verfasst und das Manuskript bearbeitet. Alle Autoren haben die endgültige Version genehmigt.
Dünne Luft, dicke Gefäße: Historische und aktuelle Perspektiven zur hypoxischen pulmonalen HypertonieDer Zusammenhang zwischen pulmonaler Hypertonie (PH) und Hypoxie ist gut belegt. Zwei wichtige mechanistische Prozesse – hypoxische pulmonale Vasokonstriktion und durch Hypoxie induzierte Gefäßumgestaltung – führen zu Veränderungen des pulmonalarteriellen Drucks. Im Gegensatz zu anderen Formen der pulmonalen Hypertonie sind die durch Hypoxie induzierten Gefäßveränderungen reversibel, sowohl bei Menschen, die aus großer Höhe auf Meereshöhe zurückkehren, als auch bei Tiermodellen. Dies wirft die faszinierende Möglichkeit auf, dass die molekularen Treiber dieser hypoxischen Prozesse gezielt eingesetzt werden könnten, um die pulmonale Gefäßumgestaltung in anderen Zusammenhängen zu verändern. In dieser Übersicht skizzieren wir die Geschichte der Forschung zu PH und Hypoxie, bevor wir die jüngsten Fortschritte in unserem Verständnis dieser Beziehung auf molekularer Ebene diskutieren und uns auf die Rolle der sauerstoffempfindlichen Transkriptionsfaktoren, Hypoxie-induzierbaren Faktoren (HIFs), konzentrieren. Neue Verbindungen zwischen HIF und Gefäßumbau unterstreichen den potenziellen Nutzen einer Hemmung dieses Signalwegs bei pulmonaler Hypertonie und weisen auf mögliche Risiken einer Aktivierung dieses Signalwegs durch HIF-stabilisierende Medikamente hin. EinführungPulmonale Hypertonie (PH) ist ein Merkmal mehrerer verschiedener klinischer Phänotypen, die auf unterschiedliche Weise zu einem erhöhten Druck in den Lungengefäßen führen. Trotz einiger Fortschritte in der Behandlung in den letzten Jahren ( 1 ) sind die meisten Formen der PH progressiv und lebensbegrenzend. In der aktuellen Klassifikation der PH-Ätiologie ist Gruppe III (PH aufgrund von Lungenerkrankungen und/oder Hypoxie) nach Herzerkrankungen die zweithäufigste Ursache für erhöhten pulmonalarteriellen Druck ( 2 ). Gruppe III umfasst ein breites Spektrum von Erkrankungen wie chronisch obstruktive Lungenerkrankung (COPD), interstitielle Lungenerkrankung (ILD) und Schlafapnoe ( 3 ). Neben Parenchymveränderungen tragen zwei wichtige pathologische Prozesse zur Entstehung von PH bei dieser Patientengruppe bei: pulmonale Gefäßumbau und Vasokonstriktion, aber die Behandlung mit pulmonalen Vasodilatatoren war bisher enttäuschend. Neue Ansätze in der Behandlung dieser Patienten sind daher dringend erforderlich, um die Ergebnisse zu verbessern, da die 3-Jahres-Überlebensrate bei COPD-Patienten mit einem mittleren Pulmonalarteriendruck von >40 mmHg nach wie vor bei nur 33 % liegt ( 1 , 2 , 4 ). Während die pathologischen Mechanismen je nach Grunderkrankung oder Phänotyp unterschiedlich sein können, kann ein besseres Verständnis der entscheidenden Komponente von Erkrankungen der Gruppe III, der Hypoxie, dazu beitragen, neue Ziele für Therapien zu finden.Ein kausaler Zusammenhang zwischen Hypoxie und PH ist gut belegt; Hypoxie wird häufig verwendet, um sowohl PH in Tiermodellen auszulösen ( 5 ) als auch um abweichende Zellphänotypen in vitro zu induzieren ( 6 ). Diese Ansätze haben unser Verständnis der zugrunde liegenden physiologischen Mechanismen, die die Pathologie vorantreiben, erheblich verbessert. Überzeugende Beweise für die Auswirkungen von Hypoxie auf den Lungengefäßtonus und die Umgestaltung bei Menschen stammen aus Studien, die in großen Höhen durchgeführt wurden, wo die damit verbundene Verringerung des Luftdrucks zu hypobarer Hypoxie führt. Dieser Ansatz ist vorteilhaft für die Bewertung der Auswirkungen von Hypoxie auf das Lungengefäßsystem in relativer Isolation, ohne die komplizierenden Faktoren der Krankheit. In dieser Übersicht skizzieren wir den historischen Kontext der Forschung zu PH und Hypoxie und diskutieren neue molekulare Mechanismen für diesen Zusammenhang. Wir konzentrieren uns auf die Rolle der sauerstoffempfindlichen Transkriptionsfaktoren, der Hypoxie-induzierbaren Faktoren (HIFs) und der Verbindungen zwischen HIFs und der Gefäßumgestaltung.Wichtige DefinitionenBevor wir mit dieser Übersichtsarbeit beginnen, ist es wichtig, die in diesem und anderen Manuskripten verwendeten Definitionen von PH zu beachten. Der Begriff PH wird verwendet, um eine Erhöhung des mittleren pulmonalarteriellen Drucks (mPAP) jeglicher Ursache zu beschreiben. PH wurde erstmals auf dem 1. Weltsymposium für pulmonale Hypertonie (WSPH) im Jahr 1973 als ein mPAP über 25 mmHg klassifiziert ( 7 ). Bemerkenswert ist, dass beim kürzlich stattgefundenen 6. WSPH die obere Normgrenze für mPAP auf 20 mmHg festgelegt wurde. Dies wurde teilweise mit neueren Hinweisen auf eine geringere Überlebensrate bei Patienten mit mPAPs von 21 bis 24 mmHg und teilweise mit der Verteilung der Werte in Daten gesunder Bevölkerung begründet ( 8 ). Für die Diagnose einer präkapillären pulmonalen Hypertonie jeglicher Ursache ist auch ein erhöhter pulmonaler Gefäßwiderstand (PVR > 3 WU) erforderlich ( 8 ). Präkapilläre Hämodynamik, die der obigen Definition entspricht, ist bei Patienten mit Lungenerkrankungen nicht ungewöhnlich ( 4 , 9 ). Die Prävalenz eines erhöhten PVR bei gesunden Personen mit Hypoxie ohne Lungenerkrankung, z. B. bei Menschen in Höhenlagen und bei Personen mit Schlafapnoe, ist jedoch weniger klar und wird später erörtert ( 10 ). Um Verwirrungen zu vermeiden, haben wir, soweit möglich, Werte (±SD) aus der zitierten Literatur einbezogen, die den aufgezeichneten pulmonalarteriellen Druck und/oder PVR angeben.Pulmonale Hypertonie: Eine GeschichtePathologische Veränderungen der Pulmonalarterien zusammen mit einer rechtsventrikulären Hypertrophie (RVH) wurden erstmals gegen Ende des 19. Jahrhunderts von dem deutschen Arzt Ernst von Romberg beobachtet, der den Begriff „pulmonalvaskuläre Sklerose“ prägte ( 11 ). Die Ätiologie der PH war zu diesem Zeitpunkt jedoch noch unklar, und sie wurde viele Jahre lang fälschlicherweise der Syphilis zugeschrieben ( 12 , 13 ). Obwohl der britische Kardiologe Oscar Brenner diesen Zusammenhang im Jahr 1935 schließlich widerlegte, konnte er keine Erklärung für das Zusammentreffen von Lungengefäßveränderungen und RVH liefern ( 14 ). Erst mit der Einführung der Rechtsherzkatheterisierung Mitte des 20. Jahrhunderts wurden diese Beobachtungen untrennbar mit einem erhöhten pulmonalarteriellen Druck (PAP) verknüpft. Trotz umfangreicher Anwendung bei Tieren im frühen 20. Jahrhundert galt die Herzkatheterisierung beim Menschen allgemein als unsicher, bis Werner Forssman im Jahr 1929 einen mutigen Selbstkatheterismus seines rechten Herzens beging ( 15 , 16 ). Während dieser mutige Akt der Tapferkeit in der medizinischen Gemeinschaft zunächst schlecht aufgenommen und weitgehend ignoriert wurde, erkannten die amerikanischen Ärzte Dickinson Richards und Andrew Cournard in den 40er Jahren die Bedeutung von Forssmans Arbeit. Ihre bahnbrechende Forschung charakterisierte erstmals mPAP bei Herz- und Lungenerkrankungen, eine Leistung, für die sie 1956 gemeinsam mit Forssman mit einem Nobelpreis ausgezeichnet wurden ( 17 , 18 ).In weiteren Arbeiten in den 1950er Jahren wurden die klinischen und pathologischen Merkmale der PH ermittelt. Eine der ersten detaillierten Beschreibungen der hämodynamischen Profile der Krankheit wurde 1951 von David Dresdale geliefert. Er beobachtete auch Zyanose, Orthopnoe und Hämoptyse bei Patienten mit idiopathischer PH. Dresdale und andere bezeichneten ihre Befunde als „primäre pulmonale Hypertonie“ ( 19 , 20 ); diese Terminologie lieferte eine wichtige Nomenklatur für die damals entstehende Forschungsgemeinschaft. Darüber hinaus wurde eine umfassende Charakterisierung der histologischen Veränderungen bei PH von Donald Heath vorgenommen. In Zusammenarbeit mit William Whitaker beschrieb er 1953 erstmals eine ausgedehnte Verdickung der Pulmonalarterienwand in Verbindung mit einer Fibrose bei Personen mit angeborenem Herzfehler, Mitralstenose und idiopathischer PH ( 21 , 22 ). Heath und Jesse Edwards entwickelten anschließend ein detailliertes histologisches Klassifikationssystem, das mit dem Schweregrad der PH beim Eisenmenger-Syndrom korrelierte und von einer frühen vaskulären Mediahypertrophie bei leichter PH bis zur späten Intimafibrose bei schwerer Erkrankung reichte ( 23 ).Frühe Zusammenhänge zwischen akuter Hypoxie und pulmonaler HypertonieObwohl erhöhter PAP erstmals 1852 mit Atemversagen in Zusammenhang gebracht wurde ( 24 ), wurde ein kausaler Zusammenhang zwischen Hypoxie und PH erst 1946 festgestellt, als von Euler und Kollegen erhöhte mPAP-Werte nachwiesen, wenn Katzen sowohl Hypoxie als auch Hyperkapnie ausgesetzt wurden ( 25 ); 1947 berichtete Dresdale über ähnliche Befunde bei Menschen ( 26 ). Diese Berichte stellten die ersten Messungen einer Verengung der pulmonalarteriolen durch Hypoxie bzw. einer hypoxischen pulmonalen Vasokonstriktion (HPV) dar, eines Phänotyps, der den vasodilatatorischen Eigenschaften der Hypoxie auf den Systemkreislauf gegenübersteht ( 27 ). Damals stellte von Euler zutreffend die Hypothese auf, dass diese physiologische Reaktion vorteilhaft sei, um Blut aus Bereichen regionaler Lungenhypoxie, die auf eine verringerte Ventilation zurückzuführen ist, abzuleiten und so die Sauerstoffsättigung des Blutes aufrechtzuerhalten (ein Konzept, das heute als Ventilations-Perfusions-Matching bezeichnet wird).Die negativen Auswirkungen dieser Reaktion im Kontext einer allgemeineren alveolären Hypoxie wurden jedoch bald offensichtlich, insbesondere in Bezug auf das Höhenlungenödem (HAPE). Während schon früher bei Höhenreisenden ein Syndrom mit Husten, blutigem Auswurf und schwerer Atemnot festgestellt worden war, war Hurtado 1937 der Erste, der dies einem Lungenödem zuschrieb ( 28 ). Eine gleichzeitige PH und HAPE wurde erstmals 1962 von Fred et al. ( 29 ) bei einem Patienten mit einem mPAP von 46 mmHg festgestellt , obwohl Hultgren und Spickard diesen Zusammenhang bereits 1960 vorgeschlagen hatten, als sie in 41 Fällen von HAPE in Peru klinisch einen lauten zweiten Herzton und elektrographische Veränderungen beschrieben, die mit einer PH übereinstimmten ( 30 ). Hultgren et al. bestätigten dies anschließend bei sieben Personen nach akuter Höhenexposition im Jahr 1964, bei denen mPAP-Werte zwischen 33 und 117 mmHg lagen (PVR wurde bei 2 Patienten berichtet; 8 und 36 WU). Wichtig ist, dass die Autoren auch eine gewisse Reversibilität des Lungenödems und des erhöhten mPAP bei Gabe von 100% Sauerstoff nachweisen konnten ( 31 ). Weitere Arbeiten dieser und anderer Gruppen ( 32 ) ergaben eine Prädisposition für ein Lungenödem bei fünf Personen mit mPAP-Werten von 38,8 ± 10,3 mmHg beim Aufstieg auf 3.100 m ( 33 ).Obwohl PH schon früh als Faktor in der Pathogenese von HAPE identifiziert wurde, ist weiterhin unklar, wie dies zur Ödembildung führt. Hultgren schlug vor, dass aufgrund der Heterogenität von HPV Bereiche der Lunge überdurchblutet werden, was zu einem Versagen der pulmonalkapillaren Stressbelastung bei HAPE führt ( 34 ). Tatsächlich haben nachfolgende Studien an HAPE-anfälligen Personen Hinweise auf eine übertriebene Heterogenität der Durchblutung erbracht ( 35 ), während hämodynamische Studien auch erhöhte pulmonalkapillare Drücke (19 ± 1 mmHg vs. 13 ± 1 mmHg bei den Kontrollen) und arterielle Drücke (mPAP 37 ± 2 mmHg vs. 26 ± 1 mmHg bei den Kontrollen) bei solchen Personen in großen Höhen gezeigt haben ( 36 ). Weitere Faktoren in der Pathogenese von HAPE sind eine beeinträchtigte Stickoxid-(NO)-Biosynthese und eine verringerte Reabsorption von Alveolarflüssigkeit, wie hier besprochen ( 37 , 38 ).Chronische Hypoxie und Umbau des LungengefäßsystemsGleichzeitig begann man mit der Untersuchung der Auswirkungen chronischer Hypoxie auf die Lungengefäße von Höhenpopulationen. Dies begann zunächst bei Rindern, die in großen Höhen häufig erhebliche Ödeme im unteren Brustbereich entwickelten, die sogenannte „Brisket Disease“, eine Erkrankung, die beim Aufstieg eine erhebliche Sterblichkeitsrate verursachte. In den 40er Jahren stellte Rue Jensen erstmals eine Dilatation und Insuffizienz des rechten Ventrikels zusammen mit einer Brisket Disease bei Höhenrinderpopulationen in Colorado fest ( 39 ); in weiteren Arbeiten mit Grover, Reeves und Will wurde eine positive Korrelation zwischen der Schwere der RVH und dem Grad des erhöhten PAP-Werts festgestellt ( 40 ). Weitere Zuchtexperimente unter der Leitung von Grover und Reeves deuteten auf einen autosomal-dominanten Erbgang der HAPH bei diesen Rindern hin ( 41 , 42 ). Im Gegensatz zu Hultgrens späteren Befunden bei Patienten mit HAPE ( 31 ) kehrte 100 % Sauerstoff die PH bei Rindern nicht vollständig um ( 40 ), was auf eine geringere Rolle von HPV in der PH-Pathogenese im Rahmen von chronischer Hypoxie hindeutet. Interessanterweise wurden ähnliche Befunde bei einer menschlichen Population von Anand et al. dokumentiert, die Hinweise auf periphere Ödeme und Kurzatmigkeit bei indischen Soldaten beschrieben, die sich 18 Wochen lang in Höhen über 5.800 m aufgehalten hatten. Obwohl in der Höhe keine Messungen durchgeführt wurden, lieferten Rechtsherzkatheteruntersuchungen dieser Patienten kurz nach der Rückkehr auf Meereshöhe Hinweise auf eine leichte präkapilläre pulmonale Hypertonie mit mPAP- und PVR-Werten von 26,1 ± 4,5 mmHg bzw. 3,41 ± 2,46 WU ( 43 ).Über erhöhte PAP-Werte bei Menschen in großen Höhen wurde erstmals 1956 von Canepa in einem der ersten Berichte über eine Rechtsherzkatheterisierung bei Peruanern aus Morochoca (4.540 m) berichtet. Bei 7 Hochlandbewohnern betrugen die Werte 25 (Bereich 18–29) mmHg und bei zwei Patienten mit chronischer Bergkrankheit 34 bzw. 35 mmHg. Diese Befunde wurden jedoch zunächst auf Polyzythämie, abnorme Ventilation und erhöhte Herzleistung zurückgeführt ( 44 ). Erst die Arbeiten unserer peruanischen Landsleute Dante Peñaloza und Javier Arias-Stella in den 1960er Jahren zeigten, dass PH bei Menschen in großen Höhen mit einer Umgestaltung der Lungengefäße einherging ( 45 – 47 ). Frühere Arbeiten von Peñaloza bestätigten erhöhten mPAP (23 ± 5,1 mmHg) in Zusammenhang mit RVH bei Peruanern in großen Höhen ( 48 , 49 ) und stellten interessanterweise auch PH bei Neugeborenen sowohl auf Meereshöhe als auch in großen Höhen fest, mit einer raschen Rückbildung auf Meereshöhe, die bei peruanischen Säuglingen nicht beobachtet wurde ( 50 ). Wichtig ist, dass die Autoren keinen Unterschied bei PAWP und CO zwischen Bewohnern auf Meereshöhe und in großen Höhen feststellten, wobei der PVR bei Bewohnern großer Höhen um 4,15 ± 2,66 WU erhöht war ( 46 , 49 ). Die Gabe von Sauerstoff an peruanische Erwachsene führte zu geringfügigen mPAP-Senkungen von 15-20 % ( 45 , 47 ), was früheren Ergebnissen bei der Brisket-Krankheit entspricht ( 40 ) und darauf hindeutet, dass die pulmonalvaskuläre Umgestaltung hauptsächlich für PH bei chronischer Hypoxie verantwortlich ist. Diese Hypothese wurde durch Jensen und Alexander weiter untermauert, die später eine lineare Beziehung zwischen medialer Hypertrophie der Pulmonalarterien und PAP bei Rindern nachwiesen ( 51 ). Obwohl eine sofortige Besserung durch Sauerstoff nicht möglich war, stellte Peñaloza insbesondere bei Höhenpopulationen nach 2 Jahren auf Meereshöhe eine Normalisierung von mPAP (12 ± 1,9 mmHg) und PVR (1,81 ± 0,44 WU) fest. Dies zeigte, dass Veränderungen infolge chronischer Hypoxie nicht dauerhaft sind ( 52 ). Ergänzend zu diesem Befund erholten sich die von Anand et al. untersuchten indischen Soldaten, die während ihres Höhenaufenthaltes Anzeichen einer Rechtsherzinsuffizienz entwickelt hatten, 12–16 Wochen nach dem Abstieg aus der großen Höhe vollständig. Dabei kam es zu einer Umkehrung der Kardiomegalie und einer Normalisierung des mPAP (16,3 ± 2,9 mmHg) und des pulmonal-vaskulären Widerstandes (PVR) (1,34 ± 0,48 WU) ( 43 ).Während die obigen Studien an gesunden Personen nahelegen, dass erhöhter pulmonalarterieller Druck in Höhenlagen überall anzutreffen ist, bleibt unklar, ob das Ausmaß der Erhöhung bei gesunden Menschen in Höhenlagen den Wert erreicht, der eine präkapilläre PH definiert. Eine aktuelle Metaanalyse von Soria et al. ergab einen durchschnittlichen systolischen PAP von 25,3 mmHg bei Bevölkerungen in großen Höhen mit einer größeren Verbreitung als unter Flachlandbewohnern, was selbst nach den neuen WHO-Kriterien auf eine geringe Prävalenz von PH hindeutet ( 8 , 10 ). Außerdem wird über PVR selten berichtet, und eine bemerkenswerte Beschränkung der berichteten PVRs bei historischen Katheterisierungsstudien in Höhenlagen ist die fehlende Korrektur für den Hämatokrit. Der Widerstand gegen den Blutfluss hängt von der Viskosität sowie den Gefäßdimensionen ab [überprüft von Vanderpool und Naeije ( 53 )], wobei Gleichungen die Beziehung beschreiben, die aus isolierten perfundierten Lungenexperimenten mit Veränderungen des Hämatokrits abgeleitet wurden ( 54 ). Die Angabe des Hämatokritwertes ist daher für die Ermittlung des wahren PVR wichtig ( 53 , 55 ) und kann zu falschen Annahmen über das Ausmaß der vaskulären Umgestaltung bei gesunden Personen nach hypoxischer Exposition führen.Ähnlich wie bei Patienten mit Lungenerkrankungen gibt es jedoch auch bei Höhenbewohnern eine Untergruppe, die eine schwerere PH entwickelt. Im Jahr 2005 wurde eine Konsensdefinition für Höhenkrankheit (HAPH) veröffentlicht, die Personen in Höhenlagen mit übertriebener Erhöhung des PAP sowie Anzeichen von RVH und Rechtsherzinsuffizienz umfasst ( 56 ). HAPH wurde definiert als ein mittlerer PAP von >30 mmHg (oder systolischer PAP > 50 mmHg) ohne übermäßige Erythrozytose (Hämoglobinkonzentration > 19 g/dl für Frauen, > 21 g/dl für Männer). Diese Definition ermöglichte die Unterscheidung zwischen HAPH und der chronischen Bergkrankheit (CMS), bei der eine übermäßige Erythrozytose vorliegt ( 57 , 58 ). Obwohl die oben genannten epidemiologischen Studien darauf hinweisen, dass HAPH gemäß der obigen Definition unter Menschen in großen Höhen selten ist ( 10 ), kann die Untersuchung dieser Personen wichtige Erkenntnisse über molekulare Mechanismen liefern, die vasokonstriktive und Umbauprozesse sowohl bei hypoxischer PH als auch möglicherweise bei anderen Formen von PAH steuern. Man könnte jedoch argumentieren, dass eine Überarbeitung der aktuellen Definition von HAPH, um den Hämatokrit-korrigierten PVR einzubeziehen, diese Forschung erleichtern würde.Artenspezifische Unterschiede in großen HöhenAufgrund dieser Ergebnisse bei Menschen und Rindern begann Donald Heath sich für die Variabilität der Lungengefäße bei Populationen in großen Höhen zwischen Arten zu interessieren. Heath reiste 1965 zusammen mit Peter Harris zum Cerro de Pasco in Peru (4.330 m). Dies war die erste von vielen Höhenexpeditionen zur PH-Erforschung. Einer der Autoren dieses Artikels gibt in Kasten 1 einen beschreibenden Überblick über diese Arbeit . 1974 veröffentlichte Heath seine Forschung an Lamas ( Lama glama ), die einen Mangel an Pulmonalarteriolenmuskularisierung bzw. RVH in großen Höhen zeigte, was im Widerspruch zu früheren Befunden bei Menschen und Rindern ( Bos taurus ) stand ( 59 ). Ein ähnlich dünnwandiges Lungengefäßsystem wurde auch beim Himalaya-Yak ( Bos grunniens ) festgestellt ( 60 ), was darauf hindeutet, dass die natürliche Selektion beim Verlust der dickwandigen, reaktiven Lungenarterien, die typischerweise für die Gattung Bos charakteristisch sind, eine Rolle gespielt hat. Kasten 1. Anpassung an chronische Hypoxie in den Anden.Die Unterscheidung zwischen den verschiedenen biologischen Klassen von Menschen und Säugetieren in großen Höhen lässt sich am besten durch einen gedanklichen Spaziergang durch die Straßen und die umliegende Landschaft einer beliebigen Kleinstadt in den Hochanden veranschaulichen. Die durchgeführten Studien zeigten, dass es in großen Höhen keinen einzelnen stereotypen Menschen oder Säugetiere gibt .Cerro de Pasco ist eine Bergbaugemeinde mit 70.000 Einwohnern und liegt auf einer Höhe von 4.330 m in den zentralen Anden Perus. Auf den Straßen tummeln sich viele Tieflandbewohner, die in wenigen Stunden von Lima an der Küste in große Höhen gelangt sind. Etwa 50 % leiden an einer leichten, akuten Höhenkrankheit, die hauptsächlich durch Kopfschmerzen, Schlaflosigkeit, Appetitlosigkeit, Übelkeit und Schwindel gekennzeichnet ist. Diese Symptome sind die Folge einer hypobaren Hypoxie und können als physiologische Komponenten der frühen Akklimatisierung angesehen werden .Im Gegensatz dazu sind die meisten Menschen einheimische Quechua-Indianer, die in den Hochanden geboren und aufgewachsen sind. Diese Nachkommen des Inka-Volkes haben sehr charakteristische körperliche Merkmale wie Hautfarbe, stark polyzythämische und geschwollene Bindehaut und Lippen. Viele haben einen großen Brustkorb, der im Vergleich zu ihrem kleinen, gedrungenen Körperbau hervorsteht und in keinem Verhältnis steht. Diese einheimischen Hochlandbewohner führen ein normales, geschäftiges Leben in großer Höhe. Sie spielen in Höhen, die höher sind als der Gipfel des Matterhorns in den Schweizer Alpen, spannende Fußballspiele .Auf den Weiden rund um den Cerro de Pasco leben einheimische Bergtiere wie Lamas, Alpakas, Vikunjas und Guanakos. Diese Tiere leben seit vielen tausend Jahren auf dem Andenhochland. Die Vitalität und Aktivität dieser Tiere in einer Atmosphäre, die von schwerer hypobarer Hypoxie geprägt ist, ist einfach beeindruckend . Eine interessante biologische Fragestellung ergibt sich, wenn sich Arten innerhalb der gleichen Gattung kreuzen; ein Beispiel dafür ist die Kreuzung von Rindern, aus der Arten wie Dzo (Kuh x Yak) und Stol (Dzo x Stier) hervorgegangen sind ( 61 ). Im Jahr 1986 haben Arbeiten der Forschergruppe um Peter Harris ergeben, dass der Schutz vor PH mit dem Grad der Yak-Abstammung korreliert; während Dzos und Yaks nur eine minimale PH zeigten, hatte die Hälfte der Stols deutlich erhöhte PAP-Werte, die denen von Rindern ähnelten ( 62 ), was auf ein gewisses Maß an Vererbung hindeutet. Diese Beobachtungen stützen die Theorie, dass Tiere, die in großen Höhen heimisch sind, sich genetisch an ihre hypoxische Umgebung angepasst haben, im Gegensatz zu einer Akklimatisierung, wie sie bei anderen Arten zu beobachten ist.Molekulare Mechanismen der PH bei akuter und chronischer hypoxischer ExpositionWährend die obigen Belege die Verbindungen zwischen hypoxischer Exposition und pulmonaler Hypertonie klar veranschaulichen, sind die zugrundeliegenden genetischen, molekularen und zellulären Mechanismen, die diese Phänotypen regulieren, nach wie vor unklar und zum Teil umstritten. Dennoch haben die grundlagenwissenschaftlichen Arbeiten der letzten 25 Jahre unser Verständnis der gemeinsamen Signalwege erweitert, die sowohl die Höhenanpassung als auch die durch Hypoxie induzierte PH steuern. Die pulmonale Vasokonstriktion bei akuter Hypoxie, die anderswo ausführlich besprochen wurde ( 63 – 65 ), umfasst mindestens zwei Phasen mit unterschiedlichen Mechanismen. Zunächst vermitteln Veränderungen des Redoxstatus in den Mitochondrien der glatten Muskelzellen Änderungen des Kalium- und spannungsgesteuerten Kalziumkanalflusses und fördern so die Kontraktion ( 63 ). Anschließend wird die Vasokonstriktion durch Mechanismen aufrechterhalten, zu denen eine verringerte Bioverfügbarkeit von NO ( 66 ), die Freisetzung endothelialer Vasokonstriktoren ( 67 ) und eine erhöhte Kalziumsensitivität der Myofilamente ( 68 ) gehören. Der Schwerpunkt dieses Artikels liegt auf der Rolle der Hypoxie-induzierbaren Faktoren (HIFs) bei der Gefäßumgestaltung aufgrund chronischer hypoxischer Exposition.Hypoxie-induzierbare Faktoren (HIFs) und pulmonale vaskuläre UmgestaltungHIFs sind eine Familie heterodimerer Transkriptionsfaktoren, die 1995 entdeckt wurden ( 69 ), deren α-Untereinheiten bei Hypoxie durch die Hemmung der sauerstoffabhängigen Enzymaktivität der Prolylhydroxylase (PHD) stabilisiert werden ( 70 ); unter normoxischen Bedingungen führt die Hydroxylierung von HIF-α durch PHDs zur Ubiquitinierung durch den VHL-Komplex, was zum anschließenden proteasomalen Abbau führt ( Abbildung 1 ) ( 71 ). Während HIF-1α im gesamten Körpergewebe ubiquitär exprimiert wird ( 72 ), ist die Expression von HIF-2α gewebespezifisch mit einer Tendenz zum Endothel ( 73 , 74 ). Bei Hypoxie induziert die Stabilisierung der HIF-α-Untereinheiten die Transkription von Zielen mit einer breiten Palette von Funktionen. Abbildung 1

OMNIA TEMPUS HABENT
Diagnose IPAH im Februar 2013, in Behandlung bei OA Dr. Ulrich Krüger, jetzt Dr. Fischer Herzzentrum Duisburg, Medikamente: Sildenafil, Bosentan jetzt Macitentan, Subkutane Treprostinilpumpe, seit Januar 2024 getunnelter ZVK mit externer Pumpe (Groshongkatheter), 24/7 Sauerstoff, Marcumar, Diuretika
Bitte Anmelden oder Registrieren um der Konversation beizutreten.
