- Beiträge: 1748
Sidebar
- Forum
- PH-Forum
- Forschung und Wissen
- GATA6 koordiniert das Übersprechen zwischen BMP10 und der oxidativen Stressachse
GATA6 koordiniert das Übersprechen zwischen BMP10 und der oxidativen Stressachse
29 Apr 2023 21:59 #1778
von danny
OMNIA TEMPUS HABENT
Diagnose IPAH im Februar 2013, in Behandlung bei OA Dr. Ulrich Krüger, jetzt Dr. Fischer Herzzentrum Duisburg, Medikamente: Sildenafil, Bosentan jetzt Macitentan, Subkutane Treprostinilpumpe, seit Januar 2024 getunnelter ZVK mit externer Pumpe (Groshongkatheter), 24/7 Sauerstoff, Marcumar, Diuretika
GATA6 koordiniert das Übersprechen zwischen BMP10 und der oxidativen Stressachse wurde erstellt von danny
www.nature.com/articles/s41598-023-33779-8AbstraktDie pulmonale arterielle Hypertonie (PAH) ist eine lebensbedrohliche Erkrankung, die durch einen fortschreitenden Anstieg des pulmonalen Gefäßwiderstands gekennzeichnet ist, der zu rechtsventrikulärem Versagen und häufig zum Tod führt. Hier berichten wir, dass der Mangel des Transkriptionsfaktors GATA6 ein gemeinsames pathologisches Merkmal von PA-Endothelzellen (PAEC) und glatten Muskelzellen (PASMC) bei menschlicher PAH und experimenteller PH ist, das für die Aufrechterhaltung hyperproliferativer zellulärer Phänotypen, Lungengefäßumbau und verantwortlich ist pulmonale Hypertonie. Wir zeigen weiter, dass GATA6 als Transkriptionsfaktor und direkter positiver Regulator von antioxidativen Enzymen wirkt und sein Mangel an PAH/PH-Lungengefäßzellen oxidativen Stress und mitochondriale Dysfunktion induziert. Wir zeigen, dass GATA6 durch die BMP10/BMP-Rezeptorachse reguliert wird und sein Verlust in PAECs und PASMC in PAH den BMPR-Mangel unterstützt. Darüber hinaus haben wir festgestellt, dass GATA6-defiziente PAEC, die auf parakrine Weise wirken, die Proliferation erhöhen und andere pathologische Veränderungen in PASMC induzieren, was die Bedeutung von GATA6 in der pulmonalen Gefäßzellkommunikation unterstützt. Die Behandlung mit Dimethylfumarat löste oxidativen Stress und BMPR-Mangel, kehrte hämodynamische Veränderungen durch endothelialen Gata6-Verlust bei Mäusen um und hemmte die Proliferation und induzierte Apoptose bei humanen PAH-PASMC, was stark darauf hindeutet, dass die Bekämpfung des GATA6-Mangels einen therapeutischen Fortschritt für Patienten mit PAH darstellen könnte. die Proliferation erhöhen und andere pathologische Veränderungen in PASMC induzieren, was die Bedeutung von GATA6 für die Kommunikation der Lungengefäßzellen unterstützt. Die Behandlung mit Dimethylfumarat löste oxidativen Stress und BMPR-Mangel, kehrte hämodynamische Veränderungen durch endothelialen Gata6-Verlust bei Mäusen um und hemmte die Proliferation und induzierte Apoptose bei humanen PAH-PASMC, was stark darauf hindeutet, dass die Bekämpfung des GATA6-Mangels einen therapeutischen Fortschritt für Patienten mit PAH darstellen könnte. die Proliferation erhöhen und andere pathologische Veränderungen in PASMC induzieren, was die Bedeutung von GATA6 für die Kommunikation der Lungengefäßzellen unterstützt. Die Behandlung mit Dimethylfumarat löste oxidativen Stress und BMPR-Mangel, kehrte hämodynamische Veränderungen durch endothelialen Gata6-Verlust bei Mäusen um und hemmte die Proliferation und induzierte Apoptose bei humanen PAH-PASMC, was stark darauf hindeutet, dass die Bekämpfung des GATA6-Mangels einen therapeutischen Fortschritt für Patienten mit PAH darstellen könnte.
EinführungDie pulmonale arterielle Hypertonie (PAH) ist eine lebensbedrohliche Erkrankung, die durch Vasokonstriktion und Umbau der präkapillären Lungenarteriolen gekennzeichnet ist, was zu einer Einschränkung des Blutflusses, einem Anstieg des pulmonalarteriellen Drucks und des pulmonalen Gefäßwiderstands und schließlich zu rechtsventrikulärem Versagen und Tod führt 1 . 2 . Unbehandelt beträgt die mediane Überlebenszeit 2,8 Jahre, und selbst mit den derzeitigen Behandlungsschemata bleibt die Prognose schlecht (Sterblichkeitsrate von 10–15 % jährlich) 3 , 4 , 5 . Die Krankheit ist nach wie vor schlecht behandelt, insbesondere bei Patienten mit schnellem Fortschreiten, und eine Lungentransplantation ist die einzige Option für Patienten im Endstadium.Der pulmonale Gefäßumbau ist ein komplexer Prozess mit multizellulärer Beteiligung. Bei etablierter PAH tragen das gesteigerte Wachstum und Überleben von glatten PAH-Muskelzellen (PASMC) und die Hyperproliferation von Endothelzellen (PAEC) signifikant zur Obliteration des Lumens kleiner PAs, zum Umbau der Lungengefäße und zur gesamten PAH bei 6 , 7 , 8 .GATA6 ist einer von sechs hochkonservierten Transkriptions-GATA-Faktoren mit zwei Zinkfingern in Tandemanordnung, die mit anderen Transkriptionsregulatoren interagieren und das kanonische DNA-Motiv (G/A)GATA(A/T) 9 binden . Menschliches GATA6 wird in einer Vielzahl von Geweben exprimiert und behält die differenzierten Zellphänotypen bei 10 , 11 . Im Gefäßsystem wurde GATA6 hauptsächlich bei systemischen VSMC untersucht. Es wird in ruhenden VSMC stark exprimiert und in verletzten Gefäßen schnell herunterreguliert 12 . Die Rettung von Gata6-Spiegeln in ballongeschädigten Halsschlagadern führte zu einer VSMC-Differenzierung und einer reduzierten neointimalen Bildung bei Ratten 12 . Eine globale Transkriptomanalyse identifizierte GATA6 als einen entscheidenden Regulator des VSMC-Schicksals im arteriellen Baum 13 , was seine Bedeutung bei der systemischen vaskulären Homöostase weiter unterstützt.Unser Wissen über die Rolle von GATA6 im pulmonalen Gefäßsystem ist jedoch begrenzt durch die Veröffentlichung, die den Gata6-Verlust in PAs von Ratten mit Pneumonektomie und Monocrotalin (MCT)-induziertem PH 14 beschreibt, und einen neueren Bericht unserer Gruppe, der sich auf den endothelialen GATA6-Verlust in konzentriert PH-Entwicklung 15 . Unsere Studien zeigten, dass GATA6 sowohl im Endothel als auch im VSMC bei IPAH und SSc-PAH 15 defizient ist . Bemerkenswerterweise entwickeln Mäuse mit bedingter Deletion von Gata6 in Endothelzellen ( Gata6 -CKO) spontan PH, was darauf hindeutet, dass die Herunterregulierung von GATA6 ein frühes und entscheidendes Ereignis ist, das zu einer endothelialen Dysfunktion und der Entwicklung von PH 15 führt . Die Mechanismen, durch die der GATA6-Verlust eine Endothelschädigung und die nachfolgende Entwicklung von PH induziert, wurden jedoch nicht aufgeklärt.Diese Studie wurde durchgeführt, um die Rolle und funktionelle Bedeutung des GATA6-Mangels im Lungengefäßsystem zu klären und das Potenzial der GATA6-Achse als therapeutisches Ziel bei PAH zu bewerten. Hier berichten wir über neue Funktionen von GATA6 als Regulator von oxidativem Stress und BMP10-Signalisierung. Wir zeigen auch, dass Dimethylfumarat (DMF) sehr wirksam bei der Linderung der durch Gata6-Verlust in vivo verursachten pathologischen Veränderungen ist.
...
...
DiskussionHier berichten wir über neuartige Mechanismen der GATA6-Regulierung und -Funktion im Lungengefäßsystem und liefern Beweise, die die Attraktivität der GATA6-Achse als molekularer Zielweg für therapeutische Interventionen bei PAH belegen. Zu unseren neuen Erkenntnissen gehören: (i) GATA6 wirkt als Transkriptionsfaktor und direkter positiver Regulator antioxidativer Enzyme, und sein Mangel an PAH/PH-Lungengefäßzellen induziert oxidativen Stress und mitochondriale Dysfunktion; (ii) GATA6 bildet ein bidirektionales Übersprechen mit der BMP10/BMP-Rezeptorachse, und sein Verlust in PAH/PH-Lungengefäßzellen unterstützt einen BMPR-Mangel; (iii) GATA6 spielt eine wichtige Rolle bei der Kommunikation der pulmonalen Gefäßzellen, und ein endothelialer GATA6-Mangel führt zu einem GATA6-Verlust bei PASMC; 8 ).Abbildung 8
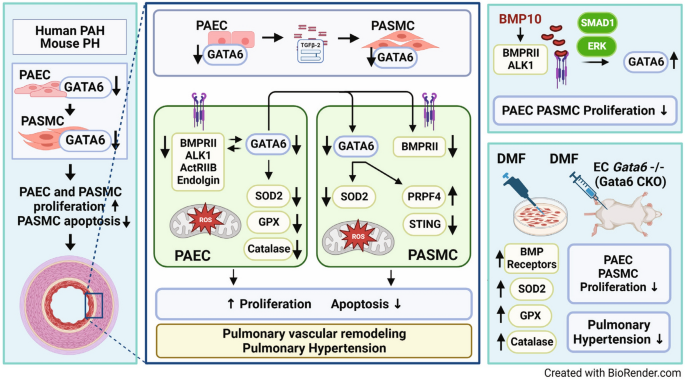 Grafische Darstellung der Rolle von GATA6 bei der Koordinierung des Übersprechens zwischen BMP10 und der oxidativen Stressachse bei PAH. GATA6 ist ein Aktivator antioxidativer Enzyme und sein Mangel an PAEC und PASMC induziert oxidativen Stress und mitochondriale Dysfunktion. BMP10 induziert die Expression von GATA6 über den ALK1-, BMPRII-, ENG- und ERK-Signalweg. GATA6 wiederum aktiviert transkriptionell BMP-Rezeptoren in PAEC. Das endotheliale GATA6 reguliert die PASMC-Funktion über parakrine Faktoren. TGFβ2, das von GATA6-defizientem PAEC sekretiert wird, induziert die PASMC-Proliferation. Die Verabreichung von Dimethylfumarat (DMF) an Mäuse mit Endothel-Gata6-Verlust stellt die Expression von BMP-Rezeptoren wieder her, löst oxidativen Stress und kehrt den PH um.
Das gegenwärtige Paradigma von PAH ist, dass eine frühe Schädigung von PAEC zu einer positiven Selektion von hyperproliferativen PAEC und einer Umprogrammierung von PASMC zu einem proliferativen/Apoptose-resistenten Phänotyp, einer daraus resultierenden Umgestaltung kleiner Lungenarterien und pulmonaler Hypertonie führt
7
. Oxidativer Stress gilt als Hauptantriebskraft der pro-proliferativen und anti-apoptotischen Veränderungen bei PAH PAEC und PASMC
50
,
51
,
52
. Hier zeigen wir, dass GATA6 ein wichtiger Transkriptionsaktivator für die beiden zentralen mitochondrialen Enzyme SOD2 und GPX-1 ist, die für die antioxidative Reaktion in PAEC erforderlich sind. Der Verlust von GATA6 in PAH PAEC verursachte eine übermäßige zelluläre und mitochondriale ROS-Produktion aufgrund der reduzierten Aktivität von SOD2, GPX1 sowie Katalase. SOD2ist ein mutmaßliches Tumorsuppressor-Gen, dessen Mangel mit proliferativen Erkrankungen wie PAH und Krebs in Verbindung gebracht wird. Zusätzlich zu oxidativem Stress
53
,
52
fördert eine verringerte Expression von SOD2 PH durch Aktivierung von HIF1α, was eine metabolische Verschiebung zur Glykolyse, erhöhte Proliferation und verringerte Apoptose verursacht
54
,
55
. Wir haben zuvor über eine erhöhte Hif1α-, Hif1β- und Hif2α-Expression in den Lungen von Gata6CKO-Mäusen berichtet, was auf eine mechanistische Verbindung zwischen GATA6 und SOD2 hindeutet
15
. Tatsächlich zeigen unsere neuen Daten, dass ein GATA6-Mangel zu einem Verlust von SOD2 in Lungengefäßzellen von Mensch und Maus führt und dass die Wiederherstellung von GATA6 in PAH PAEC und PASMC die Proliferation beider Zelltypen reduziert. Darüber hinaus korrelierte die Reexpression von GATA6 in PAH-PAEC mit erhöhten SOD2-Spiegeln, was darauf hindeutet, dass SOD2 zu den antiproliferativen Wirkungen von GATA6 in diesen Zellen beitragen könnte. Interessanterweise war die Wiederherstellung von GATA6 in PAH-PASMC, während sie die Proliferation unterdrückte und Apoptose induziert, nicht in der Lage, die SOD2-Expression wiederherzustellen, was darauf hindeutet, dass es PASMC-spezifische nachgeschaltete Mediatoren der antiproliferativen Funktion von GATA6 in PAH gibt.Weitere Analysen identifizierten zwei potenzielle neue Mediatoren des GATA6-abhängigen hyperproliferativen und antiapoptotischen Phänotyps bei PAH PASMC: STING (auch bekannt als TMEM173) und PRPF4. Der Stimulator der IFN- Gene STING wurde zwar noch nie in PAH-Lungengefäßen untersucht, ist aber für seine Rolle bei der Regulierung der angeborenen Immunität als Induktor der Typ-I-Interferonproduktion als Reaktion auf intrazelluläre Pathogene bekannt
56
,
57
. Wichtig ist, dass eine kürzlich durchgeführte Studie an Krebszellen eine weitere neue Rolle von STING als Regulator des Zellzyklus und als potenzielles Tumorsuppressorgen aufgedeckt hat
58
. Interessanterweise fanden wir heraus, dass die STING-Expression bei PAH PASMC reduziert war, was darauf hindeutet, dass die durch GATA6-Mangel induzierten proproliferativen Wirkungen teilweise durch die Insuffizienz von STING vermittelt werden könnten. Ein weiteres identifiziertes Ziel von GATA6 mit einer potenziellen Rolle im hyperproliferativen Phänotyp von PAH PASMC war der Prä-mRNA-Verarbeitungsfaktor 4, PRPF4. PRPF4 ist am Zusammenbau der Spleißosomen beteiligt, indem es das Spleißen der prä-mRNA als Komponente des U4/U6-U5-tri-snRNP-Komplexes reguliert
59
,
60
,
61
. PRPF4 wurde mit erhöhtem Zellwachstum und reduzierter Apoptose in Krebszellen in Verbindung gebracht, die spezifische Rolle von PRPF4 in diesen Prozessen bleibt jedoch unklar
62
,
63
. Die PRPF4-Expression war bei PAH PASMC erhöht, was darauf hindeutet, dass PRPF4 auch zum krankheitsspezifischen hyperproliferativen Phänotyp beitragen kann. Angesichts der möglicherweise wichtigen Rolle von STING und PFPR4 bei der Vermittlung von Zellproliferation und Apoptose sind weitere Arbeiten zu ihrer Beteiligung an PAH gerechtfertigt.BMP9 und -10 sind im Kreislauf vorhanden, spielen eine zentrale Rolle bei der Regulierung der Homöostase von Endothelzellen
64
und induzieren die Ruhe von Endothelzellen
26
,
38
, aber der zugrunde liegende Mechanismus wurde noch nicht vollständig aufgeklärt. Die mechanistische Bedeutung des BMP9-Mangels bei portopulmonaler Hypertonie wurde kürzlich vom Labor von Paul Yu berichtet
35
, und Funktionsverlustmutationen in BMP9 und GDF2 werden bei PAH identifiziert und führen zu verringerten zirkulierenden BMP9- und BMP10-Spiegeln bei PAH-Patienten
29
,
65
. Paradoxerweise schien die selektive Bmp9-Hemmung bei Nagetieren einen teilweisen Schutz gegen experimentelles PH
66 zu bieten
was auf die Komplexität der BMP9-Signalisierung hinweist. Unsere Daten haben eine neuartige positive Rückkopplungsschleife zwischen der BMP10- und der GATA6-Achse offenbart. Wir berichten nun, dass BMP10 sowohl in humanen als auch Maus-PAECs die Expression von GATA6 induziert und dass ALK1, BMPR2 und Endoglin für diese Induktion notwendig sind. Darüber hinaus zeigen wir, dass GATA6 die Gene ALK1, BMPR2 und ActRII transkriptionell aktiviert und dass ein GATA6-Mangel zu verringerten mRNA- und Proteinspiegeln dieser BMP-Rezeptoren führt. Zusammengenommen deuten unsere Daten auf eine funktionelle Co-Abhängigkeit der GATA6- und BMP10-Wege bei der Vermittlung der PAEC- und PASMC-Homöostase in einem nicht erkrankten Zustand und auf einen Schutz vor Hyperproliferation und beeinträchtigter Apoptose bei PAH hin.Das Übersprechen zwischen Endothelzellen und glatten Muskelzellen in Lungengefäßen ist seit langem als kritisches Ereignis während der pathologischen Gefäßumgestaltung bei PAH anerkannt
67
. Obwohl Fortschritte bei der Identifizierung von Faktoren erzielt wurden, die von PAEC oder PASMC produziert wurden, und die Erleichterung einer solchen Kommunikation
68
,
69
,
70
,
71
, ist mehr Arbeit erforderlich, um diesen Prozess vollständig aufzuklären. In Übereinstimmung mit früheren Berichten, die auf die erhöhte Fähigkeit von PAH PAEC hinweisen, Mitogene für PASMC
70 zu sezernieren
, hier haben wir gezeigt, dass PAEC mit GATA6-Mangel nicht nur die Proliferation von PASMC erhöht, sondern auch andere pathologische Veränderungen induziert, einschließlich der Herunterregulierung von GATA6, SOD2 und BMPR2 in PASMC. Die GATA6-abhängigen sezernierten Faktoren müssen jedoch noch charakterisiert werden.Zusammengenommen hat unsere Arbeit weitreichende nachteilige Auswirkungen eines GATA6-Mangels auf die Funktion von sowohl PAEC als auch PASMC im Zusammenhang mit PAH gezeigt. Diese Wirkungen können spezifisch für das Lungengefäßsystem sein, da unterschiedliche Folgen der endothelialen GATA6-Deletion in Karotis-Ligations- oder Femoralarterien-Drahtverletzungsmodellen berichtet wurden
72
. In diesen Modellen löste das Knock-out von endothelialem Gata6 eine schützende Wirkung aus, indem die Bildung von Neointima in beiden experimentellen Modellen reduziert wurde. Die Autoren brachten reduzierte PDGF-B-Spiegel mit den antiproliferativen Wirkungen in Verbindung, die mit dem endothelialen Gata6-Verlust verbunden sind. In unserer Studie konnten wir diese Befunde bei GATA6-defizientem humanem PAEC nicht reproduzieren (Daten nicht gezeigt), im Gegenteil, wir beobachteten einen moderaten Anstieg von PDGF-BmRNA als Reaktion auf die reduzierten GATA6-Spiegel. Der Grund für diese Diskrepanz ist unklar; Es ist jedoch möglich, dass sich Endothelzellen aus verschiedenen Gefäßbetten in Bezug auf die Auswirkungen des GATA6-Verlusts unterscheiden.Unsere Studie hat jedoch Einschränkungen. Insbesondere SSc-PAH PAEC und PASMC waren nicht in den erforderlichen Mengen verfügbar, um alle Experimente durchzuführen. Die SSc-PAH ist eine Untergruppe der seltenen PAH, die bei Patienten mit SSc der seltenen Krankheit auftritt. Im Jahr 2013 betrug die Prävalenz von SSc in den Vereinigten Staaten ~ 240 Fälle pro Million; und die Prävalenz von PAH bei Patienten mit SSc beträgt 8–14 %
73
. Dies macht von Patienten stammende Proben sehr selten und schränkt unseren Zugang zu den von Patienten stammenden residenten PA-Zellen der frühen Passage ein, die für die Forschung verfügbar sind. Wir sind jedoch der festen Überzeugung, dass die Einbeziehung der uns zur Verfügung stehenden Zellen in ausgewählte Experimente zusammen mit Zellen von anderen PAH-Patienten unser Verständnis der Pathobiologie von SSc-PAH und der gesamten PAH verbessert.Veröffentlichte Studien und unsere neuen Daten deuten stark darauf hin, dass GATA6 als multizellulärer Signalweg fungiert, der die pulmonalvaskuläre Homöostase reguliert, und dass ein dualer PAEC-PASMC-GATA6-Mangel den pulmonalvaskulären Umbau und PH fördert, indem er das Gleichgewicht zwischen den wichtigsten Signalwegen stört, die die Zellproliferation und das Überleben regulieren . Daher kann die Bekämpfung des GATA6-Mangels einen großen therapeutischen Fortschritt für Patienten mit PAH darstellen. Hier berichten wir, dass die DMF-Behandlung bei der Umkehrung hämodynamischer Veränderungen, der Verringerung oxidativer Schäden und der Wiederherstellung der Expression der Bmp-Rezeptoren in Gata6-CKO-Mäusen sehr wirksam war. Diese Ergebnisse stimmen mit den zuvor gezeigten vorteilhaften therapeutischen Wirkungen von DMF in Hypoxie- und SU5416/Hypoxie-Mausmodellen von PH
49 überein
. Während die NRF2-induzierenden Eigenschaften von DMF oder CDDO-Me häufig betont werden, ist es wichtig zu erkennen, dass diese Verbindungen mehrere, noch nicht vollständig verstandene Wirkungsweisen haben, die für ihre vorteilhaften Wirkungen bei multifaktoriellen Erkrankungen wie PAH verantwortlich sein könnten. Angesichts der zytoprotektiven und immunmodulatorischen Wirkungen von DMF und seiner nachgewiesenen Sicherheitsbilanz bei anderen chronischen Erkrankungen
74
,
75
könnte DMF eine attraktive therapeutische Strategie für PAH sein.StudienzulassungDie Verwendung von nicht identifiziertem menschlichem Gewebe und Zellen in dieser Studie wird vom IRB als „keine Forschung am Menschen“ betrachtet. Die institutionelle Genehmigung wurde durch das Protokoll Nr. 458 der University of Pittsburgh CORID erteilt. Alle tierexperimentellen Verfahren wurden gemäß Protokoll Nr. TR201900057 durchgeführt, das vom Boston University Institutional Animal Care and Use Committee überprüft und genehmigt wurde. Die Untersuchung stand im Einklang mit dem Guide for the Care and Use of Laboratory Animals, herausgegeben von den US National Institutes of Health (NIH).
Grafische Darstellung der Rolle von GATA6 bei der Koordinierung des Übersprechens zwischen BMP10 und der oxidativen Stressachse bei PAH. GATA6 ist ein Aktivator antioxidativer Enzyme und sein Mangel an PAEC und PASMC induziert oxidativen Stress und mitochondriale Dysfunktion. BMP10 induziert die Expression von GATA6 über den ALK1-, BMPRII-, ENG- und ERK-Signalweg. GATA6 wiederum aktiviert transkriptionell BMP-Rezeptoren in PAEC. Das endotheliale GATA6 reguliert die PASMC-Funktion über parakrine Faktoren. TGFβ2, das von GATA6-defizientem PAEC sekretiert wird, induziert die PASMC-Proliferation. Die Verabreichung von Dimethylfumarat (DMF) an Mäuse mit Endothel-Gata6-Verlust stellt die Expression von BMP-Rezeptoren wieder her, löst oxidativen Stress und kehrt den PH um.
Das gegenwärtige Paradigma von PAH ist, dass eine frühe Schädigung von PAEC zu einer positiven Selektion von hyperproliferativen PAEC und einer Umprogrammierung von PASMC zu einem proliferativen/Apoptose-resistenten Phänotyp, einer daraus resultierenden Umgestaltung kleiner Lungenarterien und pulmonaler Hypertonie führt
7
. Oxidativer Stress gilt als Hauptantriebskraft der pro-proliferativen und anti-apoptotischen Veränderungen bei PAH PAEC und PASMC
50
,
51
,
52
. Hier zeigen wir, dass GATA6 ein wichtiger Transkriptionsaktivator für die beiden zentralen mitochondrialen Enzyme SOD2 und GPX-1 ist, die für die antioxidative Reaktion in PAEC erforderlich sind. Der Verlust von GATA6 in PAH PAEC verursachte eine übermäßige zelluläre und mitochondriale ROS-Produktion aufgrund der reduzierten Aktivität von SOD2, GPX1 sowie Katalase. SOD2ist ein mutmaßliches Tumorsuppressor-Gen, dessen Mangel mit proliferativen Erkrankungen wie PAH und Krebs in Verbindung gebracht wird. Zusätzlich zu oxidativem Stress
53
,
52
fördert eine verringerte Expression von SOD2 PH durch Aktivierung von HIF1α, was eine metabolische Verschiebung zur Glykolyse, erhöhte Proliferation und verringerte Apoptose verursacht
54
,
55
. Wir haben zuvor über eine erhöhte Hif1α-, Hif1β- und Hif2α-Expression in den Lungen von Gata6CKO-Mäusen berichtet, was auf eine mechanistische Verbindung zwischen GATA6 und SOD2 hindeutet
15
. Tatsächlich zeigen unsere neuen Daten, dass ein GATA6-Mangel zu einem Verlust von SOD2 in Lungengefäßzellen von Mensch und Maus führt und dass die Wiederherstellung von GATA6 in PAH PAEC und PASMC die Proliferation beider Zelltypen reduziert. Darüber hinaus korrelierte die Reexpression von GATA6 in PAH-PAEC mit erhöhten SOD2-Spiegeln, was darauf hindeutet, dass SOD2 zu den antiproliferativen Wirkungen von GATA6 in diesen Zellen beitragen könnte. Interessanterweise war die Wiederherstellung von GATA6 in PAH-PASMC, während sie die Proliferation unterdrückte und Apoptose induziert, nicht in der Lage, die SOD2-Expression wiederherzustellen, was darauf hindeutet, dass es PASMC-spezifische nachgeschaltete Mediatoren der antiproliferativen Funktion von GATA6 in PAH gibt.Weitere Analysen identifizierten zwei potenzielle neue Mediatoren des GATA6-abhängigen hyperproliferativen und antiapoptotischen Phänotyps bei PAH PASMC: STING (auch bekannt als TMEM173) und PRPF4. Der Stimulator der IFN- Gene STING wurde zwar noch nie in PAH-Lungengefäßen untersucht, ist aber für seine Rolle bei der Regulierung der angeborenen Immunität als Induktor der Typ-I-Interferonproduktion als Reaktion auf intrazelluläre Pathogene bekannt
56
,
57
. Wichtig ist, dass eine kürzlich durchgeführte Studie an Krebszellen eine weitere neue Rolle von STING als Regulator des Zellzyklus und als potenzielles Tumorsuppressorgen aufgedeckt hat
58
. Interessanterweise fanden wir heraus, dass die STING-Expression bei PAH PASMC reduziert war, was darauf hindeutet, dass die durch GATA6-Mangel induzierten proproliferativen Wirkungen teilweise durch die Insuffizienz von STING vermittelt werden könnten. Ein weiteres identifiziertes Ziel von GATA6 mit einer potenziellen Rolle im hyperproliferativen Phänotyp von PAH PASMC war der Prä-mRNA-Verarbeitungsfaktor 4, PRPF4. PRPF4 ist am Zusammenbau der Spleißosomen beteiligt, indem es das Spleißen der prä-mRNA als Komponente des U4/U6-U5-tri-snRNP-Komplexes reguliert
59
,
60
,
61
. PRPF4 wurde mit erhöhtem Zellwachstum und reduzierter Apoptose in Krebszellen in Verbindung gebracht, die spezifische Rolle von PRPF4 in diesen Prozessen bleibt jedoch unklar
62
,
63
. Die PRPF4-Expression war bei PAH PASMC erhöht, was darauf hindeutet, dass PRPF4 auch zum krankheitsspezifischen hyperproliferativen Phänotyp beitragen kann. Angesichts der möglicherweise wichtigen Rolle von STING und PFPR4 bei der Vermittlung von Zellproliferation und Apoptose sind weitere Arbeiten zu ihrer Beteiligung an PAH gerechtfertigt.BMP9 und -10 sind im Kreislauf vorhanden, spielen eine zentrale Rolle bei der Regulierung der Homöostase von Endothelzellen
64
und induzieren die Ruhe von Endothelzellen
26
,
38
, aber der zugrunde liegende Mechanismus wurde noch nicht vollständig aufgeklärt. Die mechanistische Bedeutung des BMP9-Mangels bei portopulmonaler Hypertonie wurde kürzlich vom Labor von Paul Yu berichtet
35
, und Funktionsverlustmutationen in BMP9 und GDF2 werden bei PAH identifiziert und führen zu verringerten zirkulierenden BMP9- und BMP10-Spiegeln bei PAH-Patienten
29
,
65
. Paradoxerweise schien die selektive Bmp9-Hemmung bei Nagetieren einen teilweisen Schutz gegen experimentelles PH
66 zu bieten
was auf die Komplexität der BMP9-Signalisierung hinweist. Unsere Daten haben eine neuartige positive Rückkopplungsschleife zwischen der BMP10- und der GATA6-Achse offenbart. Wir berichten nun, dass BMP10 sowohl in humanen als auch Maus-PAECs die Expression von GATA6 induziert und dass ALK1, BMPR2 und Endoglin für diese Induktion notwendig sind. Darüber hinaus zeigen wir, dass GATA6 die Gene ALK1, BMPR2 und ActRII transkriptionell aktiviert und dass ein GATA6-Mangel zu verringerten mRNA- und Proteinspiegeln dieser BMP-Rezeptoren führt. Zusammengenommen deuten unsere Daten auf eine funktionelle Co-Abhängigkeit der GATA6- und BMP10-Wege bei der Vermittlung der PAEC- und PASMC-Homöostase in einem nicht erkrankten Zustand und auf einen Schutz vor Hyperproliferation und beeinträchtigter Apoptose bei PAH hin.Das Übersprechen zwischen Endothelzellen und glatten Muskelzellen in Lungengefäßen ist seit langem als kritisches Ereignis während der pathologischen Gefäßumgestaltung bei PAH anerkannt
67
. Obwohl Fortschritte bei der Identifizierung von Faktoren erzielt wurden, die von PAEC oder PASMC produziert wurden, und die Erleichterung einer solchen Kommunikation
68
,
69
,
70
,
71
, ist mehr Arbeit erforderlich, um diesen Prozess vollständig aufzuklären. In Übereinstimmung mit früheren Berichten, die auf die erhöhte Fähigkeit von PAH PAEC hinweisen, Mitogene für PASMC
70 zu sezernieren
, hier haben wir gezeigt, dass PAEC mit GATA6-Mangel nicht nur die Proliferation von PASMC erhöht, sondern auch andere pathologische Veränderungen induziert, einschließlich der Herunterregulierung von GATA6, SOD2 und BMPR2 in PASMC. Die GATA6-abhängigen sezernierten Faktoren müssen jedoch noch charakterisiert werden.Zusammengenommen hat unsere Arbeit weitreichende nachteilige Auswirkungen eines GATA6-Mangels auf die Funktion von sowohl PAEC als auch PASMC im Zusammenhang mit PAH gezeigt. Diese Wirkungen können spezifisch für das Lungengefäßsystem sein, da unterschiedliche Folgen der endothelialen GATA6-Deletion in Karotis-Ligations- oder Femoralarterien-Drahtverletzungsmodellen berichtet wurden
72
. In diesen Modellen löste das Knock-out von endothelialem Gata6 eine schützende Wirkung aus, indem die Bildung von Neointima in beiden experimentellen Modellen reduziert wurde. Die Autoren brachten reduzierte PDGF-B-Spiegel mit den antiproliferativen Wirkungen in Verbindung, die mit dem endothelialen Gata6-Verlust verbunden sind. In unserer Studie konnten wir diese Befunde bei GATA6-defizientem humanem PAEC nicht reproduzieren (Daten nicht gezeigt), im Gegenteil, wir beobachteten einen moderaten Anstieg von PDGF-BmRNA als Reaktion auf die reduzierten GATA6-Spiegel. Der Grund für diese Diskrepanz ist unklar; Es ist jedoch möglich, dass sich Endothelzellen aus verschiedenen Gefäßbetten in Bezug auf die Auswirkungen des GATA6-Verlusts unterscheiden.Unsere Studie hat jedoch Einschränkungen. Insbesondere SSc-PAH PAEC und PASMC waren nicht in den erforderlichen Mengen verfügbar, um alle Experimente durchzuführen. Die SSc-PAH ist eine Untergruppe der seltenen PAH, die bei Patienten mit SSc der seltenen Krankheit auftritt. Im Jahr 2013 betrug die Prävalenz von SSc in den Vereinigten Staaten ~ 240 Fälle pro Million; und die Prävalenz von PAH bei Patienten mit SSc beträgt 8–14 %
73
. Dies macht von Patienten stammende Proben sehr selten und schränkt unseren Zugang zu den von Patienten stammenden residenten PA-Zellen der frühen Passage ein, die für die Forschung verfügbar sind. Wir sind jedoch der festen Überzeugung, dass die Einbeziehung der uns zur Verfügung stehenden Zellen in ausgewählte Experimente zusammen mit Zellen von anderen PAH-Patienten unser Verständnis der Pathobiologie von SSc-PAH und der gesamten PAH verbessert.Veröffentlichte Studien und unsere neuen Daten deuten stark darauf hin, dass GATA6 als multizellulärer Signalweg fungiert, der die pulmonalvaskuläre Homöostase reguliert, und dass ein dualer PAEC-PASMC-GATA6-Mangel den pulmonalvaskulären Umbau und PH fördert, indem er das Gleichgewicht zwischen den wichtigsten Signalwegen stört, die die Zellproliferation und das Überleben regulieren . Daher kann die Bekämpfung des GATA6-Mangels einen großen therapeutischen Fortschritt für Patienten mit PAH darstellen. Hier berichten wir, dass die DMF-Behandlung bei der Umkehrung hämodynamischer Veränderungen, der Verringerung oxidativer Schäden und der Wiederherstellung der Expression der Bmp-Rezeptoren in Gata6-CKO-Mäusen sehr wirksam war. Diese Ergebnisse stimmen mit den zuvor gezeigten vorteilhaften therapeutischen Wirkungen von DMF in Hypoxie- und SU5416/Hypoxie-Mausmodellen von PH
49 überein
. Während die NRF2-induzierenden Eigenschaften von DMF oder CDDO-Me häufig betont werden, ist es wichtig zu erkennen, dass diese Verbindungen mehrere, noch nicht vollständig verstandene Wirkungsweisen haben, die für ihre vorteilhaften Wirkungen bei multifaktoriellen Erkrankungen wie PAH verantwortlich sein könnten. Angesichts der zytoprotektiven und immunmodulatorischen Wirkungen von DMF und seiner nachgewiesenen Sicherheitsbilanz bei anderen chronischen Erkrankungen
74
,
75
könnte DMF eine attraktive therapeutische Strategie für PAH sein.StudienzulassungDie Verwendung von nicht identifiziertem menschlichem Gewebe und Zellen in dieser Studie wird vom IRB als „keine Forschung am Menschen“ betrachtet. Die institutionelle Genehmigung wurde durch das Protokoll Nr. 458 der University of Pittsburgh CORID erteilt. Alle tierexperimentellen Verfahren wurden gemäß Protokoll Nr. TR201900057 durchgeführt, das vom Boston University Institutional Animal Care and Use Committee überprüft und genehmigt wurde. Die Untersuchung stand im Einklang mit dem Guide for the Care and Use of Laboratory Animals, herausgegeben von den US National Institutes of Health (NIH).
EinführungDie pulmonale arterielle Hypertonie (PAH) ist eine lebensbedrohliche Erkrankung, die durch Vasokonstriktion und Umbau der präkapillären Lungenarteriolen gekennzeichnet ist, was zu einer Einschränkung des Blutflusses, einem Anstieg des pulmonalarteriellen Drucks und des pulmonalen Gefäßwiderstands und schließlich zu rechtsventrikulärem Versagen und Tod führt 1 . 2 . Unbehandelt beträgt die mediane Überlebenszeit 2,8 Jahre, und selbst mit den derzeitigen Behandlungsschemata bleibt die Prognose schlecht (Sterblichkeitsrate von 10–15 % jährlich) 3 , 4 , 5 . Die Krankheit ist nach wie vor schlecht behandelt, insbesondere bei Patienten mit schnellem Fortschreiten, und eine Lungentransplantation ist die einzige Option für Patienten im Endstadium.Der pulmonale Gefäßumbau ist ein komplexer Prozess mit multizellulärer Beteiligung. Bei etablierter PAH tragen das gesteigerte Wachstum und Überleben von glatten PAH-Muskelzellen (PASMC) und die Hyperproliferation von Endothelzellen (PAEC) signifikant zur Obliteration des Lumens kleiner PAs, zum Umbau der Lungengefäße und zur gesamten PAH bei 6 , 7 , 8 .GATA6 ist einer von sechs hochkonservierten Transkriptions-GATA-Faktoren mit zwei Zinkfingern in Tandemanordnung, die mit anderen Transkriptionsregulatoren interagieren und das kanonische DNA-Motiv (G/A)GATA(A/T) 9 binden . Menschliches GATA6 wird in einer Vielzahl von Geweben exprimiert und behält die differenzierten Zellphänotypen bei 10 , 11 . Im Gefäßsystem wurde GATA6 hauptsächlich bei systemischen VSMC untersucht. Es wird in ruhenden VSMC stark exprimiert und in verletzten Gefäßen schnell herunterreguliert 12 . Die Rettung von Gata6-Spiegeln in ballongeschädigten Halsschlagadern führte zu einer VSMC-Differenzierung und einer reduzierten neointimalen Bildung bei Ratten 12 . Eine globale Transkriptomanalyse identifizierte GATA6 als einen entscheidenden Regulator des VSMC-Schicksals im arteriellen Baum 13 , was seine Bedeutung bei der systemischen vaskulären Homöostase weiter unterstützt.Unser Wissen über die Rolle von GATA6 im pulmonalen Gefäßsystem ist jedoch begrenzt durch die Veröffentlichung, die den Gata6-Verlust in PAs von Ratten mit Pneumonektomie und Monocrotalin (MCT)-induziertem PH 14 beschreibt, und einen neueren Bericht unserer Gruppe, der sich auf den endothelialen GATA6-Verlust in konzentriert PH-Entwicklung 15 . Unsere Studien zeigten, dass GATA6 sowohl im Endothel als auch im VSMC bei IPAH und SSc-PAH 15 defizient ist . Bemerkenswerterweise entwickeln Mäuse mit bedingter Deletion von Gata6 in Endothelzellen ( Gata6 -CKO) spontan PH, was darauf hindeutet, dass die Herunterregulierung von GATA6 ein frühes und entscheidendes Ereignis ist, das zu einer endothelialen Dysfunktion und der Entwicklung von PH 15 führt . Die Mechanismen, durch die der GATA6-Verlust eine Endothelschädigung und die nachfolgende Entwicklung von PH induziert, wurden jedoch nicht aufgeklärt.Diese Studie wurde durchgeführt, um die Rolle und funktionelle Bedeutung des GATA6-Mangels im Lungengefäßsystem zu klären und das Potenzial der GATA6-Achse als therapeutisches Ziel bei PAH zu bewerten. Hier berichten wir über neue Funktionen von GATA6 als Regulator von oxidativem Stress und BMP10-Signalisierung. Wir zeigen auch, dass Dimethylfumarat (DMF) sehr wirksam bei der Linderung der durch Gata6-Verlust in vivo verursachten pathologischen Veränderungen ist.
...
...
DiskussionHier berichten wir über neuartige Mechanismen der GATA6-Regulierung und -Funktion im Lungengefäßsystem und liefern Beweise, die die Attraktivität der GATA6-Achse als molekularer Zielweg für therapeutische Interventionen bei PAH belegen. Zu unseren neuen Erkenntnissen gehören: (i) GATA6 wirkt als Transkriptionsfaktor und direkter positiver Regulator antioxidativer Enzyme, und sein Mangel an PAH/PH-Lungengefäßzellen induziert oxidativen Stress und mitochondriale Dysfunktion; (ii) GATA6 bildet ein bidirektionales Übersprechen mit der BMP10/BMP-Rezeptorachse, und sein Verlust in PAH/PH-Lungengefäßzellen unterstützt einen BMPR-Mangel; (iii) GATA6 spielt eine wichtige Rolle bei der Kommunikation der pulmonalen Gefäßzellen, und ein endothelialer GATA6-Mangel führt zu einem GATA6-Verlust bei PASMC; 8 ).Abbildung 8

OMNIA TEMPUS HABENT
Diagnose IPAH im Februar 2013, in Behandlung bei OA Dr. Ulrich Krüger, jetzt Dr. Fischer Herzzentrum Duisburg, Medikamente: Sildenafil, Bosentan jetzt Macitentan, Subkutane Treprostinilpumpe, seit Januar 2024 getunnelter ZVK mit externer Pumpe (Groshongkatheter), 24/7 Sauerstoff, Marcumar, Diuretika
Bitte Anmelden oder Registrieren um der Konversation beizutreten.
