- Beiträge: 1748
Sidebar
Wirkungen von Treprostinil (Z.B. Remodulin)
22 Sep 2022 13:19 #1611
von danny
OMNIA TEMPUS HABENT
Diagnose IPAH im Februar 2013, in Behandlung bei OA Dr. Ulrich Krüger, jetzt Dr. Fischer Herzzentrum Duisburg, Medikamente: Sildenafil, Bosentan jetzt Macitentan, Subkutane Treprostinilpumpe, seit Januar 2024 getunnelter ZVK mit externer Pumpe (Groshongkatheter), 24/7 Sauerstoff, Marcumar, Diuretika
Wirkungen von Treprostinil (Z.B. Remodulin) wurde erstellt von danny
www.frontiersin.org/articles/10.3389/fphar.2021.705421/fullDas Prostacyclin-Analogon Treprostinil, das zur Behandlung von pulmonaler arterieller Hypertonie verwendet wird, ist ein starker Antagonist der TREK-1- und TREK-2-Kaliumkanäle
[list=none]
[*]1 Medway School of Pharmacy, University of Kent und University of Greenwich, Chatham Maritime, Vereinigtes Königreich
[*]2 Wolfson Center for Age-Related Diseases, King's College London, London, Vereinigtes Königreich
[*]3 Institute of Cardiovascular Science, University College London, London, Vereinigtes Königreich
[*]4 School of Engineering, Arts, Science and Technology, University of Suffolk, Ipswich, Vereinigtes Königreich
[/list]
Die pulmonale arterielle Hypertonie (PAH) ist eine aggressive Erkrankung des Gefäßumbaus, die eine hohe Morbiditäts- und Mortalitätsrate mit sich bringt. Treprostinil (Remodulin) ist ein stabiles Prostacyclin-Analogon mit starker gefäßerweiternder und antiproliferativer Aktivität, das von der FDA und der WHO zur Behandlung von PAH zugelassen wurde. Eine Einschränkung dieser Therapie sind die starken Schmerzen an der subkutanen Stelle und andere Schmerzformen, die bei einigen Patienten auftreten, was zu einer erheblichen Nichteinhaltung der Therapie führen kann. TWIK-bezogene Kaliumkanäle (TREK-1 und TREK-2) werden in sensorischen Neuronen stark exprimiert, wo sie eine Rolle bei der Regulierung der Erregbarkeit sensorischer Neuronen spielen. Die Herunterregulierung, Hemmung oder Mutation dieser Kanäle führt zu einer erhöhten Schmerzempfindlichkeit. Anhand elektrophysiologischer Patch-Clamp-Aufnahmen von ganzen Zellen zeigen wir erstmals, dass Treprostinil ein potenter Antagonist der humanen TREK-1- und TREK-2-Kanäle, aber nicht der TASK-1-Kanäle ist. Bei längerer Inkubation wurde ein Anstieg des TASK-1-Kanalstroms beobachtet, was mit seiner therapeutischen Rolle bei PAH übereinstimmt. Um die durch Treprostinil induzierte Hemmung von TREK zu untersuchen, wurde eine ortsgerichtete Mutagenese einer Reihe von Aminosäuren durchgeführt, die als wichtig für die Wirkung anderer regulatorischer Verbindungen identifiziert wurden. Wir fanden heraus, dass eine Gain-of-Function-Mutation von TREK-1 (Y284A) die Treprostinil-Hemmung abschwächte, während ein selektiver Aktivator von TREK-Kanälen, BL-1249, die hemmende Wirkung von Treprostinil überwand. EinführungDie pulmonale arterielle Hypertonie (PAH) ist eine fortschreitende Erkrankung des Gefäßumbaus, die schließlich zu rechtsventrikulärer Herzinsuffizienz und vorzeitigem Tod führt ( Simonneau et al., 2019 ). Es handelt sich um eine seltene Krankheit mit einer geschätzten Inzidenz von 5,8 pro Million bei Erwachsenen, wobei eine höhere Inzidenz bei Frauen und einem Durchschnittsalter der Patienten zwischen 50 und 65 Jahren festgestellt wird ( Galie et al., 2015 ; Leber et al., 2021 ). Es gab eine Reihe von Fortschritten bei der Behandlung, die die Lebensqualität der Patienten verbessert und die Sterblichkeit verringert haben. Trotz dieser Fortschritte bleibt die Prognose für Betroffene mit einer 5-Jahres-Überlebensrate von 61–65 % jedoch weiterhin schlecht ( Farber et al., 2015 ). Es wird allgemein vermutet, dass die PAH nach Schädigung des Endothels ( Clapp und Gurung, 2015 ; Madonna et al., 2015 ). Eine endotheliale Dysfunktion führt zu einer Abnahme der Produktion der Vasodilatatoren Prostacyclin (Prostaglandin I 2 ; PGI 2 ) und Stickoxid (NO) und einer Zunahme der potenten Vasokonstriktoren Endothelin (ET-1) und Thromboxan, die zusammen den Gefäßtonus erhöhen , Zellproliferation und Thrombozytenaggregation in Lungenarterien, um die Verengung von Blutgefäßen voranzutreiben ( Morrell et al., 2009 ; Hemnes und Humbert, 2017 ). Da PGI 2 ein wichtiger vasoaktiver Regulator ist, der von Endothelzellen in den Lungenarterien freigesetzt wird, umfasste die anfängliche therapeutische Behandlung von PAH die Gabe von Epoprostenol (synthetisches PGI 2), führte aber aufgrund seiner kurzen chemischen und biologischen Halbwertszeit zur Entwicklung stabiler PGI 2 -Analoga, Iloprost, Beraprost und Treprostinil oder in jüngerer Zeit des nicht-prostanoiden PGI 2 -Rezeptoragonisten Selexipag. Diese Therapien verbessern die körperliche Leistungsfähigkeit, Atmung, den hämodynamischen Kreislauf und das Überleben der Patienten in verschiedenen Studien ( Gomberg-Maitland und Olschewski, 2008 ; Sitbon und Vonk Noordegraaf, 2017 ).Treprostinil ist ein trizyklisches Benzinden-Analogon von PGI 2 , das oral, subkutan (SC), intravenös oder inhaliert verabreicht werden kann ( Lindegaard Pederson et al., 2020 ), wobei die SC-Verabreichung (Remodulin) von der US Food and Drug Administration und der Welt zugelassen ist Gesundheitsorganisation. In einer Reihe von Studien hat SC-Treprostinil im Vergleich zu anderen Verabreichungsmechanismen und anderen synthetischen PGI- 2 - Analoga eine signifikante Verbesserung der PAH-Symptome und eine Verringerung der Nebenwirkungen gezeigt ( Picken et al., 2019 ). Als potenter Vasodilatator treten seine therapeutischen Wirkungen über die Aktivierung spezifischer Prostanoidrezeptoren auf ( Clapp und Gurung, 2015 ; Corboz et al., 2021). ). Eine wesentliche Einschränkung der subkutanen Behandlung mit Treprostinil besteht darin, dass starke Schmerzen an der Stelle das wichtigste unerwünschte Ereignis sind, das Patienten erfahren ( Picken et al., 2019 ). Der Ursprung dieser Schmerzen an der Stelle ist unbekannt, beinhaltet aber wahrscheinlich die Regulierung der Ionenkanalaktivität in nozizeptiven sensorischen Neuronen.Die TWIK-verwandten (TREK-1 und TREK-2) Kaliumkanäle sind Mitglieder der Familie der Ionenkanäle mit zwei Porendomänen (K 2P ). Es wurde gezeigt, dass TREK-1 und TREK-2 in sensorischen Neuronen stark exprimiert werden, hauptsächlich in kleinen Nozizeptoren im Spinalganglion (DRG), wobei die TREK-2-Expression in IB4-bindenden C-Faser-Nozizeptoren und die TREK-1-Expression in Astrozyten identifiziert wurde und Neuronen des Rückenmarks, wo gezeigt wurde, dass sie spontane Schmerzen, neuropathische Schmerzen und Hyperalgesie regulieren ( Alloui et al., 2006 ; Kang und Kim, 2006 ; Acosta et al., 2014 ; Pereira et al., 2014 ; Viatchenko -Karpinski et al., 2018 ). Darüber hinaus zeigen TREK-1- und TREK-2-Knockout (KO)-Mäuse eine erhöhte Empfindlichkeit gegenüber einer Reihe von schädlichen Reizen, einschließlich Hitze, mechanischen und entzündlichen Mitteln ( Alloui et al., 2006 ; Noel et al., 2009 ; Pereira et al. , 2014 ). Umgekehrt wurde festgestellt, dass die TREK-Kanalaktivierung durch Riluzol, BL-1249, GI-530159, RNE28 bzw. C3001a Oxaliplatin-induzierte Schmerzen beseitigt ( Poupon et al., 2018 ), taktile Allodynie bei neuropathischen Ratten verringert ( Garcia et al. , 2020 ), reduzieren die Erregbarkeit kleiner DRG-Neuronen ( Lucif et al., 2018 ), erhöhen die antinozizeptive Aktivität in Schmerzmodellen der Maus ( Busserolles et al., 2020 ) und stimuliinduzierte Hyperalgesie, Allodynie und Entzündung bei Mäusen lindern ( Qiu et al., 2020 ).Das Ziel dieser Studie war es, festzustellen, ob Treprostinil eine direkte hemmende Wirkung auf humane geklonte TREK-1- und TREK-2-Kanäle hat, und somit eine plausible Erklärung für die starken Schmerzen an der Stelle zu liefern, die bei mit diesem Medikament behandelten PAH-Patienten auftreten. Wir untersuchten die Wirkung von Treprostinil auf eine Reihe von TREK-Kanälen mit Punktmutationen von Aminosäuren, die für die modulierende Wirkung einer Reihe anderer bekannter TREK-Kanal-Inhibitoren und -Aktivatoren erforderlich sind. Schließlich untersuchten wir unter Verwendung eines selektiven Aktivators von TREK-Kanälen, ob wir die hemmende Wirkung von Treprostinil auf diese Kanäle überwinden könnten. Eine vorläufige Darstellung einiger dieser Daten wurde bereits veröffentlicht ( Cunningham et al., 2018 ).
[*]1 Medway School of Pharmacy, University of Kent und University of Greenwich, Chatham Maritime, Vereinigtes Königreich
[*]2 Wolfson Center for Age-Related Diseases, King's College London, London, Vereinigtes Königreich
[*]3 Institute of Cardiovascular Science, University College London, London, Vereinigtes Königreich
[*]4 School of Engineering, Arts, Science and Technology, University of Suffolk, Ipswich, Vereinigtes Königreich
[/list]
Die pulmonale arterielle Hypertonie (PAH) ist eine aggressive Erkrankung des Gefäßumbaus, die eine hohe Morbiditäts- und Mortalitätsrate mit sich bringt. Treprostinil (Remodulin) ist ein stabiles Prostacyclin-Analogon mit starker gefäßerweiternder und antiproliferativer Aktivität, das von der FDA und der WHO zur Behandlung von PAH zugelassen wurde. Eine Einschränkung dieser Therapie sind die starken Schmerzen an der subkutanen Stelle und andere Schmerzformen, die bei einigen Patienten auftreten, was zu einer erheblichen Nichteinhaltung der Therapie führen kann. TWIK-bezogene Kaliumkanäle (TREK-1 und TREK-2) werden in sensorischen Neuronen stark exprimiert, wo sie eine Rolle bei der Regulierung der Erregbarkeit sensorischer Neuronen spielen. Die Herunterregulierung, Hemmung oder Mutation dieser Kanäle führt zu einer erhöhten Schmerzempfindlichkeit. Anhand elektrophysiologischer Patch-Clamp-Aufnahmen von ganzen Zellen zeigen wir erstmals, dass Treprostinil ein potenter Antagonist der humanen TREK-1- und TREK-2-Kanäle, aber nicht der TASK-1-Kanäle ist. Bei längerer Inkubation wurde ein Anstieg des TASK-1-Kanalstroms beobachtet, was mit seiner therapeutischen Rolle bei PAH übereinstimmt. Um die durch Treprostinil induzierte Hemmung von TREK zu untersuchen, wurde eine ortsgerichtete Mutagenese einer Reihe von Aminosäuren durchgeführt, die als wichtig für die Wirkung anderer regulatorischer Verbindungen identifiziert wurden. Wir fanden heraus, dass eine Gain-of-Function-Mutation von TREK-1 (Y284A) die Treprostinil-Hemmung abschwächte, während ein selektiver Aktivator von TREK-Kanälen, BL-1249, die hemmende Wirkung von Treprostinil überwand. EinführungDie pulmonale arterielle Hypertonie (PAH) ist eine fortschreitende Erkrankung des Gefäßumbaus, die schließlich zu rechtsventrikulärer Herzinsuffizienz und vorzeitigem Tod führt ( Simonneau et al., 2019 ). Es handelt sich um eine seltene Krankheit mit einer geschätzten Inzidenz von 5,8 pro Million bei Erwachsenen, wobei eine höhere Inzidenz bei Frauen und einem Durchschnittsalter der Patienten zwischen 50 und 65 Jahren festgestellt wird ( Galie et al., 2015 ; Leber et al., 2021 ). Es gab eine Reihe von Fortschritten bei der Behandlung, die die Lebensqualität der Patienten verbessert und die Sterblichkeit verringert haben. Trotz dieser Fortschritte bleibt die Prognose für Betroffene mit einer 5-Jahres-Überlebensrate von 61–65 % jedoch weiterhin schlecht ( Farber et al., 2015 ). Es wird allgemein vermutet, dass die PAH nach Schädigung des Endothels ( Clapp und Gurung, 2015 ; Madonna et al., 2015 ). Eine endotheliale Dysfunktion führt zu einer Abnahme der Produktion der Vasodilatatoren Prostacyclin (Prostaglandin I 2 ; PGI 2 ) und Stickoxid (NO) und einer Zunahme der potenten Vasokonstriktoren Endothelin (ET-1) und Thromboxan, die zusammen den Gefäßtonus erhöhen , Zellproliferation und Thrombozytenaggregation in Lungenarterien, um die Verengung von Blutgefäßen voranzutreiben ( Morrell et al., 2009 ; Hemnes und Humbert, 2017 ). Da PGI 2 ein wichtiger vasoaktiver Regulator ist, der von Endothelzellen in den Lungenarterien freigesetzt wird, umfasste die anfängliche therapeutische Behandlung von PAH die Gabe von Epoprostenol (synthetisches PGI 2), führte aber aufgrund seiner kurzen chemischen und biologischen Halbwertszeit zur Entwicklung stabiler PGI 2 -Analoga, Iloprost, Beraprost und Treprostinil oder in jüngerer Zeit des nicht-prostanoiden PGI 2 -Rezeptoragonisten Selexipag. Diese Therapien verbessern die körperliche Leistungsfähigkeit, Atmung, den hämodynamischen Kreislauf und das Überleben der Patienten in verschiedenen Studien ( Gomberg-Maitland und Olschewski, 2008 ; Sitbon und Vonk Noordegraaf, 2017 ).Treprostinil ist ein trizyklisches Benzinden-Analogon von PGI 2 , das oral, subkutan (SC), intravenös oder inhaliert verabreicht werden kann ( Lindegaard Pederson et al., 2020 ), wobei die SC-Verabreichung (Remodulin) von der US Food and Drug Administration und der Welt zugelassen ist Gesundheitsorganisation. In einer Reihe von Studien hat SC-Treprostinil im Vergleich zu anderen Verabreichungsmechanismen und anderen synthetischen PGI- 2 - Analoga eine signifikante Verbesserung der PAH-Symptome und eine Verringerung der Nebenwirkungen gezeigt ( Picken et al., 2019 ). Als potenter Vasodilatator treten seine therapeutischen Wirkungen über die Aktivierung spezifischer Prostanoidrezeptoren auf ( Clapp und Gurung, 2015 ; Corboz et al., 2021). ). Eine wesentliche Einschränkung der subkutanen Behandlung mit Treprostinil besteht darin, dass starke Schmerzen an der Stelle das wichtigste unerwünschte Ereignis sind, das Patienten erfahren ( Picken et al., 2019 ). Der Ursprung dieser Schmerzen an der Stelle ist unbekannt, beinhaltet aber wahrscheinlich die Regulierung der Ionenkanalaktivität in nozizeptiven sensorischen Neuronen.Die TWIK-verwandten (TREK-1 und TREK-2) Kaliumkanäle sind Mitglieder der Familie der Ionenkanäle mit zwei Porendomänen (K 2P ). Es wurde gezeigt, dass TREK-1 und TREK-2 in sensorischen Neuronen stark exprimiert werden, hauptsächlich in kleinen Nozizeptoren im Spinalganglion (DRG), wobei die TREK-2-Expression in IB4-bindenden C-Faser-Nozizeptoren und die TREK-1-Expression in Astrozyten identifiziert wurde und Neuronen des Rückenmarks, wo gezeigt wurde, dass sie spontane Schmerzen, neuropathische Schmerzen und Hyperalgesie regulieren ( Alloui et al., 2006 ; Kang und Kim, 2006 ; Acosta et al., 2014 ; Pereira et al., 2014 ; Viatchenko -Karpinski et al., 2018 ). Darüber hinaus zeigen TREK-1- und TREK-2-Knockout (KO)-Mäuse eine erhöhte Empfindlichkeit gegenüber einer Reihe von schädlichen Reizen, einschließlich Hitze, mechanischen und entzündlichen Mitteln ( Alloui et al., 2006 ; Noel et al., 2009 ; Pereira et al. , 2014 ). Umgekehrt wurde festgestellt, dass die TREK-Kanalaktivierung durch Riluzol, BL-1249, GI-530159, RNE28 bzw. C3001a Oxaliplatin-induzierte Schmerzen beseitigt ( Poupon et al., 2018 ), taktile Allodynie bei neuropathischen Ratten verringert ( Garcia et al. , 2020 ), reduzieren die Erregbarkeit kleiner DRG-Neuronen ( Lucif et al., 2018 ), erhöhen die antinozizeptive Aktivität in Schmerzmodellen der Maus ( Busserolles et al., 2020 ) und stimuliinduzierte Hyperalgesie, Allodynie und Entzündung bei Mäusen lindern ( Qiu et al., 2020 ).Das Ziel dieser Studie war es, festzustellen, ob Treprostinil eine direkte hemmende Wirkung auf humane geklonte TREK-1- und TREK-2-Kanäle hat, und somit eine plausible Erklärung für die starken Schmerzen an der Stelle zu liefern, die bei mit diesem Medikament behandelten PAH-Patienten auftreten. Wir untersuchten die Wirkung von Treprostinil auf eine Reihe von TREK-Kanälen mit Punktmutationen von Aminosäuren, die für die modulierende Wirkung einer Reihe anderer bekannter TREK-Kanal-Inhibitoren und -Aktivatoren erforderlich sind. Schließlich untersuchten wir unter Verwendung eines selektiven Aktivators von TREK-Kanälen, ob wir die hemmende Wirkung von Treprostinil auf diese Kanäle überwinden könnten. Eine vorläufige Darstellung einiger dieser Daten wurde bereits veröffentlicht ( Cunningham et al., 2018 ).
OMNIA TEMPUS HABENT
Diagnose IPAH im Februar 2013, in Behandlung bei OA Dr. Ulrich Krüger, jetzt Dr. Fischer Herzzentrum Duisburg, Medikamente: Sildenafil, Bosentan jetzt Macitentan, Subkutane Treprostinilpumpe, seit Januar 2024 getunnelter ZVK mit externer Pumpe (Groshongkatheter), 24/7 Sauerstoff, Marcumar, Diuretika
Bitte Anmelden oder Registrieren um der Konversation beizutreten.
22 Sep 2022 13:20 #1612
von danny
OMNIA TEMPUS HABENT
Diagnose IPAH im Februar 2013, in Behandlung bei OA Dr. Ulrich Krüger, jetzt Dr. Fischer Herzzentrum Duisburg, Medikamente: Sildenafil, Bosentan jetzt Macitentan, Subkutane Treprostinilpumpe, seit Januar 2024 getunnelter ZVK mit externer Pumpe (Groshongkatheter), 24/7 Sauerstoff, Marcumar, Diuretika
danny antwortete auf Wirkungen von Treprostinil (Z.B. Remodulin)
Materialen und MethodenDie meisten der hier verwendeten Methoden wurden bereits beschrieben (
Veale et al., 2014
;
Cunningham et al., 2019
;
Mathie et al., 2021a
) und werden im Folgenden nur kurz erwähnt.Säugetier-ExpressionsplasmideTREK-1 (KCNK2, Genbank™ NP_055032.1) und TASK-1 (KCNK3, NP_002237) cDNA wurden in den pcDNA3.1 + -Vektor (Invitrogen, Carlsbad, CA, Vereinigte Staaten) und TREK-2 (KCNK10, NP_612190) kloniert. 1) in PCMV6-XL-4 (OriGene Technologies, Inc. Vereinigte Staaten).MutageneseLigandenbindungsstelle und Gating-Mutationen wurden durch ortsgerichtete Mutagenese in humane TREK-1 (Q76A, I80A, L102A, Y270A, Y284A, L289A) und TREK-2 (L320A, K302Q) cDNA unter Verwendung des QuikChange-Kits (Agilent, CA, USA) wie zuvor beschrieben (
Veale et al., 2014
). Die DNA-Sequenzierung wurde von DNA Sequencing and Services (MRC/PPU, School of Life Sciences, University of Dundee, Schottland) durchgeführt.ZellkulturAlle Experimente wurden unter Verwendung einer modifizierten humanen embryonalen Nieren-293-Zelllinie, tsA201 (Europäische Sammlung authentifizierter Zellkulturen; Sigma-Aldrich, Vereinigtes Königreich), die wie zuvor beschrieben (
Veale et al., 2014
) hergestellt und gepflegt wurde, durchgeführt. Die Zellen wurden bei einer Konfluenz von 80 % geteilt, in Medium auf eine Konzentration von 7 × 10 4 resuspendiert und dann 0,5 ml in eine Platte mit vier Vertiefungen ausplattiert, die 13 mm Poly- d - Lysin-beschichtetes (1 mg ml –1 ) Glas enthielt Deckgläser, bereit für die Transfektion am nächsten Tag.TransfektionPlasmide, die cDNA entweder für Wildtyp (WT) oder mutierte TREK-cDNA und ein ähnliches Plasmid, das die cDNA für grün fluoreszierendes Protein (GFP) codiert, enthielten, wurden bei einer Konzentration von 0,5 &mgr;g unter Verwendung eines modifizierten Calciumphosphat-Protokolls, wie zuvor beschrieben, co-transfiziert (
Cunningham et al., 2019
). Alle mutierten Kanäle wurden als homodimere Kanäle exprimiert, wobei jede α-Untereinheit die eingebaute Mutation exprimierte.Ganzzell-Patch-Clamp-ElektrophysiologieStröme wurden von GFP-fluoreszierenden tsA201-Zellen, die die interessierende cDNA exprimierten, unter Verwendung einer Whole-Cell-Patch-Clamp-Konfiguration in einer Voltage-Clamp-Konfiguration und eines Step-Ramp-Spannungsprotokolls unter Verwendung einer extrazellulären Lösung aus 145 mM NaCl, 2,5 mM KCl, 3 mM MgCl aufgezeichnet 2 , 1 mM CaCl 2 und 10 mM HEPES (pH eingestellt auf 7,4 mit NaOH) und eine intrazelluläre Pipettenlösung aus 150 mM KCl, 3 mM MgCl 2 , 5 mM EGTA und 10 mM HEPES (pH eingestellt auf 7,4 mit KOH). Alle Experimente wurden bei Raumtemperatur (20–25 °C) durchgeführt und Ströme wurden unter Verwendung eines Axopatch 1D-Patch-Clamp-Verstärkers (Molecular Devices, Sunnyvale, CA) aufgezeichnet, bei 2 kHz gefiltert und bei 5 kHz digitalisiert. Kontrolllösung und modulatorische Verbindungen wurden mit einer Rate von 4–5 ml min –1 perfundiertfür ∼3–6 min pro Experiment. Für Inkubationsstudien wurden die Zellen vor Beginn der elektrophysiologischen Aufzeichnung und für die Dauer des Experiments entweder in extrazellulärer Lösung oder extrazellulärer Lösung, die die gewünschte Treprostinil-Konzentration enthielt, für 20 Minuten inkubiert.Datenanalyse und StatistikDie Datenanalyse des Ganzzellen-Auswärtsstroms und der Analysesoftware war wie zuvor in
Cunningham et al. (2019)
. Ganzzellige Auswärtsströme wurden in Picoampere (pA) gemessen und als Differenzstrom zwischen dem gemessenen bei –40 und –80 mV aufgezeichnet, normalisiert gegen die Zellkapazität (pF). Strom-Spannungs-Diagramme wurden aus der Spannungsrampe (–120 mV bis +20 mV) erhalten. Alle Rohdatenspuren waren Mittelwerte aller Zellen, die in jedem Zustand aufgezeichnet wurden. Die Daten wurden als mittlere ±95 % Konfidenzintervalle (KI) ausgedrückt, und n stellt die Anzahl der einzelnen Zellen dar, die als Symbole in den Diagrammen angezeigt werden. Die verwendete statistische Analyse war entweder eine einfache ANOVA mit einem Post-hoc-Dunnett-Mehrfachvergleichstest oder ein gepaartes Student's t-Prüfung. Die Daten wurden als statistisch unterschiedlich betrachtet, wenn p < 0,05 (*), p < 0,01 (**), p < 0,001 (***). Daten von Zellen, die mutierte Kanäle exprimieren, wurden mit übereinstimmenden Kontrolldaten von entweder WT TREK-1 oder WT TREK-2 verglichen, die entweder gleichzeitig oder etwa zur gleichen Kalenderperiode und Zellchargennummer aufgezeichnet wurden.ChemikalienBL-1249 wurde von Sigma-Aldrich, Vereinigtes Königreich, bezogen und in Dimethylsulfoxid (DMSO) gelöst, um eine 10 mM Stammlösung zu erzeugen. Treprostinil (CAY10162) wurde von Cambridge Bioscience, Vereinigtes Königreich (Vertreiber für Cayman Chemical Co.) bezogen und in DMSO auf eine Konzentration von 10 mM gelöst. Verdünnungen der Stammlösungen wurden direkt in der extrazellulären Lösung zur Verwendung am selben Tag hergestellt.ErgebnisseTREK-1- und TREK-2-Kanäle werden durch Treprostinil stark gehemmtWir untersuchten zunächst, ob der TREK-1- und TREK-2-Kanalstrom direkt durch das stabile PGI- 2 - Analogon Treprostinil beeinflusst wurde. Die Anwendung von Treprostinil über einen Konzentrationsbereich von 0,01–1 µM auf Zellen, die WT-Human-TREK-1-Kanäle exprimieren, führte zu einer starken Hemmung des Ganzzell-Auswärtsstroms, der eine berechnete 50 %-Hemmkonzentration (IC 50 ) von 0,03 µM [95 %] ergab. Konfidenzintervalle (CI): 0,01 bis 0,06] geschätzt aus der Differenz zwischen Strom gemessen bei –40 mV und –80 mV (
Abbildung 1A
). Unter Verwendung einer maximalen Konzentration von Treprostinil (1 µM) beobachteten wir eine starke Hemmung des Ganzzell-Auswärtsstroms von 28,2 pA pF –1 [95 % CI: 18,8 bis 37,6, n = 8] in der Kontrolle auf 5,3 pA pF –1(95 % KI: 1,4 bis 9,2, n =  , wenn Treprostinil vorhanden war (
Abbildungen 1B, C
). In ähnlicher Weise führte die Anwendung von Treprostinil über einen Konzentrationsbereich von 0,01–1 µM auf Zellen, die WT TREK-2-Kanäle exprimierten, zu einem berechneten IC 50 von 0,04 µM (95 % KI: 0,004 bis 0,39) (
1D
). Wobei bei einer Konzentration von 1 μM der durchschnittliche TREK-2-Strom von 39,9 pA pF –1 (95 % CI: 24,6 bis 55,3, n = 7) in der Kontrolllösung auf 18,7 pA pF –1 (95 % CI: 7,3 ) reduziert wurde bis 24,0, n = 7) in Gegenwart von Treprostinil (
Abbildungen 1E, F
).Abbildung 1
, wenn Treprostinil vorhanden war (
Abbildungen 1B, C
). In ähnlicher Weise führte die Anwendung von Treprostinil über einen Konzentrationsbereich von 0,01–1 µM auf Zellen, die WT TREK-2-Kanäle exprimierten, zu einem berechneten IC 50 von 0,04 µM (95 % KI: 0,004 bis 0,39) (
1D
). Wobei bei einer Konzentration von 1 μM der durchschnittliche TREK-2-Strom von 39,9 pA pF –1 (95 % CI: 24,6 bis 55,3, n = 7) in der Kontrolllösung auf 18,7 pA pF –1 (95 % CI: 7,3 ) reduziert wurde bis 24,0, n = 7) in Gegenwart von Treprostinil (
Abbildungen 1E, F
).Abbildung 1
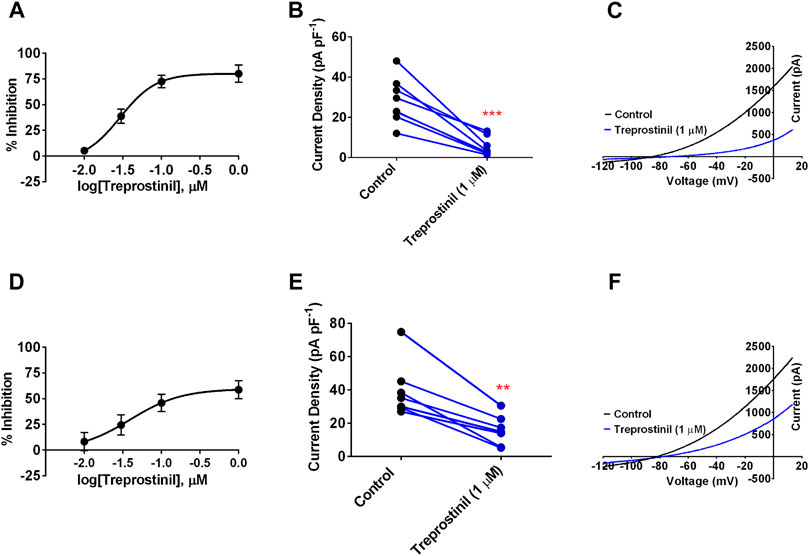 ABBILDUNG 1 . Wirkung von Treprostinil auf humane geklonte TREK-1- und TREK-2-Kanäle (A) Konzentrations-Antwort-Kurve für die Treprostinil-Hemmung des humanen TREK-1-Stroms. Fehlerbalken stellen den Standardfehler des Mittelwerts dar (SEM) (
ABBILDUNG 1 . Wirkung von Treprostinil auf humane geklonte TREK-1- und TREK-2-Kanäle (A) Konzentrations-Antwort-Kurve für die Treprostinil-Hemmung des humanen TREK-1-Stroms. Fehlerbalken stellen den Standardfehler des Mittelwerts dar (SEM) ( Messung des Ganzzellen-TREK-1-Stroms (pA), normalisiert gegen die Zellkapazität (pF) in 2,5 mM [K + ]-Kontrolllösung (schwarze Symbole) und nach akuter Anwendung von Treprostinil (1 μM, blaue Symbole, *** p < 0,0002 (95 % KI: –31,4 bis –14,5), gepaarter t - Test (C) Strom-Spannungs-Plot von TREK-1-Strömen (Durchschnitt von n = 8 Zellen ) unter Kontrollbedingungen (schwarze Linie) und in Anwesenheit von Treprostinil (1 μM, Durchschnitt vonn = 8 Zellen, blaue Linie) aufgezeichnet über eine Spannungsrampe (–120 mV bis +20 mV) (D) Konzentrations-Antwort-Kurve für die Treprostinil-Hemmung des humanen TREK-2-Stroms (E) Messung des Ganzzell-TREK-2-Stroms (pA pF –1 ) in der Kontrolle und nach akuter Anwendung von Treprostinil (1 μM, ** p < 0,001 [95 % KI: –34,43 bis –14,18]), gepaarter t -Test (F) Strom-Spannungs-Diagramm von TREK- 2 in der Kontrolle (schwarze Linie, n = 7) und in Gegenwart von Treprostinil (1 μM, n = 7, blaue Linie). Treprostinil reguliert die TASK-1-Kanäle nicht direktUm zu verstehen, ob diese inhibitorische Wirkung von Treprostinil auf die TREK-Kanäle für diesen Kanal-Subtyp selektiv war, testeten wir sie an einem anderen Mitglied der K 2P -Kanalfamilie , nämlich TASK-1, das weithin mit der PAH-Pathogenese in Verbindung gebracht wurde (
Ma et al., 2013
;
Boucherat et al., 2015
;
Antigny et al., 2016
;
Navas et al., 2017
;
Cunningham et al., 2019
). Anders als bei TREK-1 und TREK-2 hatte Treprostinil bei Verwendung des gleichen experimentellen Protokolls weder eine hemmende noch eine aktivierende Wirkung auf WT-humane TASK-1-Kanäle. Die durchschnittliche Stromdichte für TASK-1-Kanäle, gemessen in Kontrolllösung, betrug 7,2 pA pF –1 (95 % KI: 1,4 bis 13,0, n= 5) im Vergleich zu 6,5 pA pF –1 (95 % KI: 3,2 bis 9,8, n = 5) in Gegenwart von Treprostinil (1 μM; p > 0,05 (95 % KI: –3,4 bis 2,0), gepaarter t - Test ,
Abbildungen 2A,B
). Da Treprostinil den TASK-1-Kanal offenbar nicht direkt zu hemmen schien, wollten wir untersuchen, ob Treprostinil über die Aktivierung von Signalwegen wie dem von Proteinkinasen (PKA) abhängigen Weg eine Wirkung auf TASK-1 ausüben kann bereits vorgeschlagen (
Olschewski et al., 2006
;
Corboz et al., 2021).
). Dazu haben wir TASK-1-exprimierende tsA201-Zellen entweder in Kontrolllösung (unbehandelt) oder mit Zugabe von 1 µM Treprostinil (behandelt) für 20 min vorinkubiert und dann die Ströme in jedem Zustand gemessen. Ein Anstieg ( p < 0,05, ungepaarter t -Test) der Stromdichte wurde in Treprostinil-inkubierten Zellen (9,4 pA pF –1 [95 % KI: 7,7 bis 11,1, n = 15]) im Vergleich zu unbehandelten Kontroll-inkubierten Zellen beobachtet (6,0 pA pF –1 [95 % CI: 4,8 bis 7,2, n = 17],
Abbildungen 2C,D
), mit einem durchschnittlichen Stromanstieg von 36,2 %.Figur 2
Messung des Ganzzellen-TREK-1-Stroms (pA), normalisiert gegen die Zellkapazität (pF) in 2,5 mM [K + ]-Kontrolllösung (schwarze Symbole) und nach akuter Anwendung von Treprostinil (1 μM, blaue Symbole, *** p < 0,0002 (95 % KI: –31,4 bis –14,5), gepaarter t - Test (C) Strom-Spannungs-Plot von TREK-1-Strömen (Durchschnitt von n = 8 Zellen ) unter Kontrollbedingungen (schwarze Linie) und in Anwesenheit von Treprostinil (1 μM, Durchschnitt vonn = 8 Zellen, blaue Linie) aufgezeichnet über eine Spannungsrampe (–120 mV bis +20 mV) (D) Konzentrations-Antwort-Kurve für die Treprostinil-Hemmung des humanen TREK-2-Stroms (E) Messung des Ganzzell-TREK-2-Stroms (pA pF –1 ) in der Kontrolle und nach akuter Anwendung von Treprostinil (1 μM, ** p < 0,001 [95 % KI: –34,43 bis –14,18]), gepaarter t -Test (F) Strom-Spannungs-Diagramm von TREK- 2 in der Kontrolle (schwarze Linie, n = 7) und in Gegenwart von Treprostinil (1 μM, n = 7, blaue Linie). Treprostinil reguliert die TASK-1-Kanäle nicht direktUm zu verstehen, ob diese inhibitorische Wirkung von Treprostinil auf die TREK-Kanäle für diesen Kanal-Subtyp selektiv war, testeten wir sie an einem anderen Mitglied der K 2P -Kanalfamilie , nämlich TASK-1, das weithin mit der PAH-Pathogenese in Verbindung gebracht wurde (
Ma et al., 2013
;
Boucherat et al., 2015
;
Antigny et al., 2016
;
Navas et al., 2017
;
Cunningham et al., 2019
). Anders als bei TREK-1 und TREK-2 hatte Treprostinil bei Verwendung des gleichen experimentellen Protokolls weder eine hemmende noch eine aktivierende Wirkung auf WT-humane TASK-1-Kanäle. Die durchschnittliche Stromdichte für TASK-1-Kanäle, gemessen in Kontrolllösung, betrug 7,2 pA pF –1 (95 % KI: 1,4 bis 13,0, n= 5) im Vergleich zu 6,5 pA pF –1 (95 % KI: 3,2 bis 9,8, n = 5) in Gegenwart von Treprostinil (1 μM; p > 0,05 (95 % KI: –3,4 bis 2,0), gepaarter t - Test ,
Abbildungen 2A,B
). Da Treprostinil den TASK-1-Kanal offenbar nicht direkt zu hemmen schien, wollten wir untersuchen, ob Treprostinil über die Aktivierung von Signalwegen wie dem von Proteinkinasen (PKA) abhängigen Weg eine Wirkung auf TASK-1 ausüben kann bereits vorgeschlagen (
Olschewski et al., 2006
;
Corboz et al., 2021).
). Dazu haben wir TASK-1-exprimierende tsA201-Zellen entweder in Kontrolllösung (unbehandelt) oder mit Zugabe von 1 µM Treprostinil (behandelt) für 20 min vorinkubiert und dann die Ströme in jedem Zustand gemessen. Ein Anstieg ( p < 0,05, ungepaarter t -Test) der Stromdichte wurde in Treprostinil-inkubierten Zellen (9,4 pA pF –1 [95 % KI: 7,7 bis 11,1, n = 15]) im Vergleich zu unbehandelten Kontroll-inkubierten Zellen beobachtet (6,0 pA pF –1 [95 % CI: 4,8 bis 7,2, n = 17],
Abbildungen 2C,D
), mit einem durchschnittlichen Stromanstieg von 36,2 %.Figur 2
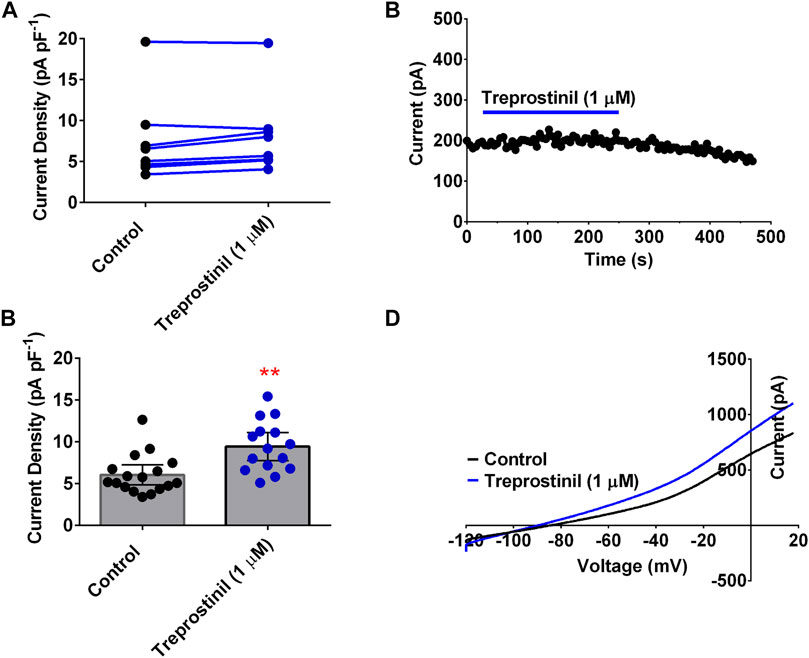 ABBILDUNG 2 . Wirkung von Treprostinil auf humanes TASK-1 (A) Messung des Ganzzell-TASK-1-Stroms (pA pF −1 ) in Kontrolllösung (schwarze Symbole) und nach Applikation von Treprostinil (1 μM, blaue Symbole, p = 0,506 [95 % KI: –53,06 bis 12,66]); gepaarter t - Test (
ABBILDUNG 2 . Wirkung von Treprostinil auf humanes TASK-1 (A) Messung des Ganzzell-TASK-1-Stroms (pA pF −1 ) in Kontrolllösung (schwarze Symbole) und nach Applikation von Treprostinil (1 μM, blaue Symbole, p = 0,506 [95 % KI: –53,06 bis 12,66]); gepaarter t - Test ( Exemplarischer Zeitverlauf, der die Wirkung von 1 µM Treprostinil (Arzneimittelapplikation wird durch die blaue Linie dargestellt) auf den Ganzzellen-TASK-1-Strom (pA) über die Zeit (s) demonstriert. Jeder Punkt ist ein 50-s-Mittelwert des Differenzstroms (C) Balkendiagramme der Stromdichten (pA pF −1) von Zellen, die WT TASK-1 transient exprimieren, gemessen in extrazellulärer Kontrolllösung und wenn die Zellen in 1 µM Treprostinil (> 20 min) inkubiert wurden, ** p = 0,0013 [95 % KI: 1,4 bis 5,3]), ungepaarter t - Test . Fehlerbalken stellen das 95 % CI (D) Strom-Spannungs-Diagramm von TASK-1 unter Kontrollbedingungen (schwarze Linie) und Treprostinil (1 μM, blaue Linie) dar, aufgezeichnet über eine Spannungsrampe (–120 mV bis +20 mV). Die Treprostinil-Hemmung von TREK-1 wird nicht durch bekannte Mutationen der allosterischen Ligandenbindungsstelle in der extrazellulären Kappe beeinflusstAls nächstes versuchten wir, die molekulare Wirkungsweise von Treprostinil auf den TREK-Kanal aufzuklären. Es wurde zuvor gezeigt, dass einige Inhibitoren von TREK-Kanälen wirken, indem sie an Stellen in der extrazellulären Kappe dieser Kanäle binden, was zu einer Blockierung des Ionenleitungswegs führt (
Luo et al., 2017
). Wir mutierten drei Reste, Glutamin (Q) 76, Isoleucin (I) 80 und Leucin (L) 102 zu Alanin (A) und verglichen die Treprostinil-induzierte Hemmung dieser mutierten Kanäle mit WT TREK-1, da Mutationen an diesen Stellen aufgetreten sind Es wurde gezeigt, dass es die Wirksamkeit von N-(4-Chlorphenyl)-N-(2-(3,4-dihydrosiochinolin-2(1H)-yl)-2-oxoethyl)methansulfonamid (TKDC)-induzierten allosterischen Konformationsübergängen des Extrazellulären reduziert Kappe (
Luo et al., 2017
). Die Alanin-Substitution dieser Aminosäuren (Q76A, I80A und L102A) in TREK-1 führte zu funktionellen homodimeren Kanälen, in denen die Mutation auf beiden α-Untereinheiten exprimiert wird, mit Ganzzell-Stromdichten (pA pF –1 ) entweder ähnlich wie bei WT ( Q76A und L102A) oder leicht erhöht (I80A, p < 0,03, einfache ANOVA, gefolgt von Dunnetts multiplem Vergleichstest,
Abbildungen 3A, E, I
, M). Der durchschnittliche Ganzzellstrom betrug 28,3 pA pF –1 (95 % KI: 21,0 bis 35,7, n = 10) für WT; 35,6 pA pF –1 (95 % KI: 25,8 bis 45,4, n = 7) für Q76A; 50,4 pA pF –1 (95 % KI: 28,2 bis 72,6, n =
Exemplarischer Zeitverlauf, der die Wirkung von 1 µM Treprostinil (Arzneimittelapplikation wird durch die blaue Linie dargestellt) auf den Ganzzellen-TASK-1-Strom (pA) über die Zeit (s) demonstriert. Jeder Punkt ist ein 50-s-Mittelwert des Differenzstroms (C) Balkendiagramme der Stromdichten (pA pF −1) von Zellen, die WT TASK-1 transient exprimieren, gemessen in extrazellulärer Kontrolllösung und wenn die Zellen in 1 µM Treprostinil (> 20 min) inkubiert wurden, ** p = 0,0013 [95 % KI: 1,4 bis 5,3]), ungepaarter t - Test . Fehlerbalken stellen das 95 % CI (D) Strom-Spannungs-Diagramm von TASK-1 unter Kontrollbedingungen (schwarze Linie) und Treprostinil (1 μM, blaue Linie) dar, aufgezeichnet über eine Spannungsrampe (–120 mV bis +20 mV). Die Treprostinil-Hemmung von TREK-1 wird nicht durch bekannte Mutationen der allosterischen Ligandenbindungsstelle in der extrazellulären Kappe beeinflusstAls nächstes versuchten wir, die molekulare Wirkungsweise von Treprostinil auf den TREK-Kanal aufzuklären. Es wurde zuvor gezeigt, dass einige Inhibitoren von TREK-Kanälen wirken, indem sie an Stellen in der extrazellulären Kappe dieser Kanäle binden, was zu einer Blockierung des Ionenleitungswegs führt (
Luo et al., 2017
). Wir mutierten drei Reste, Glutamin (Q) 76, Isoleucin (I) 80 und Leucin (L) 102 zu Alanin (A) und verglichen die Treprostinil-induzierte Hemmung dieser mutierten Kanäle mit WT TREK-1, da Mutationen an diesen Stellen aufgetreten sind Es wurde gezeigt, dass es die Wirksamkeit von N-(4-Chlorphenyl)-N-(2-(3,4-dihydrosiochinolin-2(1H)-yl)-2-oxoethyl)methansulfonamid (TKDC)-induzierten allosterischen Konformationsübergängen des Extrazellulären reduziert Kappe (
Luo et al., 2017
). Die Alanin-Substitution dieser Aminosäuren (Q76A, I80A und L102A) in TREK-1 führte zu funktionellen homodimeren Kanälen, in denen die Mutation auf beiden α-Untereinheiten exprimiert wird, mit Ganzzell-Stromdichten (pA pF –1 ) entweder ähnlich wie bei WT ( Q76A und L102A) oder leicht erhöht (I80A, p < 0,03, einfache ANOVA, gefolgt von Dunnetts multiplem Vergleichstest,
Abbildungen 3A, E, I
, M). Der durchschnittliche Ganzzellstrom betrug 28,3 pA pF –1 (95 % KI: 21,0 bis 35,7, n = 10) für WT; 35,6 pA pF –1 (95 % KI: 25,8 bis 45,4, n = 7) für Q76A; 50,4 pA pF –1 (95 % KI: 28,2 bis 72,6, n =  für I80A; 31,1 pA pF −1(95 % KI: 23,7 bis 38,6, n = 11) für L102A. Rampenänderungen des Haltepotentials von –120 auf +20 mV zeigten, dass mutierte Kanäle nach außen gleichgerichtet waren mit mittleren Nullstrom-Umkehrpotentialen, die sich nicht signifikant von WT-Kanälen unterschieden ( p > 0,05, einfache ANOVA, gefolgt von einem Dunnett-Test mit mehreren Vergleichen). (–81,4 mV [95 % KI: = –87,3 bis –75,6, n = 7] für Q76A; –86,1 mV [–89,9 bis –82,3, n = 8] für I80A; –85,6 mV [–89,7 bis –81,5, n = 11] und –83,1 mV [95 % KI: = –87,3 bis –78,9, n = 10] für WT) und nahe am erwarteten Umkehrpotential für einen kaliumselektiven Kanal unter diesen experimentellen Bedingungen.Figur 3
für I80A; 31,1 pA pF −1(95 % KI: 23,7 bis 38,6, n = 11) für L102A. Rampenänderungen des Haltepotentials von –120 auf +20 mV zeigten, dass mutierte Kanäle nach außen gleichgerichtet waren mit mittleren Nullstrom-Umkehrpotentialen, die sich nicht signifikant von WT-Kanälen unterschieden ( p > 0,05, einfache ANOVA, gefolgt von einem Dunnett-Test mit mehreren Vergleichen). (–81,4 mV [95 % KI: = –87,3 bis –75,6, n = 7] für Q76A; –86,1 mV [–89,9 bis –82,3, n = 8] für I80A; –85,6 mV [–89,7 bis –81,5, n = 11] und –83,1 mV [95 % KI: = –87,3 bis –78,9, n = 10] für WT) und nahe am erwarteten Umkehrpotential für einen kaliumselektiven Kanal unter diesen experimentellen Bedingungen.Figur 3
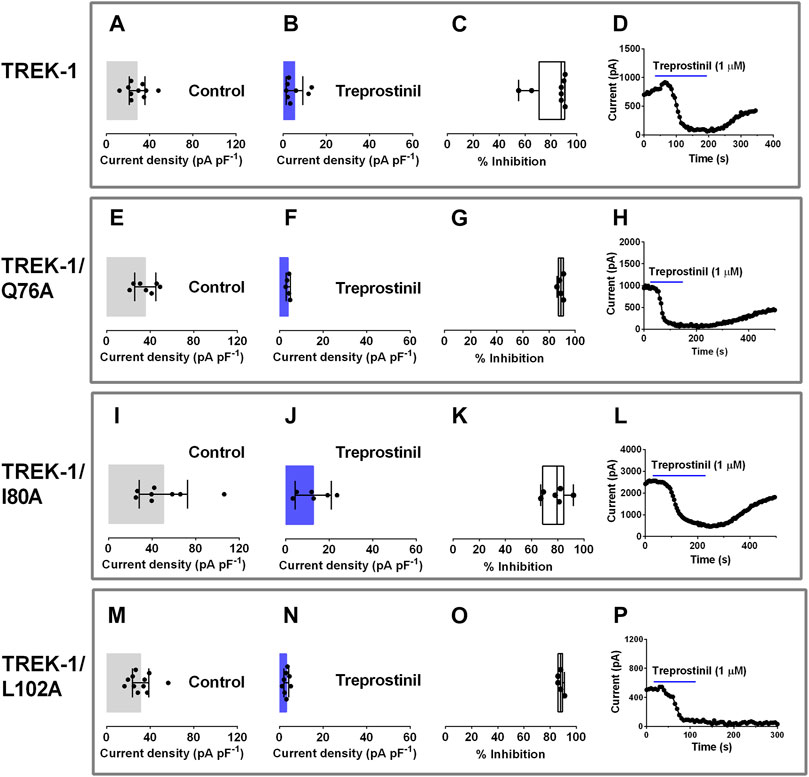 ABBILDUNG 3 . Wirkung von Treprostinil auf Mutationen der extrazellulären allosterischen Ligandenbindungsstelle in TREK-1. Graphen der Stromdichten (pA pF –1 ) von Zellen, die WT TREK-1 (A,
ABBILDUNG 3 . Wirkung von Treprostinil auf Mutationen der extrazellulären allosterischen Ligandenbindungsstelle in TREK-1. Graphen der Stromdichten (pA pF –1 ) von Zellen, die WT TREK-1 (A,  , TREK-1/Q76A (E, F), TREK-1/I80A (I, J) und TREK-1/ vorübergehend exprimieren L102A (M, N) in extrazellulärer Kontrolllösung und in Gegenwart von 1 &mgr;M Treprostinil. Fehlerbalken stellen das 95 % KI dar und Symbole stellen Ströme dar, die von einzelnen Zellen gemessen wurden ( C, G, K, O) . /I80A und TREK-1/L102A. Balken stellen die minimale und maximale Hemmung dar und Linien die mittlere Hemmung, während Symbole die einzelnen Datenpunkte darstellen (D, H, L, P)Exemplarische Zeitverläufe, die die Wirkung von 1 µM Treprostinil (Anwendung dargestellt durch die blaue Linie) auf den Gesamtzellstrom (pA) für jeden Kanaltyp zeigen. Anschließend untersuchten wir den Einfluss dieser Mutationen auf die hemmende Wirkung von Treprostinil auf WT TREK-1-Kanäle. Es wurde festgestellt, dass die Anwendung von Treprostinil (1 µM) den Strom aller drei mutierten Kanäle stark hemmt (Q76A: 4,0 pA pF –1 [95 % KI: 3,0 bis 5,0, n = 5]; I80A: 12,7 pA pF –1 [ 95 % KI: 4,5 bis 21,0, n = 6], L102A: 3,2 pA pF –1 [95 % KI: 2,1 bis 4,3, n = 8]), ähnlich wie WT-Kanäle (5,3 pA pF –1 [95 % KI: 1,4 bis 9,2, n =10] (
Abbildungen 3B, F, J, N
) .= 5) für Q76A, 78,2 % (95 % KI: 68,5 bis 87,8, n = 6) für I80A und 88 % (95 % KI: 85,3 bis 90,3, n = 5) für L102A, die ähnlich ( p > 0,05) waren WT, 82 % (95 % KI: 70,4 bis 93,6, n =
, TREK-1/Q76A (E, F), TREK-1/I80A (I, J) und TREK-1/ vorübergehend exprimieren L102A (M, N) in extrazellulärer Kontrolllösung und in Gegenwart von 1 &mgr;M Treprostinil. Fehlerbalken stellen das 95 % KI dar und Symbole stellen Ströme dar, die von einzelnen Zellen gemessen wurden ( C, G, K, O) . /I80A und TREK-1/L102A. Balken stellen die minimale und maximale Hemmung dar und Linien die mittlere Hemmung, während Symbole die einzelnen Datenpunkte darstellen (D, H, L, P)Exemplarische Zeitverläufe, die die Wirkung von 1 µM Treprostinil (Anwendung dargestellt durch die blaue Linie) auf den Gesamtzellstrom (pA) für jeden Kanaltyp zeigen. Anschließend untersuchten wir den Einfluss dieser Mutationen auf die hemmende Wirkung von Treprostinil auf WT TREK-1-Kanäle. Es wurde festgestellt, dass die Anwendung von Treprostinil (1 µM) den Strom aller drei mutierten Kanäle stark hemmt (Q76A: 4,0 pA pF –1 [95 % KI: 3,0 bis 5,0, n = 5]; I80A: 12,7 pA pF –1 [ 95 % KI: 4,5 bis 21,0, n = 6], L102A: 3,2 pA pF –1 [95 % KI: 2,1 bis 4,3, n = 8]), ähnlich wie WT-Kanäle (5,3 pA pF –1 [95 % KI: 1,4 bis 9,2, n =10] (
Abbildungen 3B, F, J, N
) .= 5) für Q76A, 78,2 % (95 % KI: 68,5 bis 87,8, n = 6) für I80A und 88 % (95 % KI: 85,3 bis 90,3, n = 5) für L102A, die ähnlich ( p > 0,05) waren WT, 82 % (95 % KI: 70,4 bis 93,6, n =  , (
Abbildungen 3C, G, K, O
), dargestellt durch beispielhafte Zeitverläufe für jede Bedingung (
Abbildungen 3D, H, L, P
).Die Unterbrechung bekannter Kontaktbindungsstellen für den Antagonisten Norfluoxetin und die Aktivatoren BL-1249, ML335 und ML402 stört nicht die Treprostinil-Hemmung von TREK-2 oder TREK-1Das Antidepressivum Norfluoxetin, ein aktiver Metabolit von Fluoxetin (Prozac) und ein bekanntes inhibitorisches Molekül der TREK-Familie (
Kennard et al., 2005
;
Heurteaux et al., 2006
), wurde innerhalb der intramembranösen Fenster gebunden, die sich unterhalb des Selektivitätsfilters befinden von TREK-2 (
Dong et al., 2015
). Als Kontaktpunkte für Norfluoxetin wurden mehrere Aminosäuren identifiziert, darunter ein Phenylalanin (F) an Position 316 (F316) und ein Leucin an Position 320 (L320) in der TM4-Region des Kanals. Darüber hinaus wurde festgestellt, dass die Mutation von L320 die Hemmung von TREK-2 durch Norfluoxetin verringert (
Dong et al., 2015
). Dieselbe Aminosäure auf dem TM4 von TREK-1 wurde auch als Kontaktpunkt für den Aktivator BL-1249 identifiziert, und die Mutation dieser entsprechenden Stelle verringerte die Wirksamkeit der Verbindung (
Schewe et al., 2019
). Da das Hemmprofil von Treprostinil auf TREK-2 und TREK-1 dem von Fluoxetin und Norfluoxetin beobachteten ähnlich ist (
Kennard et al., 2005
;
Dong et al., 2015
), haben wir untersucht, ob Treprostinil seine hemmende Wirkung über ausübt die äquivalenten Aminosäuren auf den Intramembranfenstern von sowohl TREK-2 als auch TREK-1.Um dies zu beurteilen, mutierten wir L320 auf TREK-2 und die entsprechende Aminosäure auf dem TM4 von TREK-1, L289, zu einem Alanin. Interessanterweise blieb die Treprostinil-vermittelte Hemmung sowohl der TREK-2/L320A- als auch der TREK-1/L289A-mutierten Kanäle unverändert. Die exprimierten TREK-2/L320A-mutierten homodimeren Kanäle ergaben funktionelle Ganzzellströme von 27,2 pA pF –1 (95 % CI: 21,4 bis 33,0, n = 13), die kleiner waren ( p < 0,05, ungepaarter t - Test) in der Größe als WT-Kanäle 39,9 pA pF –1 (95 % CI: 24,6 bis 55,3, n = 7) unter ähnlichen experimentellen Bedingungen. Applikation von 1 µM Treprostinil signifikant reduziert ( p < 0,05, gepaart t-Test) TREK-2/L320A Kanalströme von 23,5 pA pF −1 (95 % KI: 12,1 bis 34,9, n = 6) bis 6,0 pA pF −1 (95 % KI: 2,4 bis 9,7, n = 6) (
Abbildung 4A
). Insgesamt betrug die durchschnittliche Hemmung des TREK-2/L320A-Stroms durch 1 µM Treprostinil 74 % (95 %-KI: 68,4 bis 80,0, n = 6), verglichen mit 61 % (95 %-KI: 46,1 bis 75,9, n = 7) . ) für WT TREK-2-Kanäle (
Abbildung 4B
).Figur 4
, (
Abbildungen 3C, G, K, O
), dargestellt durch beispielhafte Zeitverläufe für jede Bedingung (
Abbildungen 3D, H, L, P
).Die Unterbrechung bekannter Kontaktbindungsstellen für den Antagonisten Norfluoxetin und die Aktivatoren BL-1249, ML335 und ML402 stört nicht die Treprostinil-Hemmung von TREK-2 oder TREK-1Das Antidepressivum Norfluoxetin, ein aktiver Metabolit von Fluoxetin (Prozac) und ein bekanntes inhibitorisches Molekül der TREK-Familie (
Kennard et al., 2005
;
Heurteaux et al., 2006
), wurde innerhalb der intramembranösen Fenster gebunden, die sich unterhalb des Selektivitätsfilters befinden von TREK-2 (
Dong et al., 2015
). Als Kontaktpunkte für Norfluoxetin wurden mehrere Aminosäuren identifiziert, darunter ein Phenylalanin (F) an Position 316 (F316) und ein Leucin an Position 320 (L320) in der TM4-Region des Kanals. Darüber hinaus wurde festgestellt, dass die Mutation von L320 die Hemmung von TREK-2 durch Norfluoxetin verringert (
Dong et al., 2015
). Dieselbe Aminosäure auf dem TM4 von TREK-1 wurde auch als Kontaktpunkt für den Aktivator BL-1249 identifiziert, und die Mutation dieser entsprechenden Stelle verringerte die Wirksamkeit der Verbindung (
Schewe et al., 2019
). Da das Hemmprofil von Treprostinil auf TREK-2 und TREK-1 dem von Fluoxetin und Norfluoxetin beobachteten ähnlich ist (
Kennard et al., 2005
;
Dong et al., 2015
), haben wir untersucht, ob Treprostinil seine hemmende Wirkung über ausübt die äquivalenten Aminosäuren auf den Intramembranfenstern von sowohl TREK-2 als auch TREK-1.Um dies zu beurteilen, mutierten wir L320 auf TREK-2 und die entsprechende Aminosäure auf dem TM4 von TREK-1, L289, zu einem Alanin. Interessanterweise blieb die Treprostinil-vermittelte Hemmung sowohl der TREK-2/L320A- als auch der TREK-1/L289A-mutierten Kanäle unverändert. Die exprimierten TREK-2/L320A-mutierten homodimeren Kanäle ergaben funktionelle Ganzzellströme von 27,2 pA pF –1 (95 % CI: 21,4 bis 33,0, n = 13), die kleiner waren ( p < 0,05, ungepaarter t - Test) in der Größe als WT-Kanäle 39,9 pA pF –1 (95 % CI: 24,6 bis 55,3, n = 7) unter ähnlichen experimentellen Bedingungen. Applikation von 1 µM Treprostinil signifikant reduziert ( p < 0,05, gepaart t-Test) TREK-2/L320A Kanalströme von 23,5 pA pF −1 (95 % KI: 12,1 bis 34,9, n = 6) bis 6,0 pA pF −1 (95 % KI: 2,4 bis 9,7, n = 6) (
Abbildung 4A
). Insgesamt betrug die durchschnittliche Hemmung des TREK-2/L320A-Stroms durch 1 µM Treprostinil 74 % (95 %-KI: 68,4 bis 80,0, n = 6), verglichen mit 61 % (95 %-KI: 46,1 bis 75,9, n = 7) . ) für WT TREK-2-Kanäle (
Abbildung 4B
).Figur 4
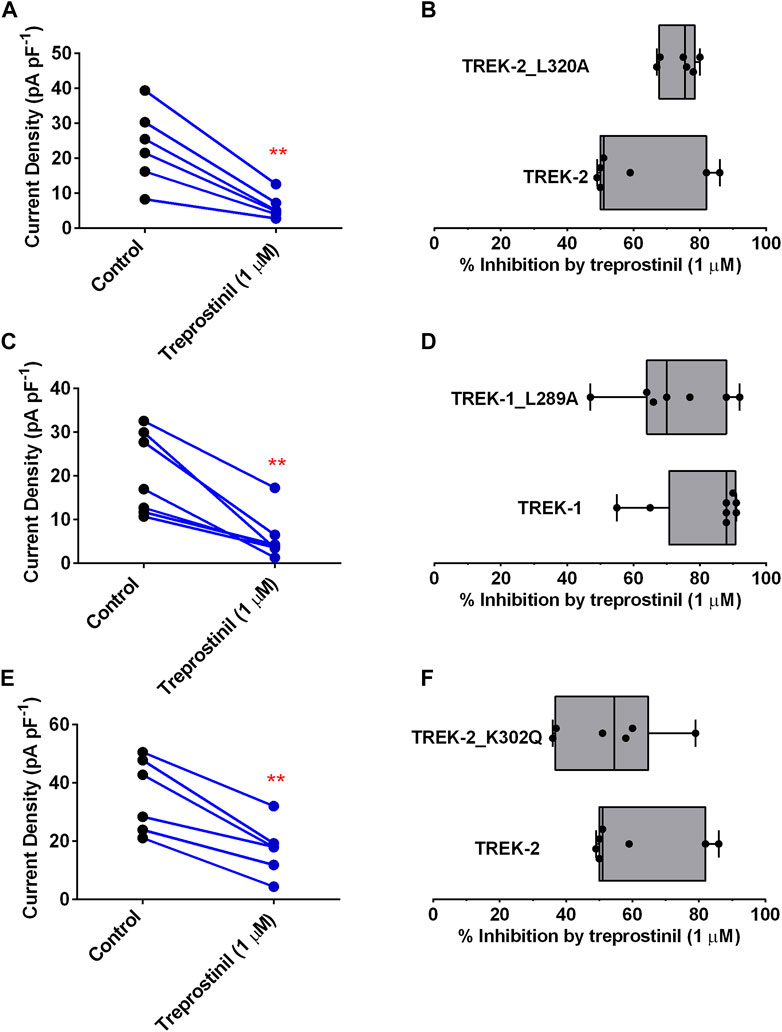 ABBILDUNG 4 . Wirkung von Treprostinil auf mutiertes TREK-2/L320A, TREK-1/L289A und TREK-2/K302Q (A) Messung des Ganzzell-TREK-2/L320A-Stroms (pA pF –1 ) in der Kontrolle ( n = 6) und nach Applikation von Treprostinil (1 μM, n = 6, ** p = 0,003; gepaarter t - Test) (
ABBILDUNG 4 . Wirkung von Treprostinil auf mutiertes TREK-2/L320A, TREK-1/L289A und TREK-2/K302Q (A) Messung des Ganzzell-TREK-2/L320A-Stroms (pA pF –1 ) in der Kontrolle ( n = 6) und nach Applikation von Treprostinil (1 μM, n = 6, ** p = 0,003; gepaarter t - Test) ( Vergleich der Hemmung des WT TREK-2- und TREK-2/L320A-Stroms durch Treprostinil (1 μM) berechnet als die Differenz des in der Kontrolle gemessenen Stroms zu dem nach der Exposition gegenüber Treprostinil gemessenen Strom, ausgedrückt als Prozentsatz, dargestellt als Box-and-Whiskers-Plot. Balken stellen die minimale und maximale Hemmung dar und Linien die mittlere Hemmung für jeden Kanaltyp. Punkte repräsentieren die einzelnen Datenpunkte(C) Messung des Ganzzell-TREK-1/L289A-Stroms (pA pF –1 ) in der Kontrolle ( n = 7) und nach Anwendung von Treprostinil (1 μM, n = 7, ** p = 0,002; gepaarter t - Test ) (D) Vergleich der Hemmung des WT TREK-1- und TREK-1/L289A-Stroms durch Treprostinil (1 µM), ausgedrückt als Prozentsatz, dargestellt als Box-and-Whiskers-Plot (E) Messung von Ganzzell-TREK-2 /K302Q-Strom (pA pF −1 ) in Kontrolle ( n = 6) und nach Applikation von Treprostinil (1 μM, n = 7, ** p < 0,001; gepaarter t - Test) (F)Vergleich der Hemmung des WT TREK-2- und TREK-2/K302Q-Stroms durch Treprostinil (1 µM), ausgedrückt als Prozentsatz, dargestellt als Box-and-Whiskers-Plot. In ähnlicher Weise ergaben die exprimierten TREK-1/L289A-mutierten homodimeren Kanäle durchschnittliche Ganzzellströme von 20,3 pA pF –1 (95 % CI: 11,6 bis 29,05, n = 7), die ähnlich waren ( p > 0,05, ungepaarter t - Test) in Größe zu WT TREK-1 Kanälen und die signifikant reduziert wurden ( p < 0,05, gepaarter t - Test) durch Anwendung von 1 µM Treprostinil auf 5,7 pA pF −1 (95 % CI: 0,82 bis 10,64, n = 7) (
Abbildung 4C
). Insgesamt betrug die durchschnittliche Hemmung des TREK-1/L289A-Stroms durch 1 µM Treprostinil 72 % (95 % KI: 57,8 bis 86,2, n= 7), ähnlich der für WT TREK-1-Kanäle beobachteten Hemmung von 82 % (95 % KI: 70,4 bis 93,6, n = 8, p > 0,05, ungepaarter t - Test) (
4D
).Ebenso reduzierte die Störung der in TREK identifizierten kryptischen Modulatortasche, die nachweislich die Aktivatoren ML335 und ML402 bindet und das C-Typ-Gate reguliert (
Lolicato et al., 2017
), die Wirksamkeit von Treprostinil bei TREK-2 nicht. Die Mutation des Lysins (K) 302 im TM4 von TREK-2, das neben dem Selektivitätsfilter des Kanals sitzt, zu einem Glutamin (K302Q), ergab Ganzzellströme von 35,7 pA pF –1 (95 % CI: 22,2 bis 49,1, n = 6), die in Gegenwart von 1 &mgr;M Treprostinil signifikant ( p < 0,05) auf 17,19 pA pF –1 (95 % KI: 7,6 bis 26,8, n = 6) reduziert wurden (
4E
). Die durchschnittliche Kanalhemmung insgesamt betrug 53,5 % (95 % KI: 36,6 bis 70,4,n = 6), was nicht signifikant unterschiedlich war ( p > 0,05, ungepaarter t -Test) von der WT-TREK-2-Hemmung (
4F
).Eine aktuelle Arbeit von
Qiu et al. (2020)
identifizierten Y270 auf TREK-1 (Y285 in ihrem menschlichen TREK-1-Konstrukt, NM_001017425.3) als eine wichtige Aminosäure, die die Wirksamkeit des antinozizeptiven Aktivators C3001a reguliert. In unseren Händen trugen TREK-1-Kanäle mit der mutierten Aminosäure Y270A einen vernachlässigbaren Strom, 3,3 pA pF –1 (95 % CI: 2,1 bis 4,5, n = 6) in Abwesenheit eines Aktivators (
ergänzende Abbildung S1
). Es war nicht möglich, die Wirkung dieser Mutation auf die Hemmung durch Treprostinil zu bestimmen.Eine Gain-of-Function-Mutation, Y284A in TREK-1, schwächt die hemmende Wirkung von Treprostinil abUm zu versuchen und weiter aufzuklären, wie Treprostinil seine hemmenden Wirkungen auf die TREK-Kanäle übertragen könnte, betrachteten wir eine bekannte Gain-of-Function (GOF)-Mutation, die das Gating des Kanals beeinflusst (Y284A). Es wurde zuvor gezeigt, dass diese Aminosäure die Wirkung des Aktivators Flufenaminsäure (FFA) und die Wirkung von Arachidonsäure abschwächt (
Veale et al., 2014
;
Ma und Lewis, 2020
) und die hemmenden Wirkungen von Norfluoxetin und Spadin antagonisiert (
McClenaghan et al., 2016
;
Ma und Lewis, 2020
). Wie bereits berichtet (
Veale et al., 2014
) führte die Mutation von Y284 zu einem Alanin in TREK-1 zu Kanälen mit großen Auswärtsströmen von 95,8 pA pF –1 (95 % KI: 74,6 bis 117,0,n = 5), die signifikant größer waren ( p < 0,05, ungepaarter t -Test) als WT TREK-1, 24,2 pA pF –1 (95 % KI: 18,3 bis 30,1, n =
Vergleich der Hemmung des WT TREK-2- und TREK-2/L320A-Stroms durch Treprostinil (1 μM) berechnet als die Differenz des in der Kontrolle gemessenen Stroms zu dem nach der Exposition gegenüber Treprostinil gemessenen Strom, ausgedrückt als Prozentsatz, dargestellt als Box-and-Whiskers-Plot. Balken stellen die minimale und maximale Hemmung dar und Linien die mittlere Hemmung für jeden Kanaltyp. Punkte repräsentieren die einzelnen Datenpunkte(C) Messung des Ganzzell-TREK-1/L289A-Stroms (pA pF –1 ) in der Kontrolle ( n = 7) und nach Anwendung von Treprostinil (1 μM, n = 7, ** p = 0,002; gepaarter t - Test ) (D) Vergleich der Hemmung des WT TREK-1- und TREK-1/L289A-Stroms durch Treprostinil (1 µM), ausgedrückt als Prozentsatz, dargestellt als Box-and-Whiskers-Plot (E) Messung von Ganzzell-TREK-2 /K302Q-Strom (pA pF −1 ) in Kontrolle ( n = 6) und nach Applikation von Treprostinil (1 μM, n = 7, ** p < 0,001; gepaarter t - Test) (F)Vergleich der Hemmung des WT TREK-2- und TREK-2/K302Q-Stroms durch Treprostinil (1 µM), ausgedrückt als Prozentsatz, dargestellt als Box-and-Whiskers-Plot. In ähnlicher Weise ergaben die exprimierten TREK-1/L289A-mutierten homodimeren Kanäle durchschnittliche Ganzzellströme von 20,3 pA pF –1 (95 % CI: 11,6 bis 29,05, n = 7), die ähnlich waren ( p > 0,05, ungepaarter t - Test) in Größe zu WT TREK-1 Kanälen und die signifikant reduziert wurden ( p < 0,05, gepaarter t - Test) durch Anwendung von 1 µM Treprostinil auf 5,7 pA pF −1 (95 % CI: 0,82 bis 10,64, n = 7) (
Abbildung 4C
). Insgesamt betrug die durchschnittliche Hemmung des TREK-1/L289A-Stroms durch 1 µM Treprostinil 72 % (95 % KI: 57,8 bis 86,2, n= 7), ähnlich der für WT TREK-1-Kanäle beobachteten Hemmung von 82 % (95 % KI: 70,4 bis 93,6, n = 8, p > 0,05, ungepaarter t - Test) (
4D
).Ebenso reduzierte die Störung der in TREK identifizierten kryptischen Modulatortasche, die nachweislich die Aktivatoren ML335 und ML402 bindet und das C-Typ-Gate reguliert (
Lolicato et al., 2017
), die Wirksamkeit von Treprostinil bei TREK-2 nicht. Die Mutation des Lysins (K) 302 im TM4 von TREK-2, das neben dem Selektivitätsfilter des Kanals sitzt, zu einem Glutamin (K302Q), ergab Ganzzellströme von 35,7 pA pF –1 (95 % CI: 22,2 bis 49,1, n = 6), die in Gegenwart von 1 &mgr;M Treprostinil signifikant ( p < 0,05) auf 17,19 pA pF –1 (95 % KI: 7,6 bis 26,8, n = 6) reduziert wurden (
4E
). Die durchschnittliche Kanalhemmung insgesamt betrug 53,5 % (95 % KI: 36,6 bis 70,4,n = 6), was nicht signifikant unterschiedlich war ( p > 0,05, ungepaarter t -Test) von der WT-TREK-2-Hemmung (
4F
).Eine aktuelle Arbeit von
Qiu et al. (2020)
identifizierten Y270 auf TREK-1 (Y285 in ihrem menschlichen TREK-1-Konstrukt, NM_001017425.3) als eine wichtige Aminosäure, die die Wirksamkeit des antinozizeptiven Aktivators C3001a reguliert. In unseren Händen trugen TREK-1-Kanäle mit der mutierten Aminosäure Y270A einen vernachlässigbaren Strom, 3,3 pA pF –1 (95 % CI: 2,1 bis 4,5, n = 6) in Abwesenheit eines Aktivators (
ergänzende Abbildung S1
). Es war nicht möglich, die Wirkung dieser Mutation auf die Hemmung durch Treprostinil zu bestimmen.Eine Gain-of-Function-Mutation, Y284A in TREK-1, schwächt die hemmende Wirkung von Treprostinil abUm zu versuchen und weiter aufzuklären, wie Treprostinil seine hemmenden Wirkungen auf die TREK-Kanäle übertragen könnte, betrachteten wir eine bekannte Gain-of-Function (GOF)-Mutation, die das Gating des Kanals beeinflusst (Y284A). Es wurde zuvor gezeigt, dass diese Aminosäure die Wirkung des Aktivators Flufenaminsäure (FFA) und die Wirkung von Arachidonsäure abschwächt (
Veale et al., 2014
;
Ma und Lewis, 2020
) und die hemmenden Wirkungen von Norfluoxetin und Spadin antagonisiert (
McClenaghan et al., 2016
;
Ma und Lewis, 2020
). Wie bereits berichtet (
Veale et al., 2014
) führte die Mutation von Y284 zu einem Alanin in TREK-1 zu Kanälen mit großen Auswärtsströmen von 95,8 pA pF –1 (95 % KI: 74,6 bis 117,0,n = 5), die signifikant größer waren ( p < 0,05, ungepaarter t -Test) als WT TREK-1, 24,2 pA pF –1 (95 % KI: 18,3 bis 30,1, n =  und in Übereinstimmung mit Kanälen mit einem höheren Wert Po ( Proks
et al., 2020
). Es wurde festgestellt, dass die Anwendung von 1 &mgr;M Treprostinil die TREK-1/Y284A-Kanalströme immer noch signifikant reduziert ( p < 0,05, gepaarter t -Test) auf 40,0 pA pF –1 (95 % CI: 22,5 bis 57,5, n = 5) (
5A ). ,B,D
). Obwohl der Strom durch den TREK-1/Y284A-Mutantenkanal immer noch wesentlich gehemmt wurde (58 %) durch Treprostinil, wurde der Grad der Hemmung durch die WT TREK-1-Hemmung signifikant reduziert ( p < 0,05, ungepaarter t -Test) (
Abbildungen 5C, D
), was darauf hindeutet, dass die Wirkung der Verbindung durch Gating am Kanalselektivitätsfilter beeinflusst wird (
McClenaghan et al., 2016
;
Proks et al., 2020
).Abbildung 5
und in Übereinstimmung mit Kanälen mit einem höheren Wert Po ( Proks
et al., 2020
). Es wurde festgestellt, dass die Anwendung von 1 &mgr;M Treprostinil die TREK-1/Y284A-Kanalströme immer noch signifikant reduziert ( p < 0,05, gepaarter t -Test) auf 40,0 pA pF –1 (95 % CI: 22,5 bis 57,5, n = 5) (
5A ). ,B,D
). Obwohl der Strom durch den TREK-1/Y284A-Mutantenkanal immer noch wesentlich gehemmt wurde (58 %) durch Treprostinil, wurde der Grad der Hemmung durch die WT TREK-1-Hemmung signifikant reduziert ( p < 0,05, ungepaarter t -Test) (
Abbildungen 5C, D
), was darauf hindeutet, dass die Wirkung der Verbindung durch Gating am Kanalselektivitätsfilter beeinflusst wird (
McClenaghan et al., 2016
;
Proks et al., 2020
).Abbildung 5
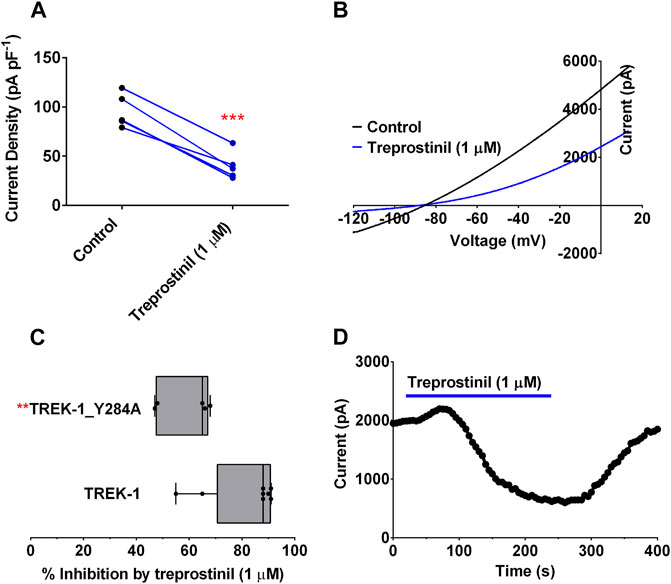 ABBILDUNG 5 . Wirkung von Treprostinil auf mutiertes TREK-1/Y284A (A) Messung des Ganzzell-TREK-1/Y284A-Stroms (pA pF –1 ) bei der Kontrolle ( n = 5) und nach akuter Anwendung von Treprostinil (1 μM, n = 5 , *** p = 0,0004; gepaarter t - Test) (
ABBILDUNG 5 . Wirkung von Treprostinil auf mutiertes TREK-1/Y284A (A) Messung des Ganzzell-TREK-1/Y284A-Stroms (pA pF –1 ) bei der Kontrolle ( n = 5) und nach akuter Anwendung von Treprostinil (1 μM, n = 5 , *** p = 0,0004; gepaarter t - Test) ( Strom-Spannungs-Verhältnis von TREK-1/Y284A-Strömen (Durchschnitt von n = 5 Zellen) unter Kontrollbedingungen (schwarze Linie) und Treprostinil (1 μM, Durchschnitt von n = 5 Zellen, blaue Linie) aufgenommen über eine Spannungsrampe (−120 mV bis +20 mV) (C)Vergleich der Hemmung des WT TREK-1- und TREK-1/Y284A-Stroms durch Treprostinil (1 µM), berechnet als Differenz des Stroms, der in der Kontrolle gemessen wurde, mit dem, der nach der Exposition gegenüber Treprostinil gemessen wurde, ausgedrückt als Prozentsatz, angezeigt als Kästchen und Whiskers-Diagramm (** p < 0,009, ungepaarter t - Test) (D) Exemplarisches Zeitverlaufsdiagramm für TREK-1/Y284A-Strom, das die Wirkung des Wechsels von einer extrazellulären Kontrolllösung zu einer mit Treprostinil (1 μM, blaue Linie) zeigt. BL-1249, ein Aktivator des TREK-Stroms, wirkt der Treprostinil-Hemmung des TREK-1- und TREK-2-Stroms entgegenDer negativ geladene Aktivator BL-1249 ist ein etablierter Aktivator von TREK-1- und TREK-2-Kanälen (
Tertyshnikova et al., 2005
;
Veale et al., 2014
;
Pope et al., 2018
;
Schewe et al., 2019
;
Mathie et al., 2021b
). BL-1249 (1 µM) erhöhte signifikant ( p < 0,05) den TREK-1- und TREK-2-Kontrollstrom um 144 % (95 %-KI: 72,8 bis 214,5, n =
Strom-Spannungs-Verhältnis von TREK-1/Y284A-Strömen (Durchschnitt von n = 5 Zellen) unter Kontrollbedingungen (schwarze Linie) und Treprostinil (1 μM, Durchschnitt von n = 5 Zellen, blaue Linie) aufgenommen über eine Spannungsrampe (−120 mV bis +20 mV) (C)Vergleich der Hemmung des WT TREK-1- und TREK-1/Y284A-Stroms durch Treprostinil (1 µM), berechnet als Differenz des Stroms, der in der Kontrolle gemessen wurde, mit dem, der nach der Exposition gegenüber Treprostinil gemessen wurde, ausgedrückt als Prozentsatz, angezeigt als Kästchen und Whiskers-Diagramm (** p < 0,009, ungepaarter t - Test) (D) Exemplarisches Zeitverlaufsdiagramm für TREK-1/Y284A-Strom, das die Wirkung des Wechsels von einer extrazellulären Kontrolllösung zu einer mit Treprostinil (1 μM, blaue Linie) zeigt. BL-1249, ein Aktivator des TREK-Stroms, wirkt der Treprostinil-Hemmung des TREK-1- und TREK-2-Stroms entgegenDer negativ geladene Aktivator BL-1249 ist ein etablierter Aktivator von TREK-1- und TREK-2-Kanälen (
Tertyshnikova et al., 2005
;
Veale et al., 2014
;
Pope et al., 2018
;
Schewe et al., 2019
;
Mathie et al., 2021b
). BL-1249 (1 µM) erhöhte signifikant ( p < 0,05) den TREK-1- und TREK-2-Kontrollstrom um 144 % (95 %-KI: 72,8 bis 214,5, n =  und 192 % (95 %-KI: 135,2 bis 248). , n = 5) (siehe auch
Tabelle 1
, C2, D2;
Abbildungen 6A,B
, blaue Linie). Sobald die BL-1249-aktivierten TREK-Ströme stabil waren (2–4 min), wurde die Lösung auf eine umgestellt, die sowohl BL-1249 (1 µM) als auch Treprostinil (1 µM) enthielt (
Abbildungen 6A, B
graue Linie). Die Menge des BL-1249-aktivierten Stroms, der nach der Treprostinil-Hemmung verbleibt, wurde gemessen, sobald die maximale Hemmung durch 1 &mgr;M Treprostinil beobachtet wurde (
Tabelle 1
, C3, D3). Interessanterweise unterschied sich sowohl für TREK-1 als auch für TREK-2 der Strom in der kombinierten Gegenwart von Treprostinil und BL-1249 (C3, D3) nicht signifikant ( p > 0,05) vom ursprünglichen Startstrom (C1, D1).Tabelle 1
und 192 % (95 %-KI: 135,2 bis 248). , n = 5) (siehe auch
Tabelle 1
, C2, D2;
Abbildungen 6A,B
, blaue Linie). Sobald die BL-1249-aktivierten TREK-Ströme stabil waren (2–4 min), wurde die Lösung auf eine umgestellt, die sowohl BL-1249 (1 µM) als auch Treprostinil (1 µM) enthielt (
Abbildungen 6A, B
graue Linie). Die Menge des BL-1249-aktivierten Stroms, der nach der Treprostinil-Hemmung verbleibt, wurde gemessen, sobald die maximale Hemmung durch 1 &mgr;M Treprostinil beobachtet wurde (
Tabelle 1
, C3, D3). Interessanterweise unterschied sich sowohl für TREK-1 als auch für TREK-2 der Strom in der kombinierten Gegenwart von Treprostinil und BL-1249 (C3, D3) nicht signifikant ( p > 0,05) vom ursprünglichen Startstrom (C1, D1).Tabelle 1
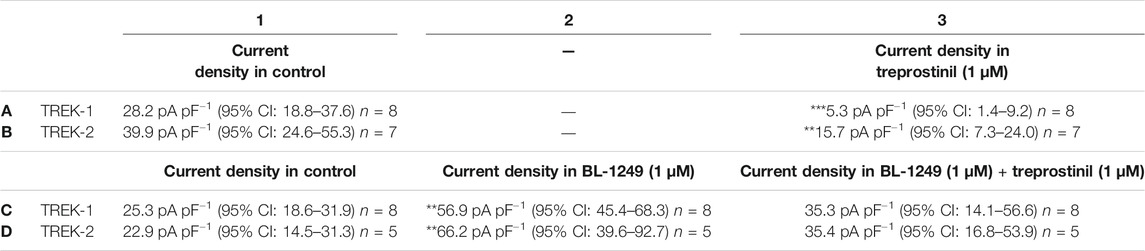 TABELLE 1 . Wirkung der Treprostinil-Hemmung auf BL-1249-präaktivierte TREK-1- und TREK-2-Kanäle . Messung des Ganzzell-TREK-1-Stroms (pA pF –1 ) bei Kontrolle (A1) und dann nach Applikation von 1 µM Treprostinil (A3) (*** p < 0,0004 [95 % KI: –31,4 bis –14,5], gepaarter t -Test). Messung des TREK-2-Stroms in der Kontrolle (B1) und dann nach Anwendung von 1 µM Treprostinil (B3) (** p < 0,001 [95 % KI: –34,4 bis –14,1], gepaarter t - Test). Messung des Ganzzell-TREK-1-Stroms in der Kontrolle (C1) und nach Applikation von 1 µM BL-1249 (C2) (** p< 0,002 [95 % KI: –69,6 bis –17,10], einfache ANOVA, gefolgt von Dunnetts multiplem Vergleichstest) und dann nach Anwendung von 1 µM Treprostinil auf den BL-1249-aktivierten Strom (C3) ( p > 0,05 [ −31,9 bis 11,76] einfache ANOVA, gefolgt von Dunnetts multiplem Vergleichstest). TREK-2-Strom in der Kontrolle (D1) und nach Anwendung von 1 µM BL-1249 (D2) (** p < 0,003 [95 % KI: –69,6 bis –17,1], einfache ANOVA, gefolgt von Dunnetts multiplem Vergleichstest ) und dann nach Anwendung von 1 µM Treprostinil auf den BL-1249-aktivierten TREK-2-Strom (D3) ( p > 0,05 [–38,8 bis 13,66], einfache ANOVA, gefolgt von Dunnetts multiplem Vergleichstest). Abbildung 6
TABELLE 1 . Wirkung der Treprostinil-Hemmung auf BL-1249-präaktivierte TREK-1- und TREK-2-Kanäle . Messung des Ganzzell-TREK-1-Stroms (pA pF –1 ) bei Kontrolle (A1) und dann nach Applikation von 1 µM Treprostinil (A3) (*** p < 0,0004 [95 % KI: –31,4 bis –14,5], gepaarter t -Test). Messung des TREK-2-Stroms in der Kontrolle (B1) und dann nach Anwendung von 1 µM Treprostinil (B3) (** p < 0,001 [95 % KI: –34,4 bis –14,1], gepaarter t - Test). Messung des Ganzzell-TREK-1-Stroms in der Kontrolle (C1) und nach Applikation von 1 µM BL-1249 (C2) (** p< 0,002 [95 % KI: –69,6 bis –17,10], einfache ANOVA, gefolgt von Dunnetts multiplem Vergleichstest) und dann nach Anwendung von 1 µM Treprostinil auf den BL-1249-aktivierten Strom (C3) ( p > 0,05 [ −31,9 bis 11,76] einfache ANOVA, gefolgt von Dunnetts multiplem Vergleichstest). TREK-2-Strom in der Kontrolle (D1) und nach Anwendung von 1 µM BL-1249 (D2) (** p < 0,003 [95 % KI: –69,6 bis –17,1], einfache ANOVA, gefolgt von Dunnetts multiplem Vergleichstest ) und dann nach Anwendung von 1 µM Treprostinil auf den BL-1249-aktivierten TREK-2-Strom (D3) ( p > 0,05 [–38,8 bis 13,66], einfache ANOVA, gefolgt von Dunnetts multiplem Vergleichstest). Abbildung 6
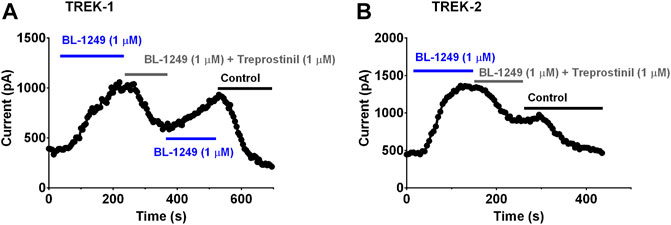 ABBILDUNG 6 . Treprostinil-Hemmung von TREK-1- und TREK-2-Kanälen, die durch BL-1249 voraktiviert wurden (A) Exemplarisches Zeitverlaufsdiagramm, das die Wirkung von 1 µM BL-1249 zeigt (Anwendung durch die blaue Linie gezeigt), gefolgt von der kombinierten Anwendung von 1 µM BL-1249 und 1 µM Treprostinil (graue Linie), dann Rückkehr zu 1 µM BL-1249 allein, auf TREK-1-Ganzzellenstrom (
ABBILDUNG 6 . Treprostinil-Hemmung von TREK-1- und TREK-2-Kanälen, die durch BL-1249 voraktiviert wurden (A) Exemplarisches Zeitverlaufsdiagramm, das die Wirkung von 1 µM BL-1249 zeigt (Anwendung durch die blaue Linie gezeigt), gefolgt von der kombinierten Anwendung von 1 µM BL-1249 und 1 µM Treprostinil (graue Linie), dann Rückkehr zu 1 µM BL-1249 allein, auf TREK-1-Ganzzellenstrom ( Exemplarisches Zeitverlaufsdiagramm, das die Wirkung von 1 µM BL-1249 zeigt (blaue Linie), gefolgt von der kombinierten Anwendung von 1 µM BL-1249 und 1 µM Treprostinil (graue Linie) auf TREK-2-Ganzzellstrom. DiskussionDie subkutane Infusion von Treprostinil bei Patienten mit PAH führt zu signifikanten Verbesserungen ihrer körperlichen Leistungsfähigkeit und Hämodynamik, diese Vorteile werden jedoch durch Schmerzen an der subkutanen Infusionsstelle beeinträchtigt (
Simonneau et al., 2002
;
McLaughlin et al., 2003
;
Picken et al ., 2019
). Es wurde auch gezeigt, dass die Behandlung mit Treprostinil mehrere andere schmerzhafte Nebenwirkungen hat, darunter Kieferschmerzen, Kopfschmerzen und Schmerzen in den Extremitäten (
Picken et al., 2019
). In dieser Studie haben wir gezeigt, dass Treprostinil sowohl die humanen TREK-1- als auch TREK-2-Kanäle wirksam und reversibel hemmt. TREK-1- und TREK-2-Kanäle sind stark an Schmerzsignalwegen beteiligt und beide werden in sensorischen Neuronen reichlich exprimiert (
Allouiet al., 2006
;
Marsh et al., 2012
).Im Gegensatz dazu wurden die TASK-1-Kanäle durch Treprostinil nicht gehemmt. TASK-1-Kanäle werden in menschlichen PASMCs stark exprimiert und spielen eine Rolle bei der Regulierung des Ruhemembranpotentials dieser Zellen (
Olschewski et al., 2006
). Es wurde gezeigt, dass die Herunterregulierung, Hemmung oder Inaktivierung von Mutationen von TASK-1-Kanälen zu einem schädlichen Gefäßumbau im Phänotyp der PAH-Krankheit beiträgt (
Ma et al., 2013
;
Boucherat et al., 2015
;
Antigny et al., 2016
;
Navas et al ., 2017
;
Cunningham et al., 2019
), während sich pharmakologische Interventionen, die den TASK-1-Kanalstrom verstärken, als vorteilhaft bei der PAH-Behandlung erwiesen haben (
Olschewski et al., 2006
;
Ma et al., 2013
;
Antigny et al., 2016
;
Cunningham et al., 2019
). Es wurde zuvor gezeigt, dass Treprostinil den TASK-1-Kanalstrom indirekt über einen Proteinkinase-A-abhängigen Weg verstärkt (
Olschewski et al., 2006
). Dies stimmt mit den hier erhaltenen Daten überein, wo festgestellt wurde, dass eine verlängerte Inkubation in Treprostinil eine Verstärkung des Stroms durch TASK-1-Kanäle induziert.Regulierung der TREK-Kanäle durch TreprostinilEin Unterscheidungsmerkmal von K2P-Kanälen ist das Vorhandensein einer extrazellulären Kappendomäne, die die Bildung von zwei tunnelartigen Seitenportalen bewirkt, die eine bilaterale extrazelluläre Ionenleitung vom Selektivitätsfilter ermöglichen (
Brohawn et al., 2013
;
Dong et al., 2015
) . Dieses strukturelle Merkmal liegt der Unempfindlichkeit von K2P-Kanälen gegenüber klassischen K-Kanal-Porenblockern wie TEA zugrunde (
Brohawn et al., 2012
;
Miller und Long, 2012
). Einige kleine Moleküle wie Rutheniumrot und Zink üben ihre hemmende Wirkung über Stellen an der extrazellulären Kappe von TASK-Kanälen aus (
Czirják und Enyedi, 2003
;
Musset et al., 2006
;
Clarke et al., 2008
). In jüngerer Zeit wurde gezeigt, dass die extrazelluläre Kappe in TREK-Kanälen wichtig ist, um die Wirkung kleiner Liganden wie TKDC und Rutheniumrot über allosterische Konformationsänderungen der bilateralen Seitenportale zu übertragen, die anschließend die Ionenleitung unterbrechen (
Braun et al., 2015
;
Luo et al., 2017
). Um den molekularen Mechanismus aufzuklären, durch den Treprostinil TREK-Kanäle hemmt, untersuchten wir seine Wirkung auf drei identifizierte Mutationen in der extrazellulären Kappe, die sich als wichtig für die TKDC-Bindung an TREK-1-Kanäle erwiesen haben (
Luo et al., 2017
). Überraschenderweise veränderte keine dieser Mutationen die hemmende Wirkung von Treprostinil auf TREK-1-Kanäle, was darauf hindeutet, dass Treprostinil seine Wirkung nicht durch Bindung an diese Region der extrazellulären Kappe ausübt und den Ionenleitungsweg des Kanals blockiert.Ein weiterer TREK-Kanal-Antagonist und Antidepressivum, Norfluoxetin (
Kennard et al., 2005
), übt seine Wirkung durch Bindung an ein hochkonserviertes Fenster neben dem Porenfiltereingang von TREK-2 aus (
Dong et al., 2015
). Kontaktpunkte für Norfluoxetin auf TREK-2 wurden in der TM4-Region des Kanals identifiziert, und es wurde festgestellt, dass die Mutation von L320 die Norfluoxetin-Hemmung von TREK-2 reduziert (
Dong et al., 2015
). Die äquivalente Aminosäure am TM4 von TREK-1, L289, wurde auch als Kontaktpunkt für den TREK-1-Agonisten BL-1249 identifiziert, dessen Mutation die Wirksamkeit der Verbindung verringerte (
Schewe et al., 2019
). Wir haben festgestellt, ob Treprostinil seine hemmende Wirkung über die äquivalenten Aminosäuren auf die Intramembranfenster von TREK-1 und TREK-2 ausübt, Mutationen von Antagonistenstellen in der TM4-Region von TREK-1 und TREK-2 jedoch nicht Treprostinil-Hemmung der Kanäle verändern. Dies würde bedeuten, dass Treprostinil nicht an dieselbe Stelle auf TREK-Kanälen bindet wie Norfluoxetin.
Lolicatoet al. (2017)
zeigten, dass zwei niedermolekulare Aktivatoren von TREK-Kanälen, ML335 und ML402, in der Lage waren, das C-Typ-Gate unabhängig von der TM4-Region des Kanals zu beeinflussen, indem sie direkt an das C-Typ-Gate binden, was die „kryptische Selektivität“ prägte -Filterbindungsstelle “ (
Lolicato et al., 2017
). Ein Lysin in TREK-1 (K271) wurde als eine wichtige Interaktionsstelle für diese Verbindungen und essentiell für die Aktivierung identifiziert (
Lolicato et al., 2017
). Die Mutation des äquivalenten Lysins in TREK-2 (K302Q) veränderte die Wirkung von Treprostinil nicht.Ein Tyrosin in der TM4-Region (Y270 in der hier verwendeten TREK-1-Isoform) hat sich kürzlich als wichtig für die Regulierung der Wirksamkeit eines Anti-Nozizeptor-Aktivators, C3001a, erwiesen (
Qiu et al., 2020
). Wir fanden jedoch heraus, dass diese Mutation einen vernachlässigbaren Strom bei –40 mV in Abwesenheit einer hohen Konzentration eines TREK-1-Kanalaktivators trug und konnten daher nicht testen, ob sie die Treprostinil-Hemmung störte.Abschwächung der Treprostinil-Hemmung der TREK-KanäleDas C-Typ-Selektivitätsfiltergate ist hochempfindlich gegenüber intrazellulären Modulatoren wie Hitze, mechanischer Belastung und intrazellulärer Azidose (
Patel et al., 1998
.;
Maingret et al., 1999
;
Bagriantsev et al., 2011
;
Piechotta et al., 2011
;
Mathie et al., 2021b
) und extrazelluläre Regulatoren wie Protonierung (
Cohen et al., 2008
;
Sandoz et al., 2009).
). Eine Reihe von Aminosäuren in der porenauskleidenden TM4-Helix von TREK-1 in der Nähe des Selektivitätsfilters wurden als wichtig für die Regulierung des Kanalgatings identifiziert. Die Mutation dieser Aminosäuren führt zu einem GOF, das wiederum die Kanalsteuerung und -regulierung durch externe und interne Regulatoren stört (
Bagriantsev et al., 2011
;
Bagriantsev et al., 2012
;
Veale et al., 2014
). Wir haben zuvor gezeigt, dass ein Tyrosin an Position 284 in TREK-1 einen GOF verursacht, der die Aktivierung durch das Fenamat, Flufenaminsäure und durch BL-1249 erheblich verringert, wodurch die Ligandenwirksamkeit verringert wird (
Veale et al., 2014
). Dieser Tyrosinrest, der sich innerhalb des „Scharniers“ der TM4-Domäne von TREK-Kanälen befindet, einem kritischen Bereich, der an der Bewegung dieser Kanäle zwischen verschiedenen „Up“- und „Down“-Zuständen beteiligt ist (
Dong et al., 2015
), wurde gezeigt um die Empfindlichkeit der Kanäle gegenüber Dehnung zu verändern, Norfluoxetin und BL-1249 (
McClenaghan et al., 2016
;
Aryal et al., 2017
;
Schewe et al., 2019
). Die Mutation dieser Aminosäure in TREK-2 (Y315A,
Dong et al., 2015
) versetzt den Kanal in einen aktivierten Zustand mit erhöhten makroskopischen Strömen und einer höheren Resting-Open-Wahrscheinlichkeit (P o ) (
McClenaghan et al., 2016
;
Proks et Al., 2020
). Es wurde auch gezeigt, dass diese Region bei der Bindung sowohl von Kanalaktivatoren als auch von Inhibitoren in anderen K-Kanälen wichtig ist (
Hosaka et al., 2007
;
Perry et al., 2010
;
Garg et al., 2011
). Interessanterweise fanden wir heraus, dass die äquivalente Y284A-GOF-Mutation von TREK-1 die Wirkung von Treprostinil auf diese Kanäle signifikant abschwächte, was darauf hindeutet, dass Treprostinil bei der Hemmung dieser Kanäle viel weniger effizient war, wenn es offen war (
McClenaghan et al., 2016
;
Proks et al., 2020
). Obwohl Treprostinil nicht an die gleiche Stelle bindet wie Norfluoxetin, ist die Blockierung durch Treprostinil daher auch vom Gating-Zustand abhängig und effektiver, wenn sich die TREK-Kanäle in ihrem niedrigeren offenen Wahrscheinlichkeitszustand befinden, der dadurch gekennzeichnet ist, dass die TM4-Regionen der Kanäle in ihrem " down“-Konformation (
Dong et al., 2015
;
McClenaghan et al., 2016
). Daher wird die Wirkung von Treprostinil durch „C-Typ“-Selektivitätsfilter-Gating des Kanals beeinflusst (
Chemin et al., 2005
;
Bagriantsev et al., 2011
;
Bagriantsev et al., 2012
;
Dong et al., 2015
;
McClenaghanet al., 2016
). Es ist von Interesse, dass die Hemmung von TREK-1 (∼75 %) und TREK-2 (∼55 %) durch Treprostinil unvollständig ist, was mit dem Vorhandensein mehrerer Gating-Zustände von TREK-Kanälen übereinstimmt (
McClenaghan et al., 2016
). von denen eines oder mehrere resistent gegenüber einer Blockierung durch die Verbindung sind.Da das Gating des Kanals die Treprostinil-Hemmung beeinflusste, stellten wir fest, ob das „Öffnen“ des Kanals mit einem pharmakologischen Aktivator, BL-1249 (
Tertyshnikova et al., 2005
;
Veale et al., 2014
), auch die hemmende Wirkung von Treprostinil abschwächen würde. Wir fanden heraus, dass die Voranwendung von BL-1249 sowohl auf die TREK-1- als auch auf die TREK-2-Kanäle tatsächlich die Hemmung durch Treprostinil abschwächte, wie wir bei der GOF-Mutation gesehen haben. Tatsächlich war der durch Treprostinil gehemmte Strom größer als der Ausgangsstrom der ursprünglichen Ausgangslinie vor der Behandlung mit BL-1249. Es wurde gezeigt, dass die BL-1249-Voraktivierung des TREK-1-Stroms die Wirkung des Inhibitors Spadin antagonisiert (
Ma und Lewis, 2020
), ein ähnlicher Effekt wie bei TREK-2-Strom mit dem Aktivator ML335 und dem Inhibitor Norfluoxetin (
Lolicato et al., 2017
;
Proks et al., 2020
).Angesichts der Tatsache, dass TREK-Kanäle bekanntermaßen an der akuten Nozizeption beteiligt sind, ist es möglich, dass die Hemmung der TREK-Kanäle durch Treprostinil für die subkutanen Schmerzen bei PAH-Patienten verantwortlich ist. Dies ähnelt dem akuten Schmerz, der durch Oxaliplatin bei der Anwendung in der Krebstherapie ausgelöst wird (
Poupon et al., 2018
), was auf eine Herunterregulierung der TREK- und TRAAK-Kanäle zurückzuführen ist (
Pereira et al., 2021
). Die mittlere Plasmakonzentration von Treprostinil bei Patienten beträgt etwa 10–20 ng/ml (25–50 nM) und liegt damit im Bereich der IC 50s hier für einen Block von TREK-1- und TREK-2-Kanälen. An der Stelle der subkutanen Injektion wäre diese Konzentration jedoch höher und könnte eine wesentliche Blockierung der TREK-Kanäle verursachen. Die starken antinozizeptiven Vorteile der pharmakologisch hochregulierten TREK-1- und TREK-2-Kanäle wurden kürzlich in vivo mit einer Reihe von substituierten Acrylsäure-Analoga und C3100a gezeigt (
Vivier et al., 2017
;
Qiu et al., 2020
). In ähnlicher Weise kann die Aktivierung von TREK-Kanälen durch Riluzol die durch Oxaliplatin induzierten neuropathischen Schmerzen überwinden (
Poupon et al., 2018
). Es wird vorgeschlagen, dass die Verwendung eines spezifischen Aktivators von TREK-Kanälen, der topisch angewendet wird, möglicherweise eine sichere therapeutische Strategie zur Überwindung der unerträglichen Schmerzen bietet, die bei Patienten auftreten, die eine Treprostinil-Injektion erhalten.
Exemplarisches Zeitverlaufsdiagramm, das die Wirkung von 1 µM BL-1249 zeigt (blaue Linie), gefolgt von der kombinierten Anwendung von 1 µM BL-1249 und 1 µM Treprostinil (graue Linie) auf TREK-2-Ganzzellstrom. DiskussionDie subkutane Infusion von Treprostinil bei Patienten mit PAH führt zu signifikanten Verbesserungen ihrer körperlichen Leistungsfähigkeit und Hämodynamik, diese Vorteile werden jedoch durch Schmerzen an der subkutanen Infusionsstelle beeinträchtigt (
Simonneau et al., 2002
;
McLaughlin et al., 2003
;
Picken et al ., 2019
). Es wurde auch gezeigt, dass die Behandlung mit Treprostinil mehrere andere schmerzhafte Nebenwirkungen hat, darunter Kieferschmerzen, Kopfschmerzen und Schmerzen in den Extremitäten (
Picken et al., 2019
). In dieser Studie haben wir gezeigt, dass Treprostinil sowohl die humanen TREK-1- als auch TREK-2-Kanäle wirksam und reversibel hemmt. TREK-1- und TREK-2-Kanäle sind stark an Schmerzsignalwegen beteiligt und beide werden in sensorischen Neuronen reichlich exprimiert (
Allouiet al., 2006
;
Marsh et al., 2012
).Im Gegensatz dazu wurden die TASK-1-Kanäle durch Treprostinil nicht gehemmt. TASK-1-Kanäle werden in menschlichen PASMCs stark exprimiert und spielen eine Rolle bei der Regulierung des Ruhemembranpotentials dieser Zellen (
Olschewski et al., 2006
). Es wurde gezeigt, dass die Herunterregulierung, Hemmung oder Inaktivierung von Mutationen von TASK-1-Kanälen zu einem schädlichen Gefäßumbau im Phänotyp der PAH-Krankheit beiträgt (
Ma et al., 2013
;
Boucherat et al., 2015
;
Antigny et al., 2016
;
Navas et al ., 2017
;
Cunningham et al., 2019
), während sich pharmakologische Interventionen, die den TASK-1-Kanalstrom verstärken, als vorteilhaft bei der PAH-Behandlung erwiesen haben (
Olschewski et al., 2006
;
Ma et al., 2013
;
Antigny et al., 2016
;
Cunningham et al., 2019
). Es wurde zuvor gezeigt, dass Treprostinil den TASK-1-Kanalstrom indirekt über einen Proteinkinase-A-abhängigen Weg verstärkt (
Olschewski et al., 2006
). Dies stimmt mit den hier erhaltenen Daten überein, wo festgestellt wurde, dass eine verlängerte Inkubation in Treprostinil eine Verstärkung des Stroms durch TASK-1-Kanäle induziert.Regulierung der TREK-Kanäle durch TreprostinilEin Unterscheidungsmerkmal von K2P-Kanälen ist das Vorhandensein einer extrazellulären Kappendomäne, die die Bildung von zwei tunnelartigen Seitenportalen bewirkt, die eine bilaterale extrazelluläre Ionenleitung vom Selektivitätsfilter ermöglichen (
Brohawn et al., 2013
;
Dong et al., 2015
) . Dieses strukturelle Merkmal liegt der Unempfindlichkeit von K2P-Kanälen gegenüber klassischen K-Kanal-Porenblockern wie TEA zugrunde (
Brohawn et al., 2012
;
Miller und Long, 2012
). Einige kleine Moleküle wie Rutheniumrot und Zink üben ihre hemmende Wirkung über Stellen an der extrazellulären Kappe von TASK-Kanälen aus (
Czirják und Enyedi, 2003
;
Musset et al., 2006
;
Clarke et al., 2008
). In jüngerer Zeit wurde gezeigt, dass die extrazelluläre Kappe in TREK-Kanälen wichtig ist, um die Wirkung kleiner Liganden wie TKDC und Rutheniumrot über allosterische Konformationsänderungen der bilateralen Seitenportale zu übertragen, die anschließend die Ionenleitung unterbrechen (
Braun et al., 2015
;
Luo et al., 2017
). Um den molekularen Mechanismus aufzuklären, durch den Treprostinil TREK-Kanäle hemmt, untersuchten wir seine Wirkung auf drei identifizierte Mutationen in der extrazellulären Kappe, die sich als wichtig für die TKDC-Bindung an TREK-1-Kanäle erwiesen haben (
Luo et al., 2017
). Überraschenderweise veränderte keine dieser Mutationen die hemmende Wirkung von Treprostinil auf TREK-1-Kanäle, was darauf hindeutet, dass Treprostinil seine Wirkung nicht durch Bindung an diese Region der extrazellulären Kappe ausübt und den Ionenleitungsweg des Kanals blockiert.Ein weiterer TREK-Kanal-Antagonist und Antidepressivum, Norfluoxetin (
Kennard et al., 2005
), übt seine Wirkung durch Bindung an ein hochkonserviertes Fenster neben dem Porenfiltereingang von TREK-2 aus (
Dong et al., 2015
). Kontaktpunkte für Norfluoxetin auf TREK-2 wurden in der TM4-Region des Kanals identifiziert, und es wurde festgestellt, dass die Mutation von L320 die Norfluoxetin-Hemmung von TREK-2 reduziert (
Dong et al., 2015
). Die äquivalente Aminosäure am TM4 von TREK-1, L289, wurde auch als Kontaktpunkt für den TREK-1-Agonisten BL-1249 identifiziert, dessen Mutation die Wirksamkeit der Verbindung verringerte (
Schewe et al., 2019
). Wir haben festgestellt, ob Treprostinil seine hemmende Wirkung über die äquivalenten Aminosäuren auf die Intramembranfenster von TREK-1 und TREK-2 ausübt, Mutationen von Antagonistenstellen in der TM4-Region von TREK-1 und TREK-2 jedoch nicht Treprostinil-Hemmung der Kanäle verändern. Dies würde bedeuten, dass Treprostinil nicht an dieselbe Stelle auf TREK-Kanälen bindet wie Norfluoxetin.
Lolicatoet al. (2017)
zeigten, dass zwei niedermolekulare Aktivatoren von TREK-Kanälen, ML335 und ML402, in der Lage waren, das C-Typ-Gate unabhängig von der TM4-Region des Kanals zu beeinflussen, indem sie direkt an das C-Typ-Gate binden, was die „kryptische Selektivität“ prägte -Filterbindungsstelle “ (
Lolicato et al., 2017
). Ein Lysin in TREK-1 (K271) wurde als eine wichtige Interaktionsstelle für diese Verbindungen und essentiell für die Aktivierung identifiziert (
Lolicato et al., 2017
). Die Mutation des äquivalenten Lysins in TREK-2 (K302Q) veränderte die Wirkung von Treprostinil nicht.Ein Tyrosin in der TM4-Region (Y270 in der hier verwendeten TREK-1-Isoform) hat sich kürzlich als wichtig für die Regulierung der Wirksamkeit eines Anti-Nozizeptor-Aktivators, C3001a, erwiesen (
Qiu et al., 2020
). Wir fanden jedoch heraus, dass diese Mutation einen vernachlässigbaren Strom bei –40 mV in Abwesenheit einer hohen Konzentration eines TREK-1-Kanalaktivators trug und konnten daher nicht testen, ob sie die Treprostinil-Hemmung störte.Abschwächung der Treprostinil-Hemmung der TREK-KanäleDas C-Typ-Selektivitätsfiltergate ist hochempfindlich gegenüber intrazellulären Modulatoren wie Hitze, mechanischer Belastung und intrazellulärer Azidose (
Patel et al., 1998
.;
Maingret et al., 1999
;
Bagriantsev et al., 2011
;
Piechotta et al., 2011
;
Mathie et al., 2021b
) und extrazelluläre Regulatoren wie Protonierung (
Cohen et al., 2008
;
Sandoz et al., 2009).
). Eine Reihe von Aminosäuren in der porenauskleidenden TM4-Helix von TREK-1 in der Nähe des Selektivitätsfilters wurden als wichtig für die Regulierung des Kanalgatings identifiziert. Die Mutation dieser Aminosäuren führt zu einem GOF, das wiederum die Kanalsteuerung und -regulierung durch externe und interne Regulatoren stört (
Bagriantsev et al., 2011
;
Bagriantsev et al., 2012
;
Veale et al., 2014
). Wir haben zuvor gezeigt, dass ein Tyrosin an Position 284 in TREK-1 einen GOF verursacht, der die Aktivierung durch das Fenamat, Flufenaminsäure und durch BL-1249 erheblich verringert, wodurch die Ligandenwirksamkeit verringert wird (
Veale et al., 2014
). Dieser Tyrosinrest, der sich innerhalb des „Scharniers“ der TM4-Domäne von TREK-Kanälen befindet, einem kritischen Bereich, der an der Bewegung dieser Kanäle zwischen verschiedenen „Up“- und „Down“-Zuständen beteiligt ist (
Dong et al., 2015
), wurde gezeigt um die Empfindlichkeit der Kanäle gegenüber Dehnung zu verändern, Norfluoxetin und BL-1249 (
McClenaghan et al., 2016
;
Aryal et al., 2017
;
Schewe et al., 2019
). Die Mutation dieser Aminosäure in TREK-2 (Y315A,
Dong et al., 2015
) versetzt den Kanal in einen aktivierten Zustand mit erhöhten makroskopischen Strömen und einer höheren Resting-Open-Wahrscheinlichkeit (P o ) (
McClenaghan et al., 2016
;
Proks et Al., 2020
). Es wurde auch gezeigt, dass diese Region bei der Bindung sowohl von Kanalaktivatoren als auch von Inhibitoren in anderen K-Kanälen wichtig ist (
Hosaka et al., 2007
;
Perry et al., 2010
;
Garg et al., 2011
). Interessanterweise fanden wir heraus, dass die äquivalente Y284A-GOF-Mutation von TREK-1 die Wirkung von Treprostinil auf diese Kanäle signifikant abschwächte, was darauf hindeutet, dass Treprostinil bei der Hemmung dieser Kanäle viel weniger effizient war, wenn es offen war (
McClenaghan et al., 2016
;
Proks et al., 2020
). Obwohl Treprostinil nicht an die gleiche Stelle bindet wie Norfluoxetin, ist die Blockierung durch Treprostinil daher auch vom Gating-Zustand abhängig und effektiver, wenn sich die TREK-Kanäle in ihrem niedrigeren offenen Wahrscheinlichkeitszustand befinden, der dadurch gekennzeichnet ist, dass die TM4-Regionen der Kanäle in ihrem " down“-Konformation (
Dong et al., 2015
;
McClenaghan et al., 2016
). Daher wird die Wirkung von Treprostinil durch „C-Typ“-Selektivitätsfilter-Gating des Kanals beeinflusst (
Chemin et al., 2005
;
Bagriantsev et al., 2011
;
Bagriantsev et al., 2012
;
Dong et al., 2015
;
McClenaghanet al., 2016
). Es ist von Interesse, dass die Hemmung von TREK-1 (∼75 %) und TREK-2 (∼55 %) durch Treprostinil unvollständig ist, was mit dem Vorhandensein mehrerer Gating-Zustände von TREK-Kanälen übereinstimmt (
McClenaghan et al., 2016
). von denen eines oder mehrere resistent gegenüber einer Blockierung durch die Verbindung sind.Da das Gating des Kanals die Treprostinil-Hemmung beeinflusste, stellten wir fest, ob das „Öffnen“ des Kanals mit einem pharmakologischen Aktivator, BL-1249 (
Tertyshnikova et al., 2005
;
Veale et al., 2014
), auch die hemmende Wirkung von Treprostinil abschwächen würde. Wir fanden heraus, dass die Voranwendung von BL-1249 sowohl auf die TREK-1- als auch auf die TREK-2-Kanäle tatsächlich die Hemmung durch Treprostinil abschwächte, wie wir bei der GOF-Mutation gesehen haben. Tatsächlich war der durch Treprostinil gehemmte Strom größer als der Ausgangsstrom der ursprünglichen Ausgangslinie vor der Behandlung mit BL-1249. Es wurde gezeigt, dass die BL-1249-Voraktivierung des TREK-1-Stroms die Wirkung des Inhibitors Spadin antagonisiert (
Ma und Lewis, 2020
), ein ähnlicher Effekt wie bei TREK-2-Strom mit dem Aktivator ML335 und dem Inhibitor Norfluoxetin (
Lolicato et al., 2017
;
Proks et al., 2020
).Angesichts der Tatsache, dass TREK-Kanäle bekanntermaßen an der akuten Nozizeption beteiligt sind, ist es möglich, dass die Hemmung der TREK-Kanäle durch Treprostinil für die subkutanen Schmerzen bei PAH-Patienten verantwortlich ist. Dies ähnelt dem akuten Schmerz, der durch Oxaliplatin bei der Anwendung in der Krebstherapie ausgelöst wird (
Poupon et al., 2018
), was auf eine Herunterregulierung der TREK- und TRAAK-Kanäle zurückzuführen ist (
Pereira et al., 2021
). Die mittlere Plasmakonzentration von Treprostinil bei Patienten beträgt etwa 10–20 ng/ml (25–50 nM) und liegt damit im Bereich der IC 50s hier für einen Block von TREK-1- und TREK-2-Kanälen. An der Stelle der subkutanen Injektion wäre diese Konzentration jedoch höher und könnte eine wesentliche Blockierung der TREK-Kanäle verursachen. Die starken antinozizeptiven Vorteile der pharmakologisch hochregulierten TREK-1- und TREK-2-Kanäle wurden kürzlich in vivo mit einer Reihe von substituierten Acrylsäure-Analoga und C3100a gezeigt (
Vivier et al., 2017
;
Qiu et al., 2020
). In ähnlicher Weise kann die Aktivierung von TREK-Kanälen durch Riluzol die durch Oxaliplatin induzierten neuropathischen Schmerzen überwinden (
Poupon et al., 2018
). Es wird vorgeschlagen, dass die Verwendung eines spezifischen Aktivators von TREK-Kanälen, der topisch angewendet wird, möglicherweise eine sichere therapeutische Strategie zur Überwindung der unerträglichen Schmerzen bietet, die bei Patienten auftreten, die eine Treprostinil-Injektion erhalten.







OMNIA TEMPUS HABENT
Diagnose IPAH im Februar 2013, in Behandlung bei OA Dr. Ulrich Krüger, jetzt Dr. Fischer Herzzentrum Duisburg, Medikamente: Sildenafil, Bosentan jetzt Macitentan, Subkutane Treprostinilpumpe, seit Januar 2024 getunnelter ZVK mit externer Pumpe (Groshongkatheter), 24/7 Sauerstoff, Marcumar, Diuretika
Bitte Anmelden oder Registrieren um der Konversation beizutreten.




