- Beiträge: 1748
Sidebar
Die Rolle von Darm- und Atemwegsmikrobiota bei PAH
18 Sep 2022 13:29 #1606
von danny
OMNIA TEMPUS HABENT
Diagnose IPAH im Februar 2013, in Behandlung bei OA Dr. Ulrich Krüger, jetzt Dr. Fischer Herzzentrum Duisburg, Medikamente: Sildenafil, Bosentan jetzt Macitentan, Subkutane Treprostinilpumpe, seit Januar 2024 getunnelter ZVK mit externer Pumpe (Groshongkatheter), 24/7 Sauerstoff, Marcumar, Diuretika
Die Rolle von Darm- und Atemwegsmikrobiota bei PAH wurde erstellt von danny
www.frontiersin.org/articles/10.3389/fmicb.2022.929752/fullDie pulmonale arterielle Hypertonie (PAH) ist eine schwere klinische Erkrankung, die pathologisch durch eine perivaskuläre Entzündung und einen pulmonalen Gefäßumbau gekennzeichnet ist, der letztendlich zu einer Rechtsherzinsuffizienz führt. Gegenwärtige Behandlungen konzentrieren sich jedoch auf die Kontrolle der Vasokonstriktion und haben nur geringe Auswirkungen auf die Umgestaltung der Lungengefäße. Bessere Therapien der PAH erfordern ein besseres Verständnis ihrer Pathogenese. Mit Fortschritten in der Sequenzierungstechnologie haben Forscher begonnen, sich auf die Rolle der menschlichen Mikrobiota bei Krankheiten zu konzentrieren. Jüngste Studien haben gezeigt, dass die Darm- und Atemwegsmikrobiota und ihre Metaboliten eine wichtige Rolle bei der Pathogenese von PAH spielen. In dieser Übersicht fassen wir die aktuelle Literatur zur Beziehung zwischen Darm- und Atemwegsmikrobiota und PAH zusammen. Wir diskutieren weiter die wichtigsten Wechselwirkungen zwischen der Darmmikrobiota und der Lunge im Zusammenhang mit PAH und die mögliche Verbindung zwischen Darm- und Atemwegsmikrobiota bei der Pathogenese von PAH. Darüber hinaus diskutieren wir das Potenzial der Nutzung der Mikrobiota als neues Ziel für die PAH-Therapie. EinführungDie pulmonale arterielle Hypertonie (PAH) ist eine Gruppe von Krankheiten, die durch einen fortschreitenden Anstieg des Drucks in der Pulmonalarterie gekennzeichnet sind, der zu irreversibler Rechtsherzinsuffizienz führen kann. Der Pulmonalarteriendruck von 25 mmHg oder höher wurde als pulmonale arterielle Hypertonie definiert (
Poch und Mandel, 2021
). Die pulmonale arterielle Hypertonie wird weiter klassifiziert als idiopathische, hereditäre, medikamenteninduzierte und krankheitsbedingte PAH (
Sockrider, 2021
). Heterozygote Mutationen im Bone Morphogenetic Protein Receptor 2 (BMPR2) wurden bei 53–86 % der Fälle von hereditärer pulmonaler arterieller Hypertonie und bei 14–35 % der Patienten mit idiopathischer PAH berichtet (
Gräf et al., 2018
). Darüber hinaus können krankheitsbedingte PAH wie angeborene Herzfehler, Bindegewebserkrankungen, HIV und Bilharziose eine Zerstörung oder Verengung der Lungenarterien verursachen, was zu einem erhöhten Lungenarteriendruck führt (
Ruopp und Cockrill, 2022
). Die Prävalenz von PAH wird in den Vereinigten Staaten und Europa mit 15–50 pro Million angegeben (
Beshay et al., 2020
). Eine systematische Übersicht aus mehreren nationalen Publikationen berichtet, dass die Inzidenz von PAH bei Erwachsenen ≈5,8 pro Million und die Prävalenz von PAH ≈47,6–54,7 pro Million beträgt (
Leber et al., 2021
). Gegenwärtig basieren die meisten epidemiologischen Daten zu PAH auf Studien zu ihrer Ätiologie und variieren zwischen verschiedenen Regionen der Welt. PAH hat eine geringe Inzidenz, aber schwerwiegende Folgen. Die meisten Patienten mit PAH bleiben unheilbar. Daher ist es wichtig, neue potenzielle Behandlungen für PAH zu finden.In den letzten Jahren konzentrierten sich die Forscher zunehmend auf die Mikroben-Wirt-Interaktionen. Die Mikrobiota besteht aus komplexen Gemeinschaften von Bakterien, Archaeen, Pilzen, Viren und Protisten, die mehrere Teile des Körpers besiedeln, wie den Magen-Darm-Trakt, den Mund, die Haut und den Urogenitaltrakt (
Stappenbeck und Virgin, 2016
). Dysbiose, definiert als ein Ungleichgewicht in der Zusammensetzung der Mikrobiota, wurde mit mehreren Krankheiten in Verbindung gebracht, darunter chronisch obstruktive Lungenerkrankung, Bluthochdruck, Herzinsuffizienz, Fettleibigkeit und entzündliche Darmerkrankungen et al. (
Halfvarson et al., 2017
;
Li et al., 2017
;
Callejo et al., 2018
;
Cui et al., 2018
;
Bowerman et al., 2020
;
Kim MH et al., 2020
). Außerdem wurde bei Patienten mit PAH eine Dysbiose der Darm- und Atemwegsmikrobiota beobachtet (
Kim S. et al., 2020
). Sowohl der Darm als auch die Lunge sind wichtige Organe in direkter Kommunikation mit der Außenwelt; sie haben denselben embryonalen Ursprung und strukturelle Ähnlichkeiten. Daher ist es nicht verwunderlich, dass diese beiden Orte möglicherweise Wechselwirkungen bei der Entstehung von Gesundheit und Krankheit haben, die genauen Mechanismen jedoch nicht bekannt sind. Tatsächlich wurde gezeigt, dass es eine Wechselwirkung zwischen der Darmmikrobiota und der Lunge gibt, und die Verbindung wurde als Darm-Lungen-Achse bezeichnet (
He et al., 2017
). Es wurde berichtet, dass Lipopolysaccharide (LPS) und kurzkettige Fettsäuren (SCFAs), die von Darmmikroorganismen produziert werden, eine wichtige Rolle bei der Regulierung des Immuntonus in der Lunge spielen (
Liu et al., 2021
). Andererseits wurde nachgewiesen, dass Lungeninfektionen bei Mäusen auch Darmdysbiose verursachen (
Groves et al., 2018
). Jüngste Studien haben ergeben, dass Veränderungen in der Struktur und Funktion der Darm- und Atemwegsmikrobiota mit PAH assoziiert sind (
Kim S. et al., 2020
;
Zhang et al., 2020
). In dieser Übersicht geben wir einen Überblick über die bei PAH berichteten mikrobiellen Veränderungen im Darm und in den Atemwegen. Dann werden wir die mechanistischen Beweise diskutieren, die die Zusammenhänge zwischen Dysbiose in Darm- und Atemwegsmikrobiota und PAH erklären. Darüber hinaus werden wir auf die Möglichkeit hinweisen, das Mikrobiom und seine verwandten Komponenten als neue Therapieoption für PAH anzugreifen.Entzündung bei PAHDas charakteristische pathologische Merkmal von PAH ist der pulmonale Gefäßumbau, der alle Schichten der Gefäßwand betrifft, wie Intima (Endothelzellen), Media (glatte Muskelzellen der Pulmonalarterie – PASMCs) und Adventitia (Fibroblasten) (
Thenappan et al., 2018
) . Die Hyperproliferation von Gefäßzellen und die Ablagerung der extrazellulären Matrix führt zu einer Verdickung der Arterienwand und einer Muskulatur kleiner nichtmuskulärer Arterien und einer Verringerung der Compliance der Lungengefäße (
Thenappan et al., 2018
). Es gibt zunehmend Hinweise darauf, dass die pulmonale perivaskuläre Entzündung eine wichtige Rolle in den frühen Stadien der PAH oder des pulmonalen Gefäßumbaus spielt. Eine signifikant erhöhte Infiltration von Makrophagen, Mastzellen, T-Lymphozyten, B-Lymphozyten, dendritischen Zellen und Monozyten wurde in den Lungengefäßen von Patienten mit PAH gefunden und hat einen entscheidenden Einfluss auf die pulmonale perivaskuläre Entzündung und pathologische Prozesse der PAH (
Savai et al ., 2012
;
Zhu et al., 2021
;
Wang et al., 2022
). Erhöhte Makrophagen, Mastzellen und B-Zellen könnten Entzündungsreaktionen und den Umbau der Lungengefäße bei PAH beschleunigen (
Ni et al., 2022
). Dementsprechend wurde beobachtet, dass die Expressionsniveaus verschiedener Cytokine und Chemokine bei PAH-Patienten und Tiermodellen erhöht sind. Über eine erhöhte Expression von Interleukin (IL)-1β, IL-6, IL-1-Rezeptor (R)1 und IL6R und deren Rolle beim pulmonalen Gefäßumbau wurde bei Patienten mit idiopathischer PAH und Hypoxie-induzierter PAH bei Mäusen berichtet (
Parpaleix et al ., 2016
;
Tamura et al., 2018
). Bei durch Hypoxie induzierten PAH-Mäusen bindet IL-33, ein Mitglied der IL-1-Familie von Zytokinen, an die Membranrezeptoren ST2 und initiiert den pulmonalen Gefäßumbau, indem es die Expression des Hypoxie-induzierbaren Faktors 1α (HIF-1α) hochreguliert. und vaskulärer endothelialer Wachstumsfaktor (VEGF) (
Liu et al., 2018
). Abid et al. fanden heraus, dass die Expression von Chemokinrezeptor (CCR) 2 und CCR5 in PASMCs und perivaskulären Makrophagen von PAH-Patienten erhöht war und das Wachstum von PASMCs förderte (
Abid et al., 2019
). Die Expression von High Mobility Group Box-1 (HMGB1) und Toll-like-Rezeptor 4 (TLR4) war in den Lungen von PAH-Patienten signifikant erhöht, und HMGB1 förderte PAH durch Aktivierung von TLR4 (
Ranchoux et al., 2017
;
Goldenberg et al ., 2019
). Darüber hinaus ist die endotheliale Dysfunktion ein wichtiger pathophysiologischer Mechanismus von PAH, der aus der veränderten Produktion von endothelialen vasoaktiven Mediatoren resultiert. Die Expression von interzellulärem Zelladhäsionsmolekül-1, vaskulärem Zelladhäsionsmolekül-1 (VCAM-1) und E-Selektin ist in den Lungenarterien von idiopathischen PAH-Patienten signifikant hochreguliert (
Le Hiress et al., 2015
). Mit einem Wort, diese Daten deuten stark darauf hin, dass perivaskuläre Entzündung und Lungengefäßumbau eine wichtige Rolle bei der Entwicklung von PAH spielen. Die spezifischen Mechanismen, die perivaskuläre Entzündungen und pulmonalvaskulären Umbau verursachen, werden jedoch noch erforscht, und neuere Studien haben begonnen, sich auf die Rolle von Mikroorganismen und ihren Metaboliten bei PAH zu konzentrieren.Darm-Lungen-Achse bei PAHDer Großteil der Mikrobiota ist im Darmtrakt angesiedelt, der normalerweise von fünf Bakterienstämmen wie Bacteroidetes, Firmicutes, Proteobacteria, Actinobacteria und Tenericutes dominiert wird (
Stappenbeck und Virgin, 2016
;
Almeida et al., 2019
). Von diesen sind Firmicutes und Bacteroidetes die beiden häufigsten Phyla und machen mehr als 90 % der Darmmikrobiota aus. Es wurde berichtet, dass das Firmicutes/Bacteroides -Verhältnis, ein klassischer Biomarker für Dysbiose, bei Personen mit Fettleibigkeit, Diabetes und Herz-Kreislauf-Erkrankungen erhöht ist (
Mariat et al., 2009
;
Koliada et al., 2017
;
Tsai et al., 2021
). Der Anteil an intestinalem F/B war in den meisten Sugen/Hypoxie-, Monocrotalin (MCT)- oder Hypoxie-induzierten PAH-Tiermodellen höher (
Callejo et al., 2018
;
Sanada et al., 2020
;
Sharma et al., 2020b
;
Hong et al., 2021
;
Luo et al., 2021
). Kimet al. verglichen das fäkale Mikrobiom von PAH-Patienten und Referenzsubjekten durch Shotgun-Metagenomik und berichteten über eine unterschiedliche Zusammensetzung des Darmmikrobioms bei den PAH-Patienten mit reduzierter Alpha-Diversität, Reichhaltigkeit und Gleichmäßigkeit (
Kim S. et al., 2020
). Im Gegensatz dazu haben Sharma et al. berichteten, dass das F/B -Verhältnis bei reinen Hypoxie-induzierten PAH-Mäusen verringert war (
Sharma et al., 2020a
). In einer Pilotstudie des Darmmikrobioms bei 20 PAH-Patienten und 20 gepaarten Kontrollpersonen wurden jedoch keine Unterschiede in der mikrobiellen Häufigkeit und Diversität bei PAH-Patienten ohne signifikante Unterschiede in der Alpha-Diversität, Beta-Diversität und dem F/B -Verhältnis berichtet (
Jose et al., 2022
). Mehrere Faktoren können zu diesen widersprüchlichen Ergebnissen beitragen. Erstens ist die Pilotstudie eine paarweise kontrollierte prospektive Kohortenstudie, und eine Vielzahl potenziell verwirrender Faktoren wie Fettleibigkeit, Nahrungsaufnahme, Umweltfaktoren und zirkadianer Rhythmus wurde durch die Verwendung eines paarweisen Registrierungsschemas streng kontrolliert. Darüber hinaus waren die Stichprobengrößen in diesen beiden Studien zur menschlichen Darmmikrobiota begrenzt, und folglich waren diese Studien zu schwach, um einen Unterschied in der Diversität der Darmmikrobiota bei PAH-Patienten nachzuweisen.Verringerte SCFA-produzierende Bakterien könnten einer der wichtigsten Hinweise auf die Rolle der Dysbiose der Darmmikrobiota im PAH-Prozess sein. Niedrigere Raten von Butyrat-produzierenden Bakterien ( Coprococcus, Butyrivibrio, Lachnospiraceae und Eubacterium ) und Propionat-produzierenden Bakterien ( Akkermansia und Bacteroides ) bei PAH-Patienten (
Kim S. et al., 2020
;
Jose et al., 2022
) (
Tabelle 1
). In ähnlicher Weise war die Häufigkeit von Akkermansia und Bacteroides bei Sugen/Hypoxie-Ratten im Vergleich zur Kontrollgruppe reduziert (
Sanada et al., 2020
). SCFAs haben nachweislich entscheidende Auswirkungen auf die Immunantwort des Wirts und die Entzündungsregulation (
Kemter und Nagler, 2019
). SCFAs können G-Protein-gekoppelte Rezeptoren (GPCRs, wie GPR43, GPR41 und GPR109a) aktivieren oder als Histon-Deacetylase (HDAC)-Inhibitoren wirken, um die Produktion von regulatorischen T-Zellen (Tregs) durch epigenetische Modifikationen zu fördern (
Arpaia et al., 2013
;
Smith et al., 2013
;
Trompette et al., 2014
); und Tregs können das vaskuläre Endothel vor PAH schützen (
Tamosiuniene et al., 2011
). Liuet al. fanden heraus, dass GPR43 und GPR41 in menschlichen Alveolar-Primärzellen exprimiert und durch aus dem Darm stammendes LPS reguliert werden, und verifizierten direkt die Übertragung von LPS und SCFA vom Darm in die Lunge unter Verwendung keimfreier Mäuse (
Liu et al., 2021
). Es wird berichtet, dass die Behandlung mit Butyrat den durch Hypoxie induzierten Anstieg von CD68+- und CD163+-Makrophagen in den Lungen von PAH-Ratten umkehren kann (
Karoor et al., 2021
). Butyrat übt auch seine entzündungshemmende Wirkung aus, indem es die Entwicklung von T-Helfer 17 (Th17)-Zellen hemmt und VCAM-1 und CX3C-Chemokin Fractalkine in Endothelzellen herunterreguliert (
Li et al., 2018
;
Chen et al., 2019
;
Karoor et al., 2021
). Neben der Immunregulation haben Karoor und Kim et al. fanden heraus, dass Butyrat die durch Hypoxie induzierte Angiogenese hemmte, indem es die Expression von VEGF-α und HIF-1α verringerte (
Kim et al., 2007
;
Karoor et al., 2021
). Darüber hinaus spielt Butyrat eine bedeutende Rolle bei der Aufrechterhaltung der Integrität der pulmonalen mikrovaskulären Endothel- und Magen-Darm-Barriere (
Plöger et al., 2012
;
Karoor et al., 2021
). Umgekehrt erhöht die Anreicherung der Collinsella im Darm von PAH-Patienten die Darmpermeabilität durch Herunterregulieren von Tight-Junction-Proteinen und fördert die Produktion von epithelialem IL-17A (
Kim et al., 2018
;
Kim S. et al., 2020
). Serotonin (5-HT), ein Schlüsselmediator von PAH, wurde mit dem PAH-Phänotyp von BMPR2-defizienten Mäusen in Verbindung gebracht, indem es die BMP-Signalgebung hemmte, die Kontraktion der Lungenarterien verstärkte und die PASMC-Proliferation förderte (
Long et al., 2006
;
Hood et al. , 2017
). Es wurde festgestellt, dass SCFAs die Tryptophan-Hydroxylase-1-Transkription fördern und die 5-HT-Produktion in humanen enterochromaffinen Zellen erhöhen (
Reigstad et al., 2015
). Darüber hinaus kann ein verringerter Anteil von Lactobacillus bei PAH-Patienten und Tiermodellen auch die 5-HT-Synthese fördern (
Sharma et al., 2020a
).Tabelle 1
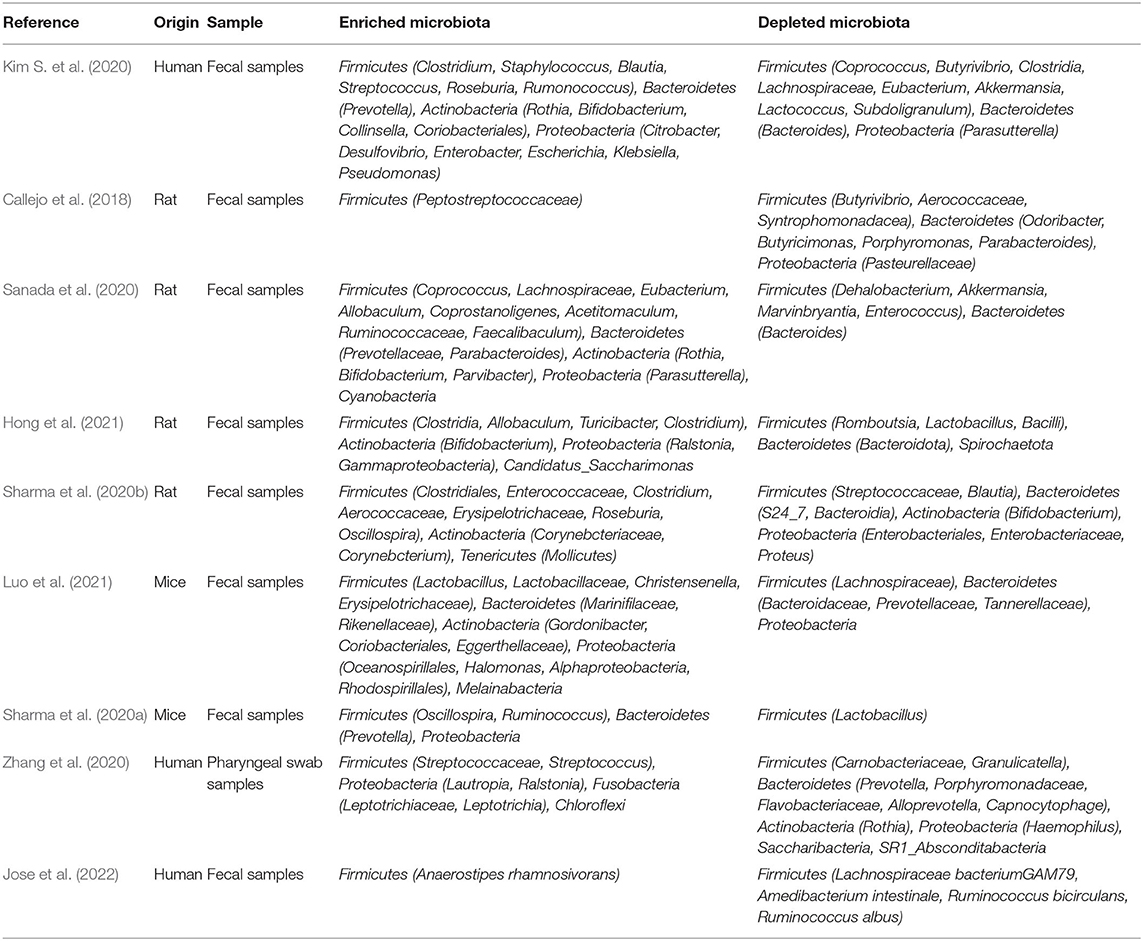 TABELLE 1 . Veränderungen der Mikrobiota bei PAH. Trimethylamin (TMA) wird ursprünglich von Darmbakterien als Nebenprodukt des Stoffwechsels von Nahrungsnährstoffen wie Cholin erzeugt, und TMA wird oxidiert, um Trimethylamin-N-oxid (TMAO) zu produzieren (
Hayase und Jenq, 2020
). Es wurde berichtet, dass TMAO mit der Entwicklung von Arteriosklerose in Verbindung gebracht wird (
Hayase und Jenq, 2020
). In einer Metaanalyse von 923 Patienten mit hohem/sehr hohem Risiko für Herz-Kreislauf-Erkrankungen wurde festgestellt, dass hohe TMAO-Spiegel ein möglicher Risikofaktor für Herz-Kreislauf-Erkrankungen sind (
Guasti et al., 2021
). Ein höherer Anteil an TMA/TMAO-produzierenden Darmbakterien wurde bei PAH-Patienten und Tiermodellen beobachtet, wie zClostridium, Desulfovibrio, Enterobacter, Escherichia, Klebsiella, Pseudomonas, Rothia, Prevotella, Clostridium, Staphylococcus, Streptococcus, Anaerostipes rhamnosivorans und Collinsella (
Kim S. et al., 2020
;
Sharma et al., 2020b
;
Jose et al., 2022
) (
Tabelle 1
). Die Expressionsniveaus von TMAO und Tumornekrosefaktor-α und IL-1β im Plasma von Mäusen, die mit der westlichen Diät (ein Risikofaktor für PAH) gefüttert wurden, waren signifikant erhöht, während die Expression des entzündungshemmenden Zytokins IL-10 verringert war, und diese Veränderung wurde durch den Inhibitor der Trimethylaminbildung rückgängig gemacht (
Chen K. et al., 2017
;
Brittain et al., 2019
). Lawrieet al. fanden weiter heraus, dass Mäuse, die mit Paigen-Diät (fettreich und cholesterinreich) gefüttert wurden, PAH in Abhängigkeit von IL-1 β entwickelten, was darauf hindeutet, dass TMAO die Entwicklung von PAH durch die entzündungsfördernde Wirkung von Zytokinen wie IL-1 β fördern könnte (
Lawrie et al., 2011
). Kürzlich wurde festgestellt, dass TMAO eine endotheliale Dysfunktion durch Aktivierung des Hypoxie-induzierten Proteinkinase C (PKC)/Kernfaktor-kappa B (NF-κ
TABELLE 1 . Veränderungen der Mikrobiota bei PAH. Trimethylamin (TMA) wird ursprünglich von Darmbakterien als Nebenprodukt des Stoffwechsels von Nahrungsnährstoffen wie Cholin erzeugt, und TMA wird oxidiert, um Trimethylamin-N-oxid (TMAO) zu produzieren (
Hayase und Jenq, 2020
). Es wurde berichtet, dass TMAO mit der Entwicklung von Arteriosklerose in Verbindung gebracht wird (
Hayase und Jenq, 2020
). In einer Metaanalyse von 923 Patienten mit hohem/sehr hohem Risiko für Herz-Kreislauf-Erkrankungen wurde festgestellt, dass hohe TMAO-Spiegel ein möglicher Risikofaktor für Herz-Kreislauf-Erkrankungen sind (
Guasti et al., 2021
). Ein höherer Anteil an TMA/TMAO-produzierenden Darmbakterien wurde bei PAH-Patienten und Tiermodellen beobachtet, wie zClostridium, Desulfovibrio, Enterobacter, Escherichia, Klebsiella, Pseudomonas, Rothia, Prevotella, Clostridium, Staphylococcus, Streptococcus, Anaerostipes rhamnosivorans und Collinsella (
Kim S. et al., 2020
;
Sharma et al., 2020b
;
Jose et al., 2022
) (
Tabelle 1
). Die Expressionsniveaus von TMAO und Tumornekrosefaktor-α und IL-1β im Plasma von Mäusen, die mit der westlichen Diät (ein Risikofaktor für PAH) gefüttert wurden, waren signifikant erhöht, während die Expression des entzündungshemmenden Zytokins IL-10 verringert war, und diese Veränderung wurde durch den Inhibitor der Trimethylaminbildung rückgängig gemacht (
Chen K. et al., 2017
;
Brittain et al., 2019
). Lawrieet al. fanden weiter heraus, dass Mäuse, die mit Paigen-Diät (fettreich und cholesterinreich) gefüttert wurden, PAH in Abhängigkeit von IL-1 β entwickelten, was darauf hindeutet, dass TMAO die Entwicklung von PAH durch die entzündungsfördernde Wirkung von Zytokinen wie IL-1 β fördern könnte (
Lawrie et al., 2011
). Kürzlich wurde festgestellt, dass TMAO eine endotheliale Dysfunktion durch Aktivierung des Hypoxie-induzierten Proteinkinase C (PKC)/Kernfaktor-kappa B (NF-κ /VCAM-1-Signalwegs sowie der HMGB1/TLR4-Achse verursacht (
Ma et al., 2017
;
Singh et al., 2019
). Chenet al. berichteten, dass TMAO auch die Pyrindomäne der Nod-ähnlichen Rezeptorfamilie, die das Inflammasom 3 (NLRP3) enthält, über den Sirtuin 3 (SIRT3)/Superoxiddismutase 2 (SOD2)/mitochondrialen ROS-Weg aktivierte, um eine Entzündung in Endothelzellen und Blutgefäßen zu induzieren (
Chen ML et al. , 2017
). Gegenwärtig wurde der Mechanismus der TMAO-induzierenden endothelialen Dysfunktion und vaskulären Entzündung bei Arteriosklerose umfassend untersucht, aber ihre spezifischen Mechanismen bei PAH müssen noch aufgeklärt werden. Darüber hinaus kann ein hoher Anteil an TMAO-produzierenden Darmmikroorganismen auch das Thromboserisiko erhöhen, das eine Schlüsselrolle bei der Entstehung bestimmter PAH-Typen spielt (
Zhu et al., 2016
). TMAO ist jedoch in Meeresfrüchten vorhanden, und eine kürzlich durchgeführte Studie ergab, dass TMAO nicht nur keine Wirkung auf gesunde Ratten hatte, sondern auch die Sterblichkeit bei Ratten mit Herzinsuffizienz verringerte, was den negativen Auswirkungen von TMAO auf Herz-Kreislauf-Erkrankungen widerspricht (
Gawrys-Kopczynska et al., 2020
). Daher sollten weitere Untersuchungen erforderlich sein, um die Auswirkungen von TMA/TMAO, die von Darmmikroben produziert werden, auf PAH zu klären.Erhöhte Harnsäurespiegel und eine verringerte Bioverfügbarkeit von Arginin werden mit der Entwicklung und Prognose von PAH in Verbindung gebracht (
Sztormowska-Achranowicz et al., 2020
;
Savale et al., 2021
). Es wurde berichtet, dass die Behandlung mit dem Xanthinoxidase-Hemmer Benzbromaron und die Nahrungsergänzung mit L-Arginin eine schützende Wirkung gegen PAH haben (
Sztormowska-Achranowicz et al., 2020
). Es wird allgemein angenommen, dass Harnsäure und Arginin aus der Ernährung und der endogenen Synthese stammen; jedoch Kim et al. fanden heraus, dass sie auch von Darmmikroben stammen können. Xanthinoxidase und Purinnukleotidase, Schlüsselenzyme der Harnsäuresynthese und des Purinstoffwechsels, wurden in der Darmmikrobiota von Patienten mit PAH signifikant erhöht gefunden (
Kim S. et al., 2020
). Konsequenterweise sind hohe Harnsäurespiegel im Serum mit einer schlechten Prognose von PAH verbunden, und es wurde nachgewiesen, dass Harnsäure die Proliferation von PASMCs in vitro fördert (
Savale et al., 2021
). Darüber hinaus wurde in der Darmmikrobiota von MCT-induzierten PAH-Ratten und PAH-Patienten ein fehlregulierter Stoffwechsel mehrerer Aminosäuren, wie Arginin, Prolin und Ornithin, gefunden (
Kim S. et al., 2020
;
Hong et al., 2021
). Konsequenterweise wurden Schlüsselbakterien, die zu einer erhöhten Biosynthese von Arginin, Ornithin und Prolin beitragen, wie Blautia, Bifidobakterien und Collinsella , mit PAH angereichert (
Kim S. et al., 2020
;
Hong et al., 2021
) (
Tabelle 1
). Darüber hinaus wandelt eine erhöhte Ornithin-Transcarbamylase in den Darmmikroben von PAH-Patienten L-Ornithin in L-Citrullin um, was zu einer verringerten Bioverfügbarkeit von Arginin führen kann (
Kim S. et al., 2020
;
Sztormowska-Achranowicz et al., 2020
).Darüber hinaus kann eine Dysbiose der Darmmikrobiota die Darmpermeabilität erhöhen, was zu einer Translokation von Bakterien und bakteriellen Metaboliten sowie zu einem Anstieg bakterieller Endotoxine im Plasma führen kann (
Ranchoux et al., 2017
). Endotoxin ist ein Bestandteil der Zellwand von „G-Bakterien“, auch bekannt als LPS, dem Hauptliganden von TLRs. Es wurde gezeigt, dass CD14 die LPS-induzierte TLR4-Endozytose reguliert, und CD14 ist auf der Oberfläche vieler TLR4-exprimierender Zellen vorhanden (
Zanoni et al., 2011
). Ranchouxet al. fanden heraus, dass serumlösliches CD14 bei Patienten mit idiopathischer PAH und hereditärer PAH, die die BMPR2-Mutation trugen, im Vergleich zu Kontrollgruppen offensichtlich höher war (
Ranchoux et al., 2017
). Die akute Exposition von Bmpr2+/–-Mäusen gegenüber LPS induziert PAH, indem sie die ROS-abhängige Produktion von entzündlichen Zytokinen (IL-6 und IL-
/VCAM-1-Signalwegs sowie der HMGB1/TLR4-Achse verursacht (
Ma et al., 2017
;
Singh et al., 2019
). Chenet al. berichteten, dass TMAO auch die Pyrindomäne der Nod-ähnlichen Rezeptorfamilie, die das Inflammasom 3 (NLRP3) enthält, über den Sirtuin 3 (SIRT3)/Superoxiddismutase 2 (SOD2)/mitochondrialen ROS-Weg aktivierte, um eine Entzündung in Endothelzellen und Blutgefäßen zu induzieren (
Chen ML et al. , 2017
). Gegenwärtig wurde der Mechanismus der TMAO-induzierenden endothelialen Dysfunktion und vaskulären Entzündung bei Arteriosklerose umfassend untersucht, aber ihre spezifischen Mechanismen bei PAH müssen noch aufgeklärt werden. Darüber hinaus kann ein hoher Anteil an TMAO-produzierenden Darmmikroorganismen auch das Thromboserisiko erhöhen, das eine Schlüsselrolle bei der Entstehung bestimmter PAH-Typen spielt (
Zhu et al., 2016
). TMAO ist jedoch in Meeresfrüchten vorhanden, und eine kürzlich durchgeführte Studie ergab, dass TMAO nicht nur keine Wirkung auf gesunde Ratten hatte, sondern auch die Sterblichkeit bei Ratten mit Herzinsuffizienz verringerte, was den negativen Auswirkungen von TMAO auf Herz-Kreislauf-Erkrankungen widerspricht (
Gawrys-Kopczynska et al., 2020
). Daher sollten weitere Untersuchungen erforderlich sein, um die Auswirkungen von TMA/TMAO, die von Darmmikroben produziert werden, auf PAH zu klären.Erhöhte Harnsäurespiegel und eine verringerte Bioverfügbarkeit von Arginin werden mit der Entwicklung und Prognose von PAH in Verbindung gebracht (
Sztormowska-Achranowicz et al., 2020
;
Savale et al., 2021
). Es wurde berichtet, dass die Behandlung mit dem Xanthinoxidase-Hemmer Benzbromaron und die Nahrungsergänzung mit L-Arginin eine schützende Wirkung gegen PAH haben (
Sztormowska-Achranowicz et al., 2020
). Es wird allgemein angenommen, dass Harnsäure und Arginin aus der Ernährung und der endogenen Synthese stammen; jedoch Kim et al. fanden heraus, dass sie auch von Darmmikroben stammen können. Xanthinoxidase und Purinnukleotidase, Schlüsselenzyme der Harnsäuresynthese und des Purinstoffwechsels, wurden in der Darmmikrobiota von Patienten mit PAH signifikant erhöht gefunden (
Kim S. et al., 2020
). Konsequenterweise sind hohe Harnsäurespiegel im Serum mit einer schlechten Prognose von PAH verbunden, und es wurde nachgewiesen, dass Harnsäure die Proliferation von PASMCs in vitro fördert (
Savale et al., 2021
). Darüber hinaus wurde in der Darmmikrobiota von MCT-induzierten PAH-Ratten und PAH-Patienten ein fehlregulierter Stoffwechsel mehrerer Aminosäuren, wie Arginin, Prolin und Ornithin, gefunden (
Kim S. et al., 2020
;
Hong et al., 2021
). Konsequenterweise wurden Schlüsselbakterien, die zu einer erhöhten Biosynthese von Arginin, Ornithin und Prolin beitragen, wie Blautia, Bifidobakterien und Collinsella , mit PAH angereichert (
Kim S. et al., 2020
;
Hong et al., 2021
) (
Tabelle 1
). Darüber hinaus wandelt eine erhöhte Ornithin-Transcarbamylase in den Darmmikroben von PAH-Patienten L-Ornithin in L-Citrullin um, was zu einer verringerten Bioverfügbarkeit von Arginin führen kann (
Kim S. et al., 2020
;
Sztormowska-Achranowicz et al., 2020
).Darüber hinaus kann eine Dysbiose der Darmmikrobiota die Darmpermeabilität erhöhen, was zu einer Translokation von Bakterien und bakteriellen Metaboliten sowie zu einem Anstieg bakterieller Endotoxine im Plasma führen kann (
Ranchoux et al., 2017
). Endotoxin ist ein Bestandteil der Zellwand von „G-Bakterien“, auch bekannt als LPS, dem Hauptliganden von TLRs. Es wurde gezeigt, dass CD14 die LPS-induzierte TLR4-Endozytose reguliert, und CD14 ist auf der Oberfläche vieler TLR4-exprimierender Zellen vorhanden (
Zanoni et al., 2011
). Ranchouxet al. fanden heraus, dass serumlösliches CD14 bei Patienten mit idiopathischer PAH und hereditärer PAH, die die BMPR2-Mutation trugen, im Vergleich zu Kontrollgruppen offensichtlich höher war (
Ranchoux et al., 2017
). Die akute Exposition von Bmpr2+/–-Mäusen gegenüber LPS induziert PAH, indem sie die ROS-abhängige Produktion von entzündlichen Zytokinen (IL-6 und IL- im Vergleich zu WT-Mäusen fördert (
Soon et al., 2015
). Es wurde auch berichtet, dass LPS an HMGB1 bindet und TLR4 aktiviert, wodurch Entzündungen und der Umbau von Lungengefäßen gefördert werden (
Ranchoux et al., 2017
). Feng et al. fanden heraus, dass HMGB1 die Proliferation und Migration von PASMCs fördert, indem es die extrazelluläre signalregulierte Kinase 1/2 (ERK1/2)/das Dynamin-verwandte Protein 1 (Drp1)/Autophagie aktiviert, um den BMPR2-Signalweg zu hemmen (
Feng et al., 2021
). Darüber hinaus aktiviert das zuvor erwähnte TMAO HMGB1/TLR4, was zu einer erhöhten endothelialen Permeabilität führt. Dies deutet darauf hin, dass HMGB1 eine wichtige Rolle beim Einfluss von Mikroorganismen auf PAH spielt und möglicherweise ein neues Ziel für die Behandlung von PAH darstellt. Darüber hinaus haben Shrestha et al. fanden heraus, dass LPS synergistisch PAH in Verbindung mit bronchopulmonaler Dysplasie in Versuchsmäusen induzierte, die Hyperoxie ausgesetzt waren (
Shrestha et al., 2020
) (
Abbildung 1
).Abbildung 1
im Vergleich zu WT-Mäusen fördert (
Soon et al., 2015
). Es wurde auch berichtet, dass LPS an HMGB1 bindet und TLR4 aktiviert, wodurch Entzündungen und der Umbau von Lungengefäßen gefördert werden (
Ranchoux et al., 2017
). Feng et al. fanden heraus, dass HMGB1 die Proliferation und Migration von PASMCs fördert, indem es die extrazelluläre signalregulierte Kinase 1/2 (ERK1/2)/das Dynamin-verwandte Protein 1 (Drp1)/Autophagie aktiviert, um den BMPR2-Signalweg zu hemmen (
Feng et al., 2021
). Darüber hinaus aktiviert das zuvor erwähnte TMAO HMGB1/TLR4, was zu einer erhöhten endothelialen Permeabilität führt. Dies deutet darauf hin, dass HMGB1 eine wichtige Rolle beim Einfluss von Mikroorganismen auf PAH spielt und möglicherweise ein neues Ziel für die Behandlung von PAH darstellt. Darüber hinaus haben Shrestha et al. fanden heraus, dass LPS synergistisch PAH in Verbindung mit bronchopulmonaler Dysplasie in Versuchsmäusen induzierte, die Hyperoxie ausgesetzt waren (
Shrestha et al., 2020
) (
Abbildung 1
).Abbildung 1
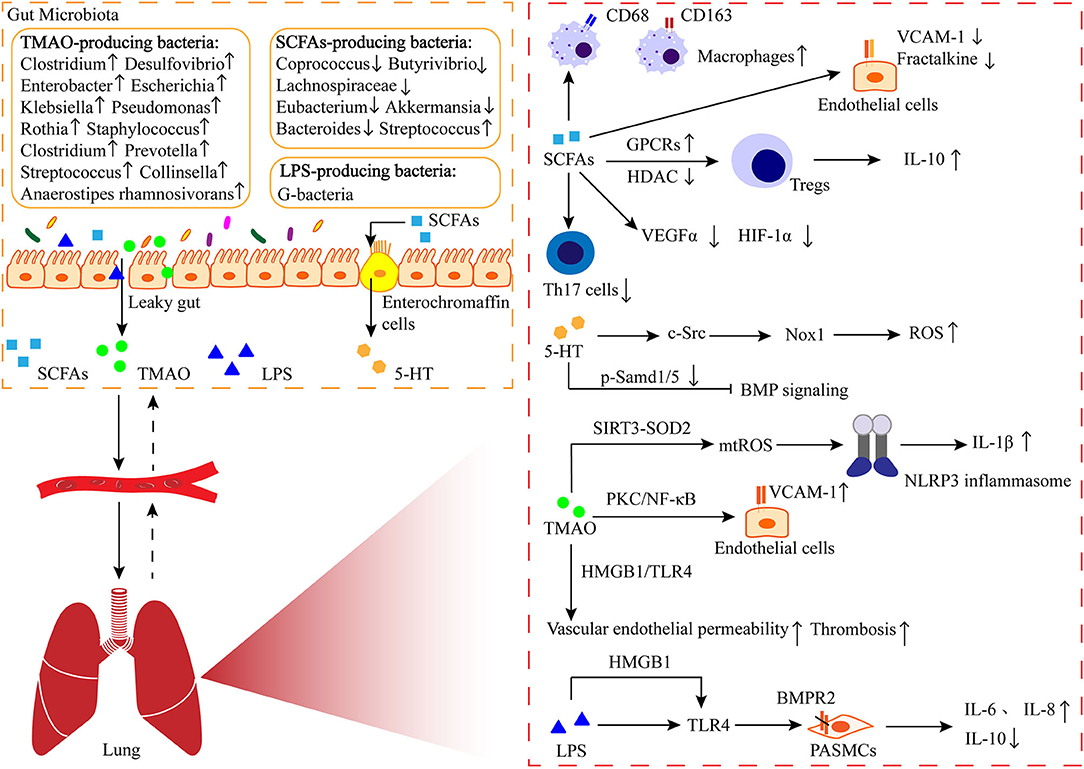 ABBILDUNG 1. Die Darm-Lungen-Achse bei PAH. Die von Darmbakterien produzierten Metaboliten wie kurzkettige Fettsäuren (SCFAs) gelangen über den Kreislauf in die Lunge, wo sie an der Immunregulation beteiligt sind und eine Rolle bei der perivaskulären Entzündung und dem Umbau der Lungengefäße spielen. 5-HT: Serotonin; TMAO: Trimethylamin-N-oxid; LPS: Lipopolysaccharid; GPCRs: G-Protein-gekoppelter Rezeptor; HDAC: Histon-Deacetylase; VCAM-1: vaskuläres Zelladhäsionsmolekül-1; VEGFα: vaskulärer endothelialer Wachstumsfaktor α; HIF-1α: Hypoxie-induzierbarer Faktor-1α; Nox-1: NADPH-Oxidase-1; ROS: reaktive Sauerstoffspezies; SIRT3: Sirtuin 3; SOD2: Superoxiddismutasen; NLRP3: Pyrindomäne der Nod-like-Rezeptorfamilie, die 3 enthält; PKC: Proteinkinase C; NF-κB: Kernfaktor-kappa B; HMGB1: Gruppe Box-1 für hohe Mobilität; TLR4: Toll-like-Rezeptor 4; BMPR2: Bone Morphogenetic Protein Receptor 2. Die in den Atemwegen lebenden Mikrobiota haben einen wichtigen Einfluss auf PAHDas menschliche Atmungssystem besteht aus den oberen Atemwegen (wie Nase, Rachen und Kehlkopf) und den unteren Atemwegen (wie Luftröhre und Bronchien auf allen Ebenen der Lunge). Vor einem Jahrzehnt galten die unteren Atemwege als sterile Umgebung, wahrscheinlich, weil invasive Bronchoskopie normalerweise nicht in gesunden Lungen durchgeführt wurde und Bronchoskopie im Verdacht stand, eine mikrobielle Kontamination aus dem Oropharynx oder der Nasenhöhle zu übertragen. Trotzdem haben Hilty et al. verwendeten 16S-rRNA-Sequenzierung, um das Vorhandensein von Mikrobiota in den unteren Atemwegen aufzudecken, deren Zusammensetzung sich zwischen Patienten mit chronisch obstruktiver Lungenerkrankung und Asthma sowie Referenzkohorten unterschied (
Hilty et al., 2010
). Neuere Studien haben solche Ergebnisse ebenfalls bestätigt und die spezifische Rolle der Atemwegsmikrobiota bei Atemwegserkrankungen aufgeklärt (
Budden et al., 2019
). Die Mikrobiota gesunder Lungen scheint von der Migration der oralen Mikrobiota abzustammen (
Bassis et al., 2015
). Darüber hinaus haben Lunge und Darm ähnliche epitheliale Barrierefunktionen und unterschiedliche Mikrobiota. Die dominanten Phyla der oberen Atemwege, wie Firmicutes, Bacteroidetes, Proteobacteria, Actinobacteria, Fusobacteria und Saccharibacteria , überlappen sich teilweise mit der intestinalen Mikrobiota (
Zhang et al., 2020
). Zhanget al. verglichen die Zusammensetzung der Atemwegsmikrobiota von PAH-Patienten und Referenzsubjekten und stellten fest, dass die Atemwegsmikrobiota von PAH-Patienten eine verringerte Diversität der Gemeinschaft und ein erhöhtes F/B -Verhältnis aufwies (
Zhang et al., 2020
). Die oben genannten Studien deuten darauf hin, dass die mikrobielle Dysbiose der Atemwege eine wichtige Rolle in der Pathogenese der PAH spielt und dass es enge Wechselwirkungen zwischen der Atemwegsmikrobiota und dem pathologischen und pathophysiologischen Prozess der PAH gibt, ein kausaler Zusammenhang jedoch noch nicht hergestellt werden kann.Die Rolle der Mikrobiota in den Atemwegen bei der Entwicklung von PAH sollte nicht ignoriert werden, wenn sich eine wachsende Zahl von Studien auf die Wirkung der Darmmikrobiota auf PAH konzentriert. Es wurde berichtet, dass der Anteil von Streptococcus in der Darmmikrobiota sowohl bei PAH-Patienten als auch bei Tiermodellen erhöht ist (Kim et al., 2020;
Sharma et al., 2020b
). In ähnlicher Weise war Streptococcus in der Mikrobiota der Atemwege signifikant mit PAH assoziiert (
Zhang et al., 2020
) (
Tabelle 1
). Tsayet al. fanden heraus, dass supraglottische dominante Taxa wie Streptococcus, Veillonella und Prevotella, wurden in den unteren Atemwegen von Lungenkrebspatienten angereichert und mit der Hochregulierung von ERK- und Phosphatidylinositol-3-Kinase (PI3K)-Signalwegen bei Lungenkrebs in Verbindung gebracht (
Tsay et al., 2018
). Verschiedene Stimuli wie der von Blutplättchen stammende Wachstumsfaktor (PDGF) induzieren die Proliferation von PASMCs und den Lungengefäßumbau über den PI3K/Proteinkinase B (AKT)/mammalian target of rapamycin (mTOR)-Signalweg (
Ogawa et al., 2012
). Eine klinische Studie zum Umbau der Atemwegsmikrobiota in transplantierten Lungen ergab, dass Streptococcus und Prevotella mit einer erhöhten Expression von Thrombospondin 1 (THBS1) assoziiert waren (
Mouraux et al., 2018
). TSP-1 (THBS1-codiertes Protein) fördert die durch Hypoxie induzierte pulmonale Vasokonstriktion durch Aktivierung der Signalübertragung des transformierenden Wachstumsfaktors β (TGF-β) (
Kumar et al., 2020
). Darüber hinaus korrelierte die Anreicherung von Veillonella und Prevotella in der Lungenmikrobiota positiv mit hohen Konzentrationen mehrerer Zytokine, wie IL-1α, IL-1β, IL-6, Fractalkine und IL-17 (
Segal et al., 2016
). Interessanterweise wurde berichtet, dass Prevotella in der Mikrobiota der oberen Atemwege von Patienten mit PAH, Asthma und chronisch obstruktiver Lungenerkrankung reduziert ist, was mit Unterschieden in der Verteilung der Mikrobiota in verschiedenen Teilen der Atemwege zusammenhängen könnte (
Hilty et al. , 2010
;
Zhang et al., 2020
). Es wurde auch gezeigt, dass kommensale Prevotella Neutrophilie, Chemokin- und Zytokinproduktion induzieren kann, aber diese begrenzte Entzündung wird in murinen Atemwegen gut toleriert und provoziert keine nachweisbare Lungenpathologie (
Larsen et al., 2015
). Daher sind weitere Studien erforderlich, um die fördernde oder schützende Wirkung von Prevotella auf Lungenerkrankungen wie PAH zu bestimmen. Es wurde auch berichtet, dass Streptococcus den p38-Mitogen-aktivierten Proteinkinase (MAPK)-Signalweg in primären menschlichen Bronchialepithelzellen aktiviert, was eine Erhöhung der IL-6-Produktion induziert (
Goleva et al., 2017
). Und IL-6 kann an der Proliferation von PASMCs und Fibroblasten über den Transkriptionsweg 3 (STAT3), p38MAPK-Inhibitor umgekehrte Hypoxie und MCT-induzierte PAH beteiligt sein (
Church et al., 2015
). Darüber hinaus kann Streptococcus auch Butyrat produzieren, um die 5-HT-Produktion zu fördern (
Butler et al., 2019
;
Chang et al., 2020
) (
Abbildung 2
). Zhanget al. fanden erhöhte Anteile von Leptotricchiaceae, Lautropia und Ralstonia in den Atemwegen von Patienten mit PAH im Vergleich zu Referenzpersonen, während weniger Forschung zu ihrer Rolle durchgeführt wurde (
Zhang et al., 2020
) (
Tabelle 1
). Darauf deuten die vorliegenden Studien hinLeptotrichia wird bei älteren Menschen mit arterieller Steifigkeit in Verbindung gebracht (
Lee et al., 2019
).Figur 2
ABBILDUNG 1. Die Darm-Lungen-Achse bei PAH. Die von Darmbakterien produzierten Metaboliten wie kurzkettige Fettsäuren (SCFAs) gelangen über den Kreislauf in die Lunge, wo sie an der Immunregulation beteiligt sind und eine Rolle bei der perivaskulären Entzündung und dem Umbau der Lungengefäße spielen. 5-HT: Serotonin; TMAO: Trimethylamin-N-oxid; LPS: Lipopolysaccharid; GPCRs: G-Protein-gekoppelter Rezeptor; HDAC: Histon-Deacetylase; VCAM-1: vaskuläres Zelladhäsionsmolekül-1; VEGFα: vaskulärer endothelialer Wachstumsfaktor α; HIF-1α: Hypoxie-induzierbarer Faktor-1α; Nox-1: NADPH-Oxidase-1; ROS: reaktive Sauerstoffspezies; SIRT3: Sirtuin 3; SOD2: Superoxiddismutasen; NLRP3: Pyrindomäne der Nod-like-Rezeptorfamilie, die 3 enthält; PKC: Proteinkinase C; NF-κB: Kernfaktor-kappa B; HMGB1: Gruppe Box-1 für hohe Mobilität; TLR4: Toll-like-Rezeptor 4; BMPR2: Bone Morphogenetic Protein Receptor 2. Die in den Atemwegen lebenden Mikrobiota haben einen wichtigen Einfluss auf PAHDas menschliche Atmungssystem besteht aus den oberen Atemwegen (wie Nase, Rachen und Kehlkopf) und den unteren Atemwegen (wie Luftröhre und Bronchien auf allen Ebenen der Lunge). Vor einem Jahrzehnt galten die unteren Atemwege als sterile Umgebung, wahrscheinlich, weil invasive Bronchoskopie normalerweise nicht in gesunden Lungen durchgeführt wurde und Bronchoskopie im Verdacht stand, eine mikrobielle Kontamination aus dem Oropharynx oder der Nasenhöhle zu übertragen. Trotzdem haben Hilty et al. verwendeten 16S-rRNA-Sequenzierung, um das Vorhandensein von Mikrobiota in den unteren Atemwegen aufzudecken, deren Zusammensetzung sich zwischen Patienten mit chronisch obstruktiver Lungenerkrankung und Asthma sowie Referenzkohorten unterschied (
Hilty et al., 2010
). Neuere Studien haben solche Ergebnisse ebenfalls bestätigt und die spezifische Rolle der Atemwegsmikrobiota bei Atemwegserkrankungen aufgeklärt (
Budden et al., 2019
). Die Mikrobiota gesunder Lungen scheint von der Migration der oralen Mikrobiota abzustammen (
Bassis et al., 2015
). Darüber hinaus haben Lunge und Darm ähnliche epitheliale Barrierefunktionen und unterschiedliche Mikrobiota. Die dominanten Phyla der oberen Atemwege, wie Firmicutes, Bacteroidetes, Proteobacteria, Actinobacteria, Fusobacteria und Saccharibacteria , überlappen sich teilweise mit der intestinalen Mikrobiota (
Zhang et al., 2020
). Zhanget al. verglichen die Zusammensetzung der Atemwegsmikrobiota von PAH-Patienten und Referenzsubjekten und stellten fest, dass die Atemwegsmikrobiota von PAH-Patienten eine verringerte Diversität der Gemeinschaft und ein erhöhtes F/B -Verhältnis aufwies (
Zhang et al., 2020
). Die oben genannten Studien deuten darauf hin, dass die mikrobielle Dysbiose der Atemwege eine wichtige Rolle in der Pathogenese der PAH spielt und dass es enge Wechselwirkungen zwischen der Atemwegsmikrobiota und dem pathologischen und pathophysiologischen Prozess der PAH gibt, ein kausaler Zusammenhang jedoch noch nicht hergestellt werden kann.Die Rolle der Mikrobiota in den Atemwegen bei der Entwicklung von PAH sollte nicht ignoriert werden, wenn sich eine wachsende Zahl von Studien auf die Wirkung der Darmmikrobiota auf PAH konzentriert. Es wurde berichtet, dass der Anteil von Streptococcus in der Darmmikrobiota sowohl bei PAH-Patienten als auch bei Tiermodellen erhöht ist (Kim et al., 2020;
Sharma et al., 2020b
). In ähnlicher Weise war Streptococcus in der Mikrobiota der Atemwege signifikant mit PAH assoziiert (
Zhang et al., 2020
) (
Tabelle 1
). Tsayet al. fanden heraus, dass supraglottische dominante Taxa wie Streptococcus, Veillonella und Prevotella, wurden in den unteren Atemwegen von Lungenkrebspatienten angereichert und mit der Hochregulierung von ERK- und Phosphatidylinositol-3-Kinase (PI3K)-Signalwegen bei Lungenkrebs in Verbindung gebracht (
Tsay et al., 2018
). Verschiedene Stimuli wie der von Blutplättchen stammende Wachstumsfaktor (PDGF) induzieren die Proliferation von PASMCs und den Lungengefäßumbau über den PI3K/Proteinkinase B (AKT)/mammalian target of rapamycin (mTOR)-Signalweg (
Ogawa et al., 2012
). Eine klinische Studie zum Umbau der Atemwegsmikrobiota in transplantierten Lungen ergab, dass Streptococcus und Prevotella mit einer erhöhten Expression von Thrombospondin 1 (THBS1) assoziiert waren (
Mouraux et al., 2018
). TSP-1 (THBS1-codiertes Protein) fördert die durch Hypoxie induzierte pulmonale Vasokonstriktion durch Aktivierung der Signalübertragung des transformierenden Wachstumsfaktors β (TGF-β) (
Kumar et al., 2020
). Darüber hinaus korrelierte die Anreicherung von Veillonella und Prevotella in der Lungenmikrobiota positiv mit hohen Konzentrationen mehrerer Zytokine, wie IL-1α, IL-1β, IL-6, Fractalkine und IL-17 (
Segal et al., 2016
). Interessanterweise wurde berichtet, dass Prevotella in der Mikrobiota der oberen Atemwege von Patienten mit PAH, Asthma und chronisch obstruktiver Lungenerkrankung reduziert ist, was mit Unterschieden in der Verteilung der Mikrobiota in verschiedenen Teilen der Atemwege zusammenhängen könnte (
Hilty et al. , 2010
;
Zhang et al., 2020
). Es wurde auch gezeigt, dass kommensale Prevotella Neutrophilie, Chemokin- und Zytokinproduktion induzieren kann, aber diese begrenzte Entzündung wird in murinen Atemwegen gut toleriert und provoziert keine nachweisbare Lungenpathologie (
Larsen et al., 2015
). Daher sind weitere Studien erforderlich, um die fördernde oder schützende Wirkung von Prevotella auf Lungenerkrankungen wie PAH zu bestimmen. Es wurde auch berichtet, dass Streptococcus den p38-Mitogen-aktivierten Proteinkinase (MAPK)-Signalweg in primären menschlichen Bronchialepithelzellen aktiviert, was eine Erhöhung der IL-6-Produktion induziert (
Goleva et al., 2017
). Und IL-6 kann an der Proliferation von PASMCs und Fibroblasten über den Transkriptionsweg 3 (STAT3), p38MAPK-Inhibitor umgekehrte Hypoxie und MCT-induzierte PAH beteiligt sein (
Church et al., 2015
). Darüber hinaus kann Streptococcus auch Butyrat produzieren, um die 5-HT-Produktion zu fördern (
Butler et al., 2019
;
Chang et al., 2020
) (
Abbildung 2
). Zhanget al. fanden erhöhte Anteile von Leptotricchiaceae, Lautropia und Ralstonia in den Atemwegen von Patienten mit PAH im Vergleich zu Referenzpersonen, während weniger Forschung zu ihrer Rolle durchgeführt wurde (
Zhang et al., 2020
) (
Tabelle 1
). Darauf deuten die vorliegenden Studien hinLeptotrichia wird bei älteren Menschen mit arterieller Steifigkeit in Verbindung gebracht (
Lee et al., 2019
).Figur 2
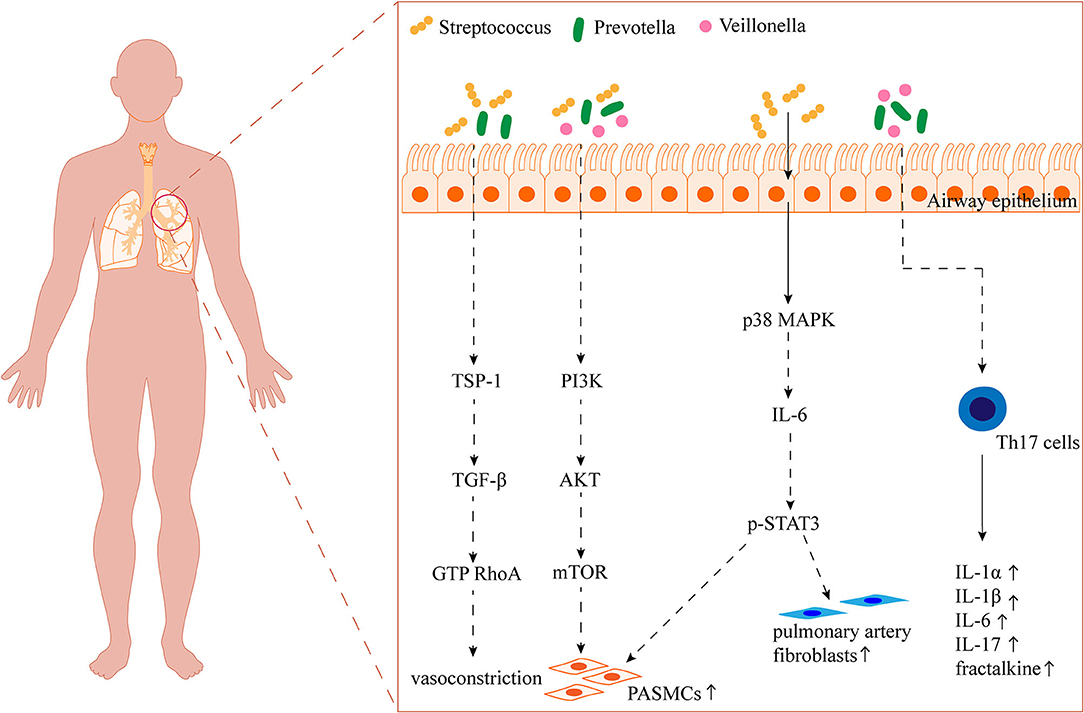 ABBILDUNG 2 . Überblick über die potenziellen Auswirkungen der Atemwegsmikrobiota auf PAH. TSP-1: Thrombospondin 1; TGF-β: transformierender Wachstumsfaktor-β; RhoA: das kleine GTP-bindende Protein; PI3K: Phosphatidylinositol-3-kinase; AKT: Proteinkinase B; mTOR: Säugetierziel von Rapamycin; MAPK: Mitogen-aktivierte Proteinkinase; STAT3: Transkription 3. Perspektiven der Mikrobiota bei der Behandlung von PAHZusammenfassend ist die Dysbiose des Darms und der Atemwege eng mit der Pathogenese der PAH verbunden. Die Veränderung der Darm- und Atemwegsmikrobiota, der Metaboliten und der Assoziation mit PAH macht die Mikrobiota zu einem neuen therapeutischen Ziel für PAH. Therapeutische Eingriffe zur Eliminierung pathogener Mikroorganismen mit Antibiotika sind in der klinischen Praxis weit verbreitet. Eine Antibiotikatherapie, ein Cocktail, der Ampicillin, Vancomycin, Neomycin und Metronidazol enthält, wurde zur Behandlung von SU5416/hypoxischen Ratten durchgeführt und es wurde berichtet, dass sie Veränderungen in der Darmmikrobiota mit einer erhöhten Häufigkeit von Proteobakterien auf Stammebene und Shigella auf Gattungsebene induziert (
Sanadaet al., 2020
). Folglich hemmte die Antibiotika-Cocktail-Therapie das SU5416/Hypoxie-induzierte Fortschreiten des pulmonalen Gefäßumbaus und die Entwicklung von PAH bei Ratten. Es besteht jedoch Einigkeit darüber, dass solche unspezifischen antimikrobiellen Therapien viele Nebenwirkungen hervorrufen können, die die Vielfalt der Darm- und Atemwegsmikrobiota zerstören können, was zu multiplen Infektionen und Arzneimittelresistenz schädlicher Mikroorganismen führen kann (
Forslund et al., 2013
;
Rashid et a., 2015
).Probiotika werden häufig verwendet, um die Darmflora auszugleichen, und werden derzeit von der Ernährungs- und Landwirtschaftsorganisation der Vereinten Nationen und der Weltgesundheitsorganisation als „lebende Mikroorganismen in ausreichender Anzahl, um dem Wirt gesundheitliche Vorteile zu bieten“ definiert (
Hill et al., 2014
). Eine klinische Studie zeigte, dass die Supplementierung mit Lactobacillus plantarum 299v vaskuläre endotheliale Störungen und systemische Entzündungen bei männlichen Patienten mit stabiler Angina pectoris reduzierte, indem sie die SFCA-Spiegel veränderte (
Malik et al., 2018
). Wedgwoodet al. berichteten, dass die probiotische Behandlung mit Lactobacillus reuteri DSM 17938 in der Lage war, die durch postnatale Wachstumsrestriktion induzierte PAH umzukehren (
Wedgwood et al., 2020
). Darüber hinaus berichteten einige Forscher, dass der therapeutische Anwendungsbereich von Probiotika durch Gentechnik erweitert wurde, die als technisch hergestellte Probiotika bezeichnet wird. Gegenwärtig sind technisch hergestellte Probiotika besser erforscht und bei Stoffwechsel- und Infektionskrankheiten wirksamer (
Zhou et al., 2020
). Das Potenzial technisch hergestellter Probiotika bei der Behandlung von PAH muss jedoch weiter erforscht werden. Obwohl die meisten der als Probiotika verwendeten kommensalen Bakterien aus dem Magen-Darm-Trakt stammen, wurden auch kommensale Bakterien aus dem Atmungssystem als Probiotika beschrieben. Es wurde gezeigt, dass der pro-Th1-Stamm CNCM I 4969 (patentierte Stämme), der aus der Lunge von neugeborenen Mäusen isoliert wurde, die Anfälligkeit für Asthma bei Mäusen durch intranasale Inokulation modulieren kann (
Remot et al., 2017
).Eine weitere Strategie zur Regulierung der Darmmikrobiota ist die präbiotische Therapie, bei der es sich um ein Substrat handelt, das selektiv von Wirtsmikroben zum Nutzen der Wirtsgesundheit genutzt wird (
Gibson et al., 2017
). Feng et al. fanden heraus, dass Algen-Oligosaccharide als Präbiotika entzündungshemmende und antioxidative Wirkungen ausüben und MCT-induzierte PAH bei Ratten verbessern könnten (
Feng et al., 2020
). Darüber hinaus können Algenpolysaccharide wie Fucoidan, Laminarin, Alginat, Ulvan und Porphyran die Produktion von SFCAs steigern (
Feng et al., 2020
;
Shannon et al., 2021
). Die International Scientific Association for Probiotics and Prebiotics definiert mehrfach ungesättigte Fettsäuren (PUFA) als Kandidaten für Präbiotika (
Gibson et al., 2017
). Es wurde auch berichtet, dass eine Lipidemulsion, die n – 3 PUFA enthält, eine starke und anhaltende Vasodilatation in der fetalen Lunge induzieren kann (
Houeijeh et al., 2011
). Darüber hinaus verhindert die mütterliche Omega-3-PUFA-Ergänzung eine Hyperoxie-induzierte PAH bei den Nachkommen, indem sie die Produktion proinflammatorischer Zytokine, die Angiogenese und den Gefäßumbau unterdrückt (
Zhong et al., 2018
). Die orale Verabreichung von Docosapentaensäuremonoacylglycerid, der mit Monoglyceriden umveresterten Form von Docosapentaensäure mit besserer Bioverfügbarkeit, unterdrückt Entzündungen und Gefäßumbau und verhindert das Fortschreiten von MCT-induzierter PAH (
Morin et al., 2014
;
Sztuka et al., 2018
). Daher kann die Einnahme von Probiotika und Präbiotika oder einer Kombination aus beiden, dh Synbiotika, zur Vorbeugung und Behandlung von PAH beitragen. Aufgrund der großen individuellen Unterschiede in der mikrobiellen Zusammensetzung beim Menschen ist die Standardisierung der Dosis und Zusammensetzung präbiotischer Produkte jedoch zu einer großen Herausforderung geworden, die in größeren Studien angegangen werden muss (
Suez et al., 2019
).Die fäkale mikrobielle Transplantation (FMT) ist eine mögliche therapeutische Intervention zur Regulierung der Darmmikrobiota, die darauf abzielt, den fäkalen Inhalt eines gesunden Spenders in den Magen-Darm-Trakt des Patienten einzubringen. Diese Behandlung hat sich weiterentwickelt, mit mehr Forschung, insbesondere bei der Behandlung von Darmerkrankungen. Eine wegweisende klinische Studie hat gezeigt, dass FMT bei der Behandlung von rezidivierenden Clostridium-difficile - Infektionen einen signifikanten Vorteil gegenüber Antibiotika hat (
van Nood et al., 2013
). In den letzten Jahren haben Forscher auch begonnen, der Nützlichkeit von FMT zur Behandlung von Krankheiten im Zusammenhang mit mikrobieller Dysbiose wie Fettleibigkeit, Bluthochdruck und Diabetes Aufmerksamkeit zu schenken (
Leshem et al., 2019
). Wanget al. berichteten, dass FMT die Darmpermeabilität verringerte und die systemische Entzündung bei Ratten mit hepatischer Enzephalopathie verbesserte (
Wang et al., 2017
). Wie berichtet wird, hat die Überexpression des Angiotensin-Converting-Enzyms 2 (ACE2) oder FMT von ACE2-überexprimierenden Mäusen die Darmmikrobiota wieder ins Gleichgewicht gebracht und die Hypoxie-induzierte PAH verbessert, was darauf hindeutet, dass ACE2 die PAH verbessern kann, indem es die Darmmikrobiota zusätzlich zur Vermittlung des Renin-Angiotensin-Systems reguliert (
Sharma et al., 2020a
). Folglich spekulieren wir, dass FMT auch zur Behandlung von PAH verwendet werden kann, aber seine Wirksamkeit muss durch eine große Anzahl von präklinischen Studien und klinischen Studien geklärt werden.Darüber hinaus deutet eine wachsende Zahl von Studien darauf hin, dass eine Therapie mit mesenchymalen Stammzellen (MSCs) auch die PAH verbessern kann. Eine Metaanalyse wurde durchgeführt, um die therapeutische Wirksamkeit von MSCs und Sekretomen bei PAH zu bewerten, und kam zu dem Schluss, dass sowohl Sekretom als auch MSCs die PAH signifikant verbesserten, indem sie den rechtsventrikulären systolischen Druck, den mittleren pulmonalarteriellen Druck und das rechtsventrikuläre Remodeling reduzierten (
Muhammad et al. , 2020
). Es wurde bewiesen, dass die MSC-Therapie die Kapillardichte erhöhen, die Kardiomyozyten-Hypertrophie und -Fibrose unterdrücken und die immunmodulatorischen Aktivitäten bei PAH verbessern kann (
Muhammad et al., 2020
). Darüber hinaus wird auch berichtet, dass MSCs auch die durch Hypoxie induzierte PAH verbessern können, indem sie die Darmmikrobiota bei Mäusen ausgleichen, undMicrococcaales, Nesterenkonia, Anaerotruncus und Tyzzerella können diskriminierend sein und als Darmmikrobiota-Biomarker von mit MSCs behandelten Mäusen dienen (
Luo et al., 2021
).Schlussfolgerungen und ZukunftsperspektivenKlinische Beobachtungsstudien und Grundlagenforschung weisen darauf hin, dass ein starker Zusammenhang zwischen Dysbiose im Darm und den Atemwegen und PAH besteht. Im Darm und in den Atemwegen von PAH wurde eine verringerte mikrobielle Vielfalt beobachtet. Ungleichgewichte zwischen nützlichen Bakterien wie Bacteroidenund SCFAs produzierende Bakterien und potenziell pathogene Bakterien wie TMA/TMAO-assoziierte Bakterien treten parallel zu PAH auf, mit funktionellen Veränderungen des Mikrobioms. Diese populationsbasierten Studien zur Mikrobiota bei PAH sind Querschnitts-Beobachtungsstudien; und der kausale Zusammenhang zwischen Dysbiose und PAH konnte nicht hergestellt werden. Basierend auf Tierversuchen konnten wir jedoch den Schluss ziehen, dass PAH tatsächlich das Darmmikrobiom beeinflusst, da die unterschiedlichen Profile der Darmmikrobiota nach Exposition gegenüber Faktoren wie Hypoxie und MCT gefunden wurden und PAH-Modelle erfolgreich etabliert wurden. Um interessanterweise zu untersuchen, ob diskriminierende Mikrobiota eine kausale Rolle bei PAH spielen, wurde der Transfer von Fäkalien von ACE2-Knock-in-Mäusen, die unterschiedliche mikrobiologische Gemeinschaften im Darm aufweisen und vor der Entwicklung von PAH geschützt sind, untersucht.
Sharma et al., 2020a
). Zusammenfassend dachten wir, dass es eine interaktive Beziehung zwischen veränderten mikrobiellen Gemeinschaften und PAH gibt.Die veränderte Darm-/Atemwegsmikrobiota hat entscheidende Auswirkungen auf das Fortschreiten von PAH, hauptsächlich durch Modulation der Immunität, SCFA-Produktion, Polysaccharidfermentation, Stärkung der Darmbarriere, Verschlimmerung von Lungeninfektionen und Lungen-/Darmentzündung. Der kausale Zusammenhang zwischen dem Mikrobiom und der Entwicklung von PAH ist jedoch noch nicht klar und muss durch zusätzliche Tierstudien, prospektive Kohortenstudien und In-vitro -Mikrobiom-Dysregulation und -Analyse validiert werden. Da das Lebensumfeld und genetische Faktoren die Zusammensetzung der Mikrobiota in vivo beeinflussen können, sollte der Verbesserung in vivo besondere Aufmerksamkeit geschenkt werdenTiermodelle, um menschliche klinische Bedingungen so weit wie möglich zu simulieren. Vorhandene Studien belegen einen entero-pulmonalen Zusammenhang bei PAH und deuten darauf hin, dass es eine Überschneidung zwischen intestinaler und pulmonaler Mikrobiota gibt, was darauf hindeutet, dass sie sich bei der Entwicklung von PAH koordinieren oder antagonisieren können. Allerdings berichtete nur eine Studie über die Wirkung der oropharyngealen Mikrobiota auf PAH. Obwohl eine große Ähnlichkeit zwischen der Mikrobiota der Lunge und der oberen Atemwege besteht, sollten bei der Untersuchung der Lungenmikrobiota Unterschiede in der Verteilung der Mikrobiota in verschiedenen Teilen der Atemwege berücksichtigt werden, und es kann wichtiger sein, sie zu untersuchen die Wirkung der Lungenmikrobiota auf PAH. Deswegen,Eine auf Mikrobiota basierende Therapie könnte eine neue therapeutische Strategie für PAH werden, aber es fehlt an relevanter klinischer Evidenz. Um die Wirksamkeit mikrobiotabasierter PAH-Therapien zu validieren, müssen groß angelegte klinische Studien konzipiert werden. Zum Beispiel, ob bei Patienten, die sich einer Kolektomie unterziehen, ein Risiko für eine veränderte PAH besteht und ob Patienten mit PAH, die mit FMT oder Probiotika behandelt werden, verbesserte Anzeichen und Symptome von PAH aufweisen. Neben der Konzentration auf Bakterien sollten wir auch die Wirkung anderer Mikroorganismen wie Archaeen, Pilze und Viren auf PAH berücksichtigen. Es hat sich gezeigt, dass Bakterien im Darm starke Wechselwirkungen mit Phagen haben (
Kim S. et al., 2020
). Ackermannet al. fanden schwere Endothelschäden und Thrombosen im Zusammenhang mit dem intrazellulären schweren akuten respiratorischen Syndrom Coronavirus 2 bei der Coronavirus-Krankheit 2019, die mit der Pathogenese bestimmter Arten von PAH zusammenhängt (
Ackermann et al., 2020
).
ABBILDUNG 2 . Überblick über die potenziellen Auswirkungen der Atemwegsmikrobiota auf PAH. TSP-1: Thrombospondin 1; TGF-β: transformierender Wachstumsfaktor-β; RhoA: das kleine GTP-bindende Protein; PI3K: Phosphatidylinositol-3-kinase; AKT: Proteinkinase B; mTOR: Säugetierziel von Rapamycin; MAPK: Mitogen-aktivierte Proteinkinase; STAT3: Transkription 3. Perspektiven der Mikrobiota bei der Behandlung von PAHZusammenfassend ist die Dysbiose des Darms und der Atemwege eng mit der Pathogenese der PAH verbunden. Die Veränderung der Darm- und Atemwegsmikrobiota, der Metaboliten und der Assoziation mit PAH macht die Mikrobiota zu einem neuen therapeutischen Ziel für PAH. Therapeutische Eingriffe zur Eliminierung pathogener Mikroorganismen mit Antibiotika sind in der klinischen Praxis weit verbreitet. Eine Antibiotikatherapie, ein Cocktail, der Ampicillin, Vancomycin, Neomycin und Metronidazol enthält, wurde zur Behandlung von SU5416/hypoxischen Ratten durchgeführt und es wurde berichtet, dass sie Veränderungen in der Darmmikrobiota mit einer erhöhten Häufigkeit von Proteobakterien auf Stammebene und Shigella auf Gattungsebene induziert (
Sanadaet al., 2020
). Folglich hemmte die Antibiotika-Cocktail-Therapie das SU5416/Hypoxie-induzierte Fortschreiten des pulmonalen Gefäßumbaus und die Entwicklung von PAH bei Ratten. Es besteht jedoch Einigkeit darüber, dass solche unspezifischen antimikrobiellen Therapien viele Nebenwirkungen hervorrufen können, die die Vielfalt der Darm- und Atemwegsmikrobiota zerstören können, was zu multiplen Infektionen und Arzneimittelresistenz schädlicher Mikroorganismen führen kann (
Forslund et al., 2013
;
Rashid et a., 2015
).Probiotika werden häufig verwendet, um die Darmflora auszugleichen, und werden derzeit von der Ernährungs- und Landwirtschaftsorganisation der Vereinten Nationen und der Weltgesundheitsorganisation als „lebende Mikroorganismen in ausreichender Anzahl, um dem Wirt gesundheitliche Vorteile zu bieten“ definiert (
Hill et al., 2014
). Eine klinische Studie zeigte, dass die Supplementierung mit Lactobacillus plantarum 299v vaskuläre endotheliale Störungen und systemische Entzündungen bei männlichen Patienten mit stabiler Angina pectoris reduzierte, indem sie die SFCA-Spiegel veränderte (
Malik et al., 2018
). Wedgwoodet al. berichteten, dass die probiotische Behandlung mit Lactobacillus reuteri DSM 17938 in der Lage war, die durch postnatale Wachstumsrestriktion induzierte PAH umzukehren (
Wedgwood et al., 2020
). Darüber hinaus berichteten einige Forscher, dass der therapeutische Anwendungsbereich von Probiotika durch Gentechnik erweitert wurde, die als technisch hergestellte Probiotika bezeichnet wird. Gegenwärtig sind technisch hergestellte Probiotika besser erforscht und bei Stoffwechsel- und Infektionskrankheiten wirksamer (
Zhou et al., 2020
). Das Potenzial technisch hergestellter Probiotika bei der Behandlung von PAH muss jedoch weiter erforscht werden. Obwohl die meisten der als Probiotika verwendeten kommensalen Bakterien aus dem Magen-Darm-Trakt stammen, wurden auch kommensale Bakterien aus dem Atmungssystem als Probiotika beschrieben. Es wurde gezeigt, dass der pro-Th1-Stamm CNCM I 4969 (patentierte Stämme), der aus der Lunge von neugeborenen Mäusen isoliert wurde, die Anfälligkeit für Asthma bei Mäusen durch intranasale Inokulation modulieren kann (
Remot et al., 2017
).Eine weitere Strategie zur Regulierung der Darmmikrobiota ist die präbiotische Therapie, bei der es sich um ein Substrat handelt, das selektiv von Wirtsmikroben zum Nutzen der Wirtsgesundheit genutzt wird (
Gibson et al., 2017
). Feng et al. fanden heraus, dass Algen-Oligosaccharide als Präbiotika entzündungshemmende und antioxidative Wirkungen ausüben und MCT-induzierte PAH bei Ratten verbessern könnten (
Feng et al., 2020
). Darüber hinaus können Algenpolysaccharide wie Fucoidan, Laminarin, Alginat, Ulvan und Porphyran die Produktion von SFCAs steigern (
Feng et al., 2020
;
Shannon et al., 2021
). Die International Scientific Association for Probiotics and Prebiotics definiert mehrfach ungesättigte Fettsäuren (PUFA) als Kandidaten für Präbiotika (
Gibson et al., 2017
). Es wurde auch berichtet, dass eine Lipidemulsion, die n – 3 PUFA enthält, eine starke und anhaltende Vasodilatation in der fetalen Lunge induzieren kann (
Houeijeh et al., 2011
). Darüber hinaus verhindert die mütterliche Omega-3-PUFA-Ergänzung eine Hyperoxie-induzierte PAH bei den Nachkommen, indem sie die Produktion proinflammatorischer Zytokine, die Angiogenese und den Gefäßumbau unterdrückt (
Zhong et al., 2018
). Die orale Verabreichung von Docosapentaensäuremonoacylglycerid, der mit Monoglyceriden umveresterten Form von Docosapentaensäure mit besserer Bioverfügbarkeit, unterdrückt Entzündungen und Gefäßumbau und verhindert das Fortschreiten von MCT-induzierter PAH (
Morin et al., 2014
;
Sztuka et al., 2018
). Daher kann die Einnahme von Probiotika und Präbiotika oder einer Kombination aus beiden, dh Synbiotika, zur Vorbeugung und Behandlung von PAH beitragen. Aufgrund der großen individuellen Unterschiede in der mikrobiellen Zusammensetzung beim Menschen ist die Standardisierung der Dosis und Zusammensetzung präbiotischer Produkte jedoch zu einer großen Herausforderung geworden, die in größeren Studien angegangen werden muss (
Suez et al., 2019
).Die fäkale mikrobielle Transplantation (FMT) ist eine mögliche therapeutische Intervention zur Regulierung der Darmmikrobiota, die darauf abzielt, den fäkalen Inhalt eines gesunden Spenders in den Magen-Darm-Trakt des Patienten einzubringen. Diese Behandlung hat sich weiterentwickelt, mit mehr Forschung, insbesondere bei der Behandlung von Darmerkrankungen. Eine wegweisende klinische Studie hat gezeigt, dass FMT bei der Behandlung von rezidivierenden Clostridium-difficile - Infektionen einen signifikanten Vorteil gegenüber Antibiotika hat (
van Nood et al., 2013
). In den letzten Jahren haben Forscher auch begonnen, der Nützlichkeit von FMT zur Behandlung von Krankheiten im Zusammenhang mit mikrobieller Dysbiose wie Fettleibigkeit, Bluthochdruck und Diabetes Aufmerksamkeit zu schenken (
Leshem et al., 2019
). Wanget al. berichteten, dass FMT die Darmpermeabilität verringerte und die systemische Entzündung bei Ratten mit hepatischer Enzephalopathie verbesserte (
Wang et al., 2017
). Wie berichtet wird, hat die Überexpression des Angiotensin-Converting-Enzyms 2 (ACE2) oder FMT von ACE2-überexprimierenden Mäusen die Darmmikrobiota wieder ins Gleichgewicht gebracht und die Hypoxie-induzierte PAH verbessert, was darauf hindeutet, dass ACE2 die PAH verbessern kann, indem es die Darmmikrobiota zusätzlich zur Vermittlung des Renin-Angiotensin-Systems reguliert (
Sharma et al., 2020a
). Folglich spekulieren wir, dass FMT auch zur Behandlung von PAH verwendet werden kann, aber seine Wirksamkeit muss durch eine große Anzahl von präklinischen Studien und klinischen Studien geklärt werden.Darüber hinaus deutet eine wachsende Zahl von Studien darauf hin, dass eine Therapie mit mesenchymalen Stammzellen (MSCs) auch die PAH verbessern kann. Eine Metaanalyse wurde durchgeführt, um die therapeutische Wirksamkeit von MSCs und Sekretomen bei PAH zu bewerten, und kam zu dem Schluss, dass sowohl Sekretom als auch MSCs die PAH signifikant verbesserten, indem sie den rechtsventrikulären systolischen Druck, den mittleren pulmonalarteriellen Druck und das rechtsventrikuläre Remodeling reduzierten (
Muhammad et al. , 2020
). Es wurde bewiesen, dass die MSC-Therapie die Kapillardichte erhöhen, die Kardiomyozyten-Hypertrophie und -Fibrose unterdrücken und die immunmodulatorischen Aktivitäten bei PAH verbessern kann (
Muhammad et al., 2020
). Darüber hinaus wird auch berichtet, dass MSCs auch die durch Hypoxie induzierte PAH verbessern können, indem sie die Darmmikrobiota bei Mäusen ausgleichen, undMicrococcaales, Nesterenkonia, Anaerotruncus und Tyzzerella können diskriminierend sein und als Darmmikrobiota-Biomarker von mit MSCs behandelten Mäusen dienen (
Luo et al., 2021
).Schlussfolgerungen und ZukunftsperspektivenKlinische Beobachtungsstudien und Grundlagenforschung weisen darauf hin, dass ein starker Zusammenhang zwischen Dysbiose im Darm und den Atemwegen und PAH besteht. Im Darm und in den Atemwegen von PAH wurde eine verringerte mikrobielle Vielfalt beobachtet. Ungleichgewichte zwischen nützlichen Bakterien wie Bacteroidenund SCFAs produzierende Bakterien und potenziell pathogene Bakterien wie TMA/TMAO-assoziierte Bakterien treten parallel zu PAH auf, mit funktionellen Veränderungen des Mikrobioms. Diese populationsbasierten Studien zur Mikrobiota bei PAH sind Querschnitts-Beobachtungsstudien; und der kausale Zusammenhang zwischen Dysbiose und PAH konnte nicht hergestellt werden. Basierend auf Tierversuchen konnten wir jedoch den Schluss ziehen, dass PAH tatsächlich das Darmmikrobiom beeinflusst, da die unterschiedlichen Profile der Darmmikrobiota nach Exposition gegenüber Faktoren wie Hypoxie und MCT gefunden wurden und PAH-Modelle erfolgreich etabliert wurden. Um interessanterweise zu untersuchen, ob diskriminierende Mikrobiota eine kausale Rolle bei PAH spielen, wurde der Transfer von Fäkalien von ACE2-Knock-in-Mäusen, die unterschiedliche mikrobiologische Gemeinschaften im Darm aufweisen und vor der Entwicklung von PAH geschützt sind, untersucht.
Sharma et al., 2020a
). Zusammenfassend dachten wir, dass es eine interaktive Beziehung zwischen veränderten mikrobiellen Gemeinschaften und PAH gibt.Die veränderte Darm-/Atemwegsmikrobiota hat entscheidende Auswirkungen auf das Fortschreiten von PAH, hauptsächlich durch Modulation der Immunität, SCFA-Produktion, Polysaccharidfermentation, Stärkung der Darmbarriere, Verschlimmerung von Lungeninfektionen und Lungen-/Darmentzündung. Der kausale Zusammenhang zwischen dem Mikrobiom und der Entwicklung von PAH ist jedoch noch nicht klar und muss durch zusätzliche Tierstudien, prospektive Kohortenstudien und In-vitro -Mikrobiom-Dysregulation und -Analyse validiert werden. Da das Lebensumfeld und genetische Faktoren die Zusammensetzung der Mikrobiota in vivo beeinflussen können, sollte der Verbesserung in vivo besondere Aufmerksamkeit geschenkt werdenTiermodelle, um menschliche klinische Bedingungen so weit wie möglich zu simulieren. Vorhandene Studien belegen einen entero-pulmonalen Zusammenhang bei PAH und deuten darauf hin, dass es eine Überschneidung zwischen intestinaler und pulmonaler Mikrobiota gibt, was darauf hindeutet, dass sie sich bei der Entwicklung von PAH koordinieren oder antagonisieren können. Allerdings berichtete nur eine Studie über die Wirkung der oropharyngealen Mikrobiota auf PAH. Obwohl eine große Ähnlichkeit zwischen der Mikrobiota der Lunge und der oberen Atemwege besteht, sollten bei der Untersuchung der Lungenmikrobiota Unterschiede in der Verteilung der Mikrobiota in verschiedenen Teilen der Atemwege berücksichtigt werden, und es kann wichtiger sein, sie zu untersuchen die Wirkung der Lungenmikrobiota auf PAH. Deswegen,Eine auf Mikrobiota basierende Therapie könnte eine neue therapeutische Strategie für PAH werden, aber es fehlt an relevanter klinischer Evidenz. Um die Wirksamkeit mikrobiotabasierter PAH-Therapien zu validieren, müssen groß angelegte klinische Studien konzipiert werden. Zum Beispiel, ob bei Patienten, die sich einer Kolektomie unterziehen, ein Risiko für eine veränderte PAH besteht und ob Patienten mit PAH, die mit FMT oder Probiotika behandelt werden, verbesserte Anzeichen und Symptome von PAH aufweisen. Neben der Konzentration auf Bakterien sollten wir auch die Wirkung anderer Mikroorganismen wie Archaeen, Pilze und Viren auf PAH berücksichtigen. Es hat sich gezeigt, dass Bakterien im Darm starke Wechselwirkungen mit Phagen haben (
Kim S. et al., 2020
). Ackermannet al. fanden schwere Endothelschäden und Thrombosen im Zusammenhang mit dem intrazellulären schweren akuten respiratorischen Syndrom Coronavirus 2 bei der Coronavirus-Krankheit 2019, die mit der Pathogenese bestimmter Arten von PAH zusammenhängt (
Ackermann et al., 2020
).



OMNIA TEMPUS HABENT
Diagnose IPAH im Februar 2013, in Behandlung bei OA Dr. Ulrich Krüger, jetzt Dr. Fischer Herzzentrum Duisburg, Medikamente: Sildenafil, Bosentan jetzt Macitentan, Subkutane Treprostinilpumpe, seit Januar 2024 getunnelter ZVK mit externer Pumpe (Groshongkatheter), 24/7 Sauerstoff, Marcumar, Diuretika
Bitte Anmelden oder Registrieren um der Konversation beizutreten.
