- Beiträge: 1748
Sidebar
- Forum
- PH-Forum
- Forschung und Wissen
- Infliximab z.B. / Biologische Behandlungen bei interstitiellen Lungenerkrankunge
Infliximab z.B. / Biologische Behandlungen bei interstitiellen Lungenerkrankunge
15 Jul 2022 12:21 #1538
von danny
OMNIA TEMPUS HABENT
Diagnose IPAH im Februar 2013, in Behandlung bei OA Dr. Ulrich Krüger, jetzt Dr. Fischer Herzzentrum Duisburg, Medikamente: Sildenafil, Bosentan jetzt Macitentan, Subkutane Treprostinilpumpe, seit Januar 2024 getunnelter ZVK mit externer Pumpe (Groshongkatheter), 24/7 Sauerstoff, Marcumar, Diuretika
Infliximab z.B. / Biologische Behandlungen bei interstitiellen Lungenerkrankunge wurde erstellt von danny
Interstitielle Lungenerkrankungen (ILD) stellen eine Gruppe heterogener parenchymaler Lungenerkrankungen mit komplexer Pathophysiologie dar, die durch unterschiedliche klinische und radiologische Muster gekennzeichnet sind und letztendlich zur Lungenfibrose führen. Ein beträchtlicher Anteil dieser Krankheitsentitäten ist ohne wirksame Behandlung, da die derzeitigen Therapieschemata nur das Fortschreiten der Krankheit verlangsamen und die Patienten bestenfalls mit einer erheblichen funktionellen Beeinträchtigung zurücklassen. Biologische Therapien sind entstanden und werden bei Patienten mit verschiedenen Formen von ILD untersucht. Leider hat ihr Sicherheitsprofil viele Bedenken aufgeworfen, da Beweise zeigen, dass sie bei einer Untergruppe von Patienten einen ILD-Status verursachen oder verschlimmern könnten. Ziel dieser Übersichtsarbeit ist es, den aktuellen Wissensstand zu ihrer Rolle bei Patienten mit ILD zusammenzufassen und Zukunftsperspektiven aufzuzeigen. EinführungInterstitielle Lungenerkrankungen (ILD) sind eine Gruppe heterogener parenchymaler Lungenerkrankungen, die durch unterschiedliche klinische und radiologische Muster gekennzeichnet sind (
1
,
2
). Trotz eines exponentiellen Wissenszuwachses und des Aufkommens neuartiger Therapien bleibt die Behandlung für einen beträchtlichen Teil der Patienten wirkungslos (
3
–
13
). Biologische Behandlungen umfassen eine breite Gruppe von Verbindungen natürlichen Ursprungs, die durch Biotechnologie und andere Spitzentechnologien hergestellt werden (
14
); Dieser Begriff bezieht sich jedoch hauptsächlich auf die Untergruppe komplexer Moleküle, die eine zielgerichtete Therapie darstellen, wie monoklonale Antikörper und Rezeptorfusionsproteine (
15
). In den letzten Jahren sind biologische Behandlungen zur Behandlung mehrerer Immun- und onkologischer Erkrankungen aufgekommen (
16
–
18
). Die am häufigsten verwendeten sind Tumornekrosefaktor-α (TNF-a)-Inhibitoren, B-Zell-gerichtete Therapien, co-stimulierende T-Zell-Molekülblocker und Immun-Checkpoint-Inhibitoren. In Bezug auf ILDs gibt es fundiertes Wissen über den Einsatz biologischer Therapien bei Patienten mit Bindegewebserkrankungen (CTD-ILDs) und Sarkoidose (
12
,
16
,
19
–
21
). Trotz alter Skepsis (
7
,
22
–
27
), gab es in letzter Zeit eine Verschiebung hin zum Angriff auf das Immunsystem als therapeutische Option für verschiedene Formen der interstitiellen Lungenentzündung und Fibrose (
9
,
28
–
33
). Leider hat ihr Sicherheitsprofil viele Bedenken aufgeworfen, da Beweise zeigen, dass sie die Neuentwicklung von ILD in einer Untergruppe von Patienten verschlimmern oder verursachen könnten ( 34
–
36
)
(
Tabelle 1
). Ziel dieser Übersichtsarbeit ist es, den aktuellen Wissensstand zu ihrer Rolle bei Patienten mit ILD zusammenzufassen und Zukunftsperspektiven aufzuzeigen.Tabelle 1
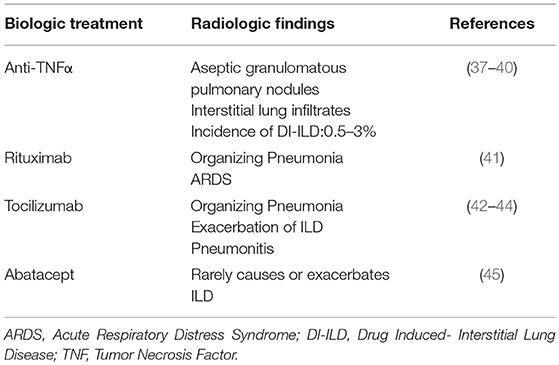 TABELLE 1 . Lungentoxizität von biologischen Behandlungen. Sarkoidose (
Tabelle 2
)Prednisolon bleibt der Eckpfeiler der Behandlung von Sarkoidose (
55
). Biologische Therapien stellen derzeit eine fruchtbare therapeutische Alternative in Sarkoidose-Fällen dar, die gegenüber immunmodulatorischen Mitteln der ersten Wahl, einschließlich Kortikosteroiden, Methotrexat, Azathioprin, Leflunomid und Mycophenolatmofetil, refraktär sind (
56
). TNFα-Inhibitoren in Kombination mit niedrig dosiertem Prednisolon oder Methotrexat wurden vorgeschlagen bei: (i) chronisch fortschreitender Lungenerkrankung, (ii) Schwächung durch Lupus pernio, (iii) anhaltender Neurosarkoidose, (iv) anhaltender kardialer Sarkoidose (
55
). Infliximab hat bei pulmonaler Sarkoidose im Vergleich zu Etanercept und Adalimumab überlegene Ansprechraten gezeigt (
46
,
47
,
50
).
51
,
57
). Insbesondere eine randomisierte kontrollierte Studie (RCT) mit 148 Patienten mit chronischer Lungensarkoidose zeigte, dass Infliximab nach 24 Behandlungswochen zu einer statistisch signifikanten Verbesserung der forcierten Vitalkapazität (FVC%pred) um 2,5 % führte (
46
). Ergebnisse aus anderen nicht-randomisierten Studien waren eher widersprüchlich (
47
,
48
). Leider zeigten fast 2/3 der Patienten mit Sarkoidose, die Infliximab erhielten, einen Rückfall nach dem Absetzen des Arzneimittels (
49
). Adalimumab hat ein akzeptables Verträglichkeits- und Wirksamkeitsprofil gezeigt, wie durch Verbesserungen bei FVC% pred, 6-Minuten-Gehstrecke (6MWD) und Borg-Skala über einen Zeitraum von 52 Wochen in einer kleinen Kohorte von Patienten mit refraktärer pulmonaler Sarkoidose angezeigt wird (
50
). Eine Phase-2-Studie mit Etanercept bei Patienten mit Lungensarkoidose wurde aufgrund ungünstiger Ergebnisse vorzeitig beendet (
51
). Darüber hinaus zeigten Golimumab (TNFα-Inhibitor) und Ustekinumab (ein monoklonaler Antikörper, der sowohl auf IL-12 als auch auf IL-23 abzielt) in einer RCT mit 173 Patienten keine Wirksamkeit bei Patienten mit pulmonaler und/oder kutaner Sarkoidose (
52
). Schließlich hatte Rituximab ein akzeptables Sicherheitsprofil, aber eine uneinheitliche Wirksamkeit in einer kleinen Kohorte von Patienten mit unterschiedlichem genetischem Hintergrund und refraktärer pulmonaler Sarkoidose; daher könnte seine Verwendung durch einen Ansatz der personalisierten Medizin in der Zukunft realisierbar sein (
53
).Tabelle 2
TABELLE 1 . Lungentoxizität von biologischen Behandlungen. Sarkoidose (
Tabelle 2
)Prednisolon bleibt der Eckpfeiler der Behandlung von Sarkoidose (
55
). Biologische Therapien stellen derzeit eine fruchtbare therapeutische Alternative in Sarkoidose-Fällen dar, die gegenüber immunmodulatorischen Mitteln der ersten Wahl, einschließlich Kortikosteroiden, Methotrexat, Azathioprin, Leflunomid und Mycophenolatmofetil, refraktär sind (
56
). TNFα-Inhibitoren in Kombination mit niedrig dosiertem Prednisolon oder Methotrexat wurden vorgeschlagen bei: (i) chronisch fortschreitender Lungenerkrankung, (ii) Schwächung durch Lupus pernio, (iii) anhaltender Neurosarkoidose, (iv) anhaltender kardialer Sarkoidose (
55
). Infliximab hat bei pulmonaler Sarkoidose im Vergleich zu Etanercept und Adalimumab überlegene Ansprechraten gezeigt (
46
,
47
,
50
).
51
,
57
). Insbesondere eine randomisierte kontrollierte Studie (RCT) mit 148 Patienten mit chronischer Lungensarkoidose zeigte, dass Infliximab nach 24 Behandlungswochen zu einer statistisch signifikanten Verbesserung der forcierten Vitalkapazität (FVC%pred) um 2,5 % führte (
46
). Ergebnisse aus anderen nicht-randomisierten Studien waren eher widersprüchlich (
47
,
48
). Leider zeigten fast 2/3 der Patienten mit Sarkoidose, die Infliximab erhielten, einen Rückfall nach dem Absetzen des Arzneimittels (
49
). Adalimumab hat ein akzeptables Verträglichkeits- und Wirksamkeitsprofil gezeigt, wie durch Verbesserungen bei FVC% pred, 6-Minuten-Gehstrecke (6MWD) und Borg-Skala über einen Zeitraum von 52 Wochen in einer kleinen Kohorte von Patienten mit refraktärer pulmonaler Sarkoidose angezeigt wird (
50
). Eine Phase-2-Studie mit Etanercept bei Patienten mit Lungensarkoidose wurde aufgrund ungünstiger Ergebnisse vorzeitig beendet (
51
). Darüber hinaus zeigten Golimumab (TNFα-Inhibitor) und Ustekinumab (ein monoklonaler Antikörper, der sowohl auf IL-12 als auch auf IL-23 abzielt) in einer RCT mit 173 Patienten keine Wirksamkeit bei Patienten mit pulmonaler und/oder kutaner Sarkoidose (
52
). Schließlich hatte Rituximab ein akzeptables Sicherheitsprofil, aber eine uneinheitliche Wirksamkeit in einer kleinen Kohorte von Patienten mit unterschiedlichem genetischem Hintergrund und refraktärer pulmonaler Sarkoidose; daher könnte seine Verwendung durch einen Ansatz der personalisierten Medizin in der Zukunft realisierbar sein (
53
).Tabelle 2
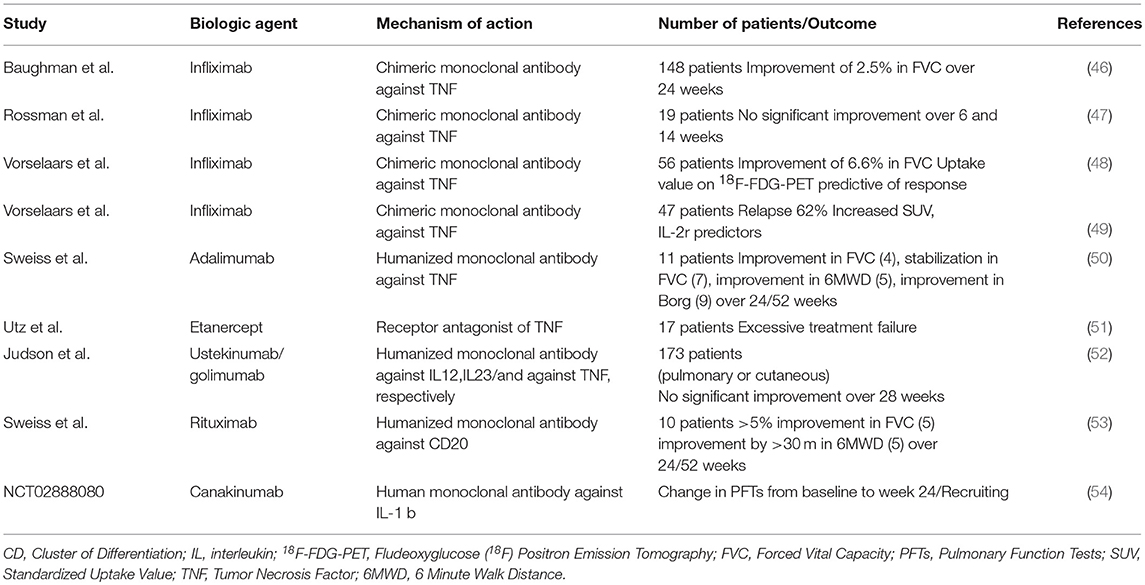 TABELLE 2 . Biologische Behandlungen bei Lungensarkoidose. Erhöhte Spiegel des C-reaktiven Proteins (CRP) und TNFα-Gly308Ala-Polymorphismen haben sich als prädiktiv für das Ansprechen auf eine Anti-TNFα-Therapie erwiesen, während Serumspiegel des löslichen IL-2-Rezeptors von ≥ 4.000 pg·mL −1 zu Beginn der Therapie prädiktiv für einen Rückfall waren (
49
,
58
). Darüber hinaus zeigte 18 8F-FDG-PET eine bemerkenswerte Vorhersagegenauigkeit bei der Identifizierung von Patienten, die auf eine Infliximab-Behandlung ansprachen oder einen Rückfall erlitten (
48
,
49
).Ein breites Spektrum an unerwünschten Ereignissen wurde mit der Anwendung von TNF-α-Inhibitoren in Verbindung gebracht, darunter anaphylaktische Reaktionen, Reaktivierung latenter Infektionen, neurologische (d. h. demyelinisierende Erkrankungen) und Autoimmunerkrankungen und möglicherweise in einigen Fällen Malignität (
55
,
59
,
60
). Die paradoxe Reaktion, die als sarkoidartige Granulomatose bezeichnet wird, wurde ebenfalls berichtet (
61
).Zusammenfassend lässt sich sagen, dass aktuelle Erkenntnisse auf der Grundlage von Expertenmeinungen den Einsatz biologischer Behandlungen bei schwerer refraktärer pulmonaler Sarkoidose nahelegen. TNFα-Hemmer werden bei Patienten mit persistierender Erkrankung trotz Behandlung mit Kortikosteroiden und anderen immunmodulatorischen Zweitlinienpräparaten bevorzugt, insbesondere bei lebensbedrohlichen Erkrankungen. Solche Strategien erfordern jedoch eine gründliche Bewertung vor der Behandlung und multidisziplinäre Ansätze (
12
).Idiopathische Lungenfibrose (
Abbildung 1
,
Tabelle 3
)Die Behandlung von IPF wurde durch das Aufkommen von zwei neuartigen Verbindungen, Pirfenidon und Nintedanib (
3
–
11
), revolutioniert. Dennoch verlangsamen beide Verbindungen nur das Fortschreiten der Krankheit; somit lassen Patienten bestenfalls eine erhebliche funktionelle Behinderung zurück. Daher bleibt der Bedarf an alternativen therapeutischen Optionen offen (
75
–
78
).Abbildung 1
TABELLE 2 . Biologische Behandlungen bei Lungensarkoidose. Erhöhte Spiegel des C-reaktiven Proteins (CRP) und TNFα-Gly308Ala-Polymorphismen haben sich als prädiktiv für das Ansprechen auf eine Anti-TNFα-Therapie erwiesen, während Serumspiegel des löslichen IL-2-Rezeptors von ≥ 4.000 pg·mL −1 zu Beginn der Therapie prädiktiv für einen Rückfall waren (
49
,
58
). Darüber hinaus zeigte 18 8F-FDG-PET eine bemerkenswerte Vorhersagegenauigkeit bei der Identifizierung von Patienten, die auf eine Infliximab-Behandlung ansprachen oder einen Rückfall erlitten (
48
,
49
).Ein breites Spektrum an unerwünschten Ereignissen wurde mit der Anwendung von TNF-α-Inhibitoren in Verbindung gebracht, darunter anaphylaktische Reaktionen, Reaktivierung latenter Infektionen, neurologische (d. h. demyelinisierende Erkrankungen) und Autoimmunerkrankungen und möglicherweise in einigen Fällen Malignität (
55
,
59
,
60
). Die paradoxe Reaktion, die als sarkoidartige Granulomatose bezeichnet wird, wurde ebenfalls berichtet (
61
).Zusammenfassend lässt sich sagen, dass aktuelle Erkenntnisse auf der Grundlage von Expertenmeinungen den Einsatz biologischer Behandlungen bei schwerer refraktärer pulmonaler Sarkoidose nahelegen. TNFα-Hemmer werden bei Patienten mit persistierender Erkrankung trotz Behandlung mit Kortikosteroiden und anderen immunmodulatorischen Zweitlinienpräparaten bevorzugt, insbesondere bei lebensbedrohlichen Erkrankungen. Solche Strategien erfordern jedoch eine gründliche Bewertung vor der Behandlung und multidisziplinäre Ansätze (
12
).Idiopathische Lungenfibrose (
Abbildung 1
,
Tabelle 3
)Die Behandlung von IPF wurde durch das Aufkommen von zwei neuartigen Verbindungen, Pirfenidon und Nintedanib (
3
–
11
), revolutioniert. Dennoch verlangsamen beide Verbindungen nur das Fortschreiten der Krankheit; somit lassen Patienten bestenfalls eine erhebliche funktionelle Behinderung zurück. Daher bleibt der Bedarf an alternativen therapeutischen Optionen offen (
75
–
78
).Abbildung 1
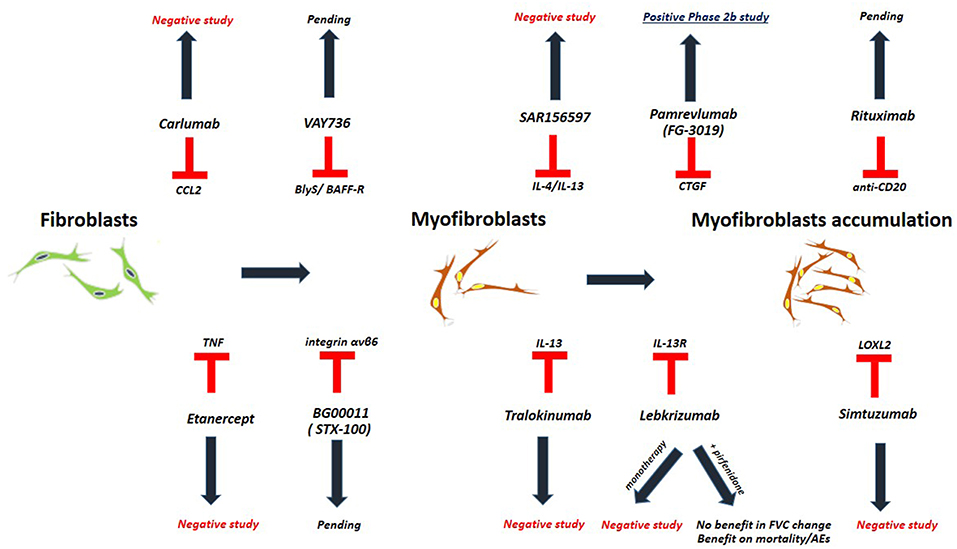 ABBILDUNG 1 . Studien zur Untersuchung biologischer Behandlungen bei Patienten mit IPF. Tisch 3
ABBILDUNG 1 . Studien zur Untersuchung biologischer Behandlungen bei Patienten mit IPF. Tisch 3
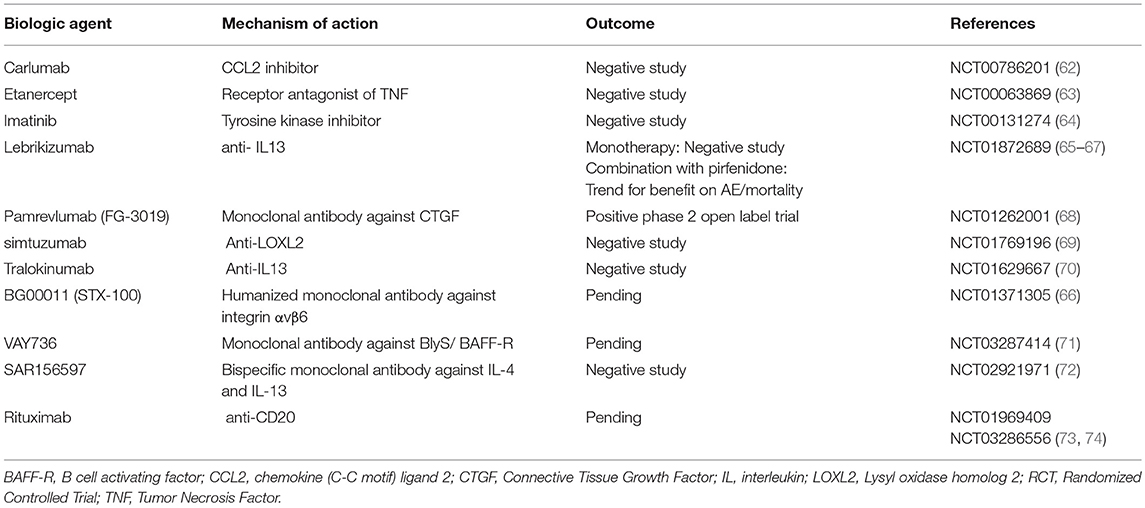 TABELLE 3 . Klinische Studien der Phase 2 für biologische Behandlungen bei Patienten mit IPF. Biologische Wirkstoffe stellen eine solche Option dar, jedoch mit enttäuschenden Ergebnissen. Die klinische Studie mit Carlumab, einem monoklonalen Antikörper gegen CC-Chemokin-Ligand 2 (CCL2), wurde vorzeitig abgebrochen, da bei Patienten im Carlumab-Behandlungsarm im Vergleich zu Patienten im Placebo-Behandlungsarm ein stärkerer funktioneller Rückgang auftrat (
62
). TNFa-Blocker wie Etanercept zeigten keine Wirksamkeit bei Patienten mit IPF (
63
). Imatinib, ein Tyrosinkinase-Inhibitor mit mehreren biologischen Eigenschaften, beeinflusste das Überleben oder die Lungenfunktion von Patienten mit IPF nicht (
64
). Auch die Studie mit Simtuzumab, einem monoklonalen Antikörper gegen Lysyloxidase-like 2 (LOXL2), war eine negative Studie (
69
). Vor kurzem wurden zwei monoklonale Anti-IL-13-Antikörper in die Pipeline klinischer Studien für IPF aufgenommen. Tralokinumab hatte ein akzeptables Sicherheits- und Verträglichkeitsprofil; Dennoch wurden wichtige Wirksamkeitsendpunkte nicht erreicht (
70
). Die Monotherapie mit Lebrikizumab, einem anderen monoklonalen Anti-IL-13-Antikörper, führte über 52 Wochen zu keinem Vorteil hinsichtlich der Lungenfunktion oder Mortalität (
65
). Die Kombination von Lebrikizumab und Pirfenidon wurde gut vertragen, erreichte jedoch nicht den primären Endpunkt der Abnahme der FVC in %; dennoch wurde ein Trend zu positiven Wirkungen auf die Sterblichkeit und akute Exazerbationen beobachtet (
66
,
67
). Darüber hinaus konnte SAR156597, ein monoklonaler bispezifischer Antikörper, der auf IL-4 und IL-13 abzielt, das Fortschreiten der Krankheit weder als Monotherapie noch in Kombination mit standardmäßigen Antifibrotika aufhalten (
72
). Eine offene Phase-2-Studie mit Pamrevlumab (FG-3019), einem monoklonalen Antikörper, der die nachgeschalteten Wirkungen des Bindegewebe-Wachstumsfaktors (CTGF) blockiert, zeigte ein akzeptables Sicherheits- und Wirksamkeitsprofil, und daher wird derzeit eine klinische Phase-III-Studie erwartet (
68
).
79
,
80
). Sicherheit und Wirksamkeit von VAY736, einem monoklonalen Antikörper gegen das Zytokin BlyS, einen B-Zell-Aktivierungsfaktor, wird derzeit ebenfalls in einer Phase-2-Studie getestet (
71
). BG00011 (STX-100), ein humanisierter monoklonaler Antikörper gegen Integrin αvβ6, zeigte ein akzeptables Sicherheitsprofil und seine Wirksamkeit wird derzeit in einer Phase-2b-Studie untersucht (
66
,
81
). Schließlich zeigte Rituximab ± intravenöses Immunglobulin einen 1-Jahres-Überlebensvorteil in einer kleinen Kohorte von Patienten mit IPF, die sich einer akuten Exazerbation unterzogen, im Vergleich zu historischen Kontrollen (
82
). Eine Phase-2-Studie mit Rituximab bei IPF mit dem Ziel, die Titer von Autoantikörpern gegen HEp-2-Zellen über einen Nachbeobachtungszeitraum von 9 Monaten zu reduzieren, wurde kürzlich abgeschlossen (
73
,
83
). Darüber hinaus werden die Ergebnisse der Autoantikörperreduktion bei akuten Exazerbationen von IPF (STRIVE-IPF) mit Spannung erwartet (
74
).Connective Tissue Disease-Associated Interstitial Lung Disease (CTD-ILD) Rheumatoide ArthritisLungenkomplikationen sind ein wichtiges extraartikuläres Merkmal der rheumatoiden Arthritis und eine Hauptursache für Mortalität und Verschlechterung der Lebensqualität (
16
). Die Entscheidung, sie zu behandeln, erfordert einen multidisziplinären Ansatz, der Folgendes abwägt: (i) die Schwere der Erkrankung und den klinischen Status des Patienten, (ii) den potenziellen Nutzen einer frühen Therapie (dh Behandlung der Entzündung, bevor sich eine Fibrose entwickelt) und (iii) das Risiko einer Nebenwirkungen (dh Immunsuppression, insbesondere bei Patienten mit bestehender Fibrose oder schweren bronchiektatischen Läsionen). Angesichts des fehlenden Konsens über klinische Studien basiert das Management derzeit auf Expertenmeinungen. Das kürzliche Auftauchen neuartiger antifibrotischer Verbindungen für die IPF-UIP-Lunge ist vielversprechend für die RA-UIP-Lunge (
84
–
87
) und die erste randomisierte Studie mit Antifibrotika bei RA-ILD (TRAIL-Studie) wird derzeit untersucht (
84
). Zu diesem Zweck können biologische Behandlungen bei einem Teil der Patienten mit refraktärer RA-ILD vorteilhafte Ergebnisse zeigen.Rituximab stellt die am weitesten verbreitete biologische Behandlung bei Patienten mit schnell fortschreitender RA-ILD dar, die nicht auf therapeutische Verbindungen der ersten Wahl, einschließlich Kortikosteroide und Methotrexat, ansprechen (
88
). Leider basiert die Evidenz auf kleinen Beobachtungsstudien und daher sind weitere Daten erforderlich (
89
–
97
). Eine kürzlich durchgeführte prospektive beobachtende Kohortenstudie mit 43 Patienten unter Rituximab und 309 Patienten unter TNF-α-Inhibitoren zeigte ein besseres Langzeitüberleben bei Patienten, die Rituximab erhielten, als bei Patienten, die TNF-α-Inhibitoren erhielten, da die Ereignisraten 53,0 und 94,8 pro 1.000 Personen betrugen Jahren (
98
).Die Anwendung von TNF-α-Inhibitoren führte zu kontroversen Sicherheits- und Wirksamkeitsergebnissen bei Patienten mit RA-ILD. Vorbehalte nach ihrer Verwendung bei CTD-ILD entsprechen denen, die zuvor bei Sarkoidose beschrieben wurden. Trotz ihrer Wirksamkeit bei der Verbesserung des klinischen Zustands und der Verlangsamung des Fortschreitens von Gelenkerkrankungen bleibt die Lungentoxizität ein großes Problem (
99
–
103
). Kleine Fallserien von Patienten mit RA-ILD haben gezeigt, dass Infliximab und Etanercept Dyspnoe und Husten verbessern sowie den Funktionsstatus der Krankheit stabilisieren könnten (
104
–
107
). Andererseits wurden Sicherheitsbedenken für aktuelle TNF-α-Inhibitoren wie Infliximab (
108
–
111
), Etanercept (
112
–
116 ) geäußert
), Adalimumab (
117
–
121
), Golimumab (
90
) und Certolizumab (
37
,
122
,
123
) unter Berücksichtigung von Berichten über ILD-Exazerbation. Wichtig ist, dass TNF-induzierte ILD schnell fortschreiten und sogar tödlich verlaufen kann, insbesondere bei Patienten mit vorbestehender ILD (
34
,
124
–
127
). Nichtsdestotrotz berichteten große Kohorten von Patienten mit RA über keinen Zusammenhang zwischen Anti-TNF-Mitteln und ILD-Entwicklung oder -Progression (
128
,
129
). Bei älteren Patienten ist Vorsicht geboten, da sie eine Hochrisiko- und Gebrechlichkeitsgruppe von Patienten darstellen (
100
).Daten für andere Wirkstoffe wie Abatacept, Tocilizumab und Anakinra sind noch spärlich. Abatacept hat sowohl in großen RCTs (
130
) als auch in kleineren Fallstudien (
45
,
90
,
102
,
131
,
132
) ein akzeptables Sicherheits- und Wirksamkeitsprofil gezeigt, das anhand von Dyspnoe, funktionellen Indikatoren und dem radiologischen Ausmaß der Entzündung beurteilt wurde. Die Anwendung von Tocilizumab führte zu widersprüchlichen Ergebnissen und scheint nur bei einer kleinen Untergruppe von Patienten mit RA-ILD von Vorteil zu sein (
42
,
90
,
102
,
126
,
133
–
137 ).
). Einzelfälle von ILD-Exazerbationen nach Behandlung mit Tocilizumab wurden beschrieben (
138
). Schließlich wird Anakinra, ein IL-1-Rezeptorantagonist, selten, wenn überhaupt, bei der Behandlung von Patienten mit RA-ILD eingesetzt (
126
,
139
).SklerodermieBis vor kurzem galt Cyclophosphamid als Standardbehandlung für systemische Sklerose-assoziierte ILD (SSc-ILD), basierend auf den Ergebnissen der Scleroderma Lung Study (
140
). Zuvor berichtete Daten aus kleinen Studien zeigten jedoch positive Wirkungen von Mycophenolatmofetil bei SSc-ILD (
141
–
143
). Die kürzlich berichtete groß angelegte, randomisierte, doppelblinde Sklerodermie-Lungenstudie II, in der Cyclophosphamid mit Mycophenolatmofetil direkt verglichen wurde, ergab, dass Mycophenolatmofetil genauso wirksam wie Cyclophosphamid war, jedoch ein besseres Sicherheitsprofil aufwies. Somit hat sich Mycophenolatmofetil als aktueller Behandlungsstandard für SSc-ILD etabliert (
144
). Der statistisch signifikante, aber klinisch eher geringe Nutzen aus der Verwendung einer solchen Behandlung zusammen mit der allgemein resistenten Natur von SSc-ILD unterstreicht deutlich die Notwendigkeit für neue Behandlungen. Biologische Wirkstoffe, insbesondere Rituximab, wurden in kleinen Studien bei einer Minderheit von Patienten mit fortschreitender, behandlungsresistenter Erkrankung untersucht (
145
). Die Ergebnisse einer multizentrischen, offenen Vergleichsstudie, in der Rituximab zusätzlich zur Standardbehandlung ( n = 33) im Vergleich zur Standardbehandlung allein ( n= 18) zeigten, dass Patienten in der Rituximab-Gruppe nach 2 Behandlungsjahren einen Anstieg der FVC um 6 % im Vergleich zu den Ausgangswerten aufwiesen, ein Vorteil, der offensichtlich später erhalten blieb; jedoch war die Zahl der Patienten nach 7 Behandlungsjahren zu klein für sichere Schlussfolgerungen (
146
). Der direkte Vergleich zwischen der Rituximab-Gruppe und der Standardbehandlungsgruppe ergab einen statistisch signifikanten Nutzen für die mit Rituximab behandelten Patienten. Andere Studien haben Ergebnisse in die gleiche Richtung berichtet (
19
,
20
,
145
,
147
–
149
). Dennoch sind formelle, multizentrische, groß angelegte Studien eindeutig erforderlich, um den Wert von B-Zell-Depletionsbehandlungen bei Patienten mit SSc-ILD zu bewerten. Eine Phase-III-Studie zur Bewertung der Wirkungen des monoklonalen Anti-IL-6-Rezeptor-Antikörpers Tocilizumab wurde trotz relativ vielversprechender Ergebnisse in den früheren Phasenstudien (
150
,
151
) und den Ergebnissen aus der Verwendung von Belimumab, einem monoklonalen Anti-BLyS-Antikörper, beendet. wurden nur in einer Studie mit einer kleinen Anzahl von Patienten ( n = 9) mit klinisch nicht signifikanter SSc-ILD ausgewertet (
152
).Myositis/Antisynthetase-SyndromILDs stellen eine Haupttodesursache bei Dermatomyositis (DM), Polymyositis (PM) und Antisynthetase-Syndrom dar. Die häufigsten Antikörper bei Patienten mit Myositis-ILD sind Anti-EJ, Anti-PL12, Anti-PL7, Anti-Jo1, Anti-OJ und Anti-KS (
153
). Biologika wurden in Fällen von Myositis-assoziierter ILD eingesetzt, die gegenüber häufiger verwendeten immunmodulatorischen Mitteln wie Kortikosteroiden, Azathioprin und Mycophenolatmofetil refraktär waren (
92
,
153
). Daten aus Fallserien, Fallberichten und retrospektiven Studien deuten auf klinische, funktionelle und radiologische Vorteile von Rituximab bei Patienten mit progressiver ILD in Verbindung mit PM/DM/Antisynthetase-Syndrom hin (
92
,
154
–
161
). Basiliximab, ein monoklonaler Antikörper, der die Alpha-Kette (CD25) des IL-2-Rezeptorkomplexes blockiert, führte zu einer radiologischen und funktionellen Verbesserung in drei von vier Fällen von klinisch amyopathischer Dermatomyositis (CADM) mit Anti-MDA5-Positivität und schnell fortschreitender ILD (
162
). Vor der Anwendung solcher Therapien ist jedoch der Ausschluss anderer Ursachen der Lungenfunktionsverschlechterung wie medikamenteninduzierte Pneumonitis, Superinfektion und Atemmuskelschwäche zwingend erforderlich.Zukunftsperspektiven und Schlussbemerkungen (
Tabelle 3
)ILDs repräsentieren Krankheitsparadigmen mit unbekannter Pathogenese, unvorhersehbarem klinischen Verlauf und relativ ineffektiven therapeutischen Ansätzen. Biologische Therapien können eine wirksame Alternative in progressiven und refraktären Fällen darstellen. Die Früherkennung dieser Patienten ist von größter Bedeutung. Leider liefern aktuelle physiologische Biomarker weder mechanistische Einblicke in Krankheitsendotypen noch sagen sie den klinischen Krankheitsverlauf voraus. Während ILDs mit mehreren zugrunde liegenden Mechanismen assoziiert sind, zielen derzeit angewendete Therapien auf spezifische Signalwege ab, und daher besteht nach wie vor ein Bedarf an neuen Verbindungen. Die Entwicklung von Biologika zur Behandlung von fibrotischen Lungenerkrankungen kann angesichts des Potenzials zur Krankheitsmodulation vielversprechend sein (
163
).Es hat sich gezeigt, dass biologische Wirkstoffe bei schweren refraktären Fällen von Sarkoidose eine große Wirkung haben. Darüber hinaus ist Canakinumab, ein menschlicher monoklonaler Antikörper gegen IL-1 b, in die Pipeline klinischer Studien für Sarkoidose eingetreten, und die Ergebnisse werden mit Spannung erwartet (
54
). Leider haben die meisten biologischen Wirkstoffe bei IPF bisher zu enttäuschenden Ergebnissen geführt, hauptsächlich aufgrund der Tatsache, dass sie auf immunvermittelte Entzündungen und nicht auf Fibrose abzielen. Die Anwendung onkologischer und personalisierter Medizinansätze stellen entscheidende Schritte zur erfolgreichen Implementierung biologischer Wirkstoffe bei Lungenfibrose dar (
164
). Das Aufkommen und die Implementierung von Hochdurchsatz-Computerwerkzeugen könnten Biomarker identifizieren, die in der Lage sind, die Endotypen von Patienten zu unterscheiden und somit die Untergruppe von Patienten vorherzusagen, die mit größerer Wahrscheinlichkeit von spezifischen biologischen Interventionen profitieren (
165
,
166
). Die biologische Anreicherung zukünftiger klinischer Studien und die Implementierung von Biomarkern als Endpunkte könnten einen entscheidenden Einfluss in diese Richtung haben. Eine systematische Vorbehandlungsbewertung für latente Infektionen und Immunschwäche ist obligatorisch vor Beginn der Behandlung, um unerwünschte Nebenwirkungen zu vermeiden. Sorgfältige Überwachung und multidisziplinäre Versorgung mit Rheumatologen und Pneumologen werden dringend empfohlen.
TABELLE 3 . Klinische Studien der Phase 2 für biologische Behandlungen bei Patienten mit IPF. Biologische Wirkstoffe stellen eine solche Option dar, jedoch mit enttäuschenden Ergebnissen. Die klinische Studie mit Carlumab, einem monoklonalen Antikörper gegen CC-Chemokin-Ligand 2 (CCL2), wurde vorzeitig abgebrochen, da bei Patienten im Carlumab-Behandlungsarm im Vergleich zu Patienten im Placebo-Behandlungsarm ein stärkerer funktioneller Rückgang auftrat (
62
). TNFa-Blocker wie Etanercept zeigten keine Wirksamkeit bei Patienten mit IPF (
63
). Imatinib, ein Tyrosinkinase-Inhibitor mit mehreren biologischen Eigenschaften, beeinflusste das Überleben oder die Lungenfunktion von Patienten mit IPF nicht (
64
). Auch die Studie mit Simtuzumab, einem monoklonalen Antikörper gegen Lysyloxidase-like 2 (LOXL2), war eine negative Studie (
69
). Vor kurzem wurden zwei monoklonale Anti-IL-13-Antikörper in die Pipeline klinischer Studien für IPF aufgenommen. Tralokinumab hatte ein akzeptables Sicherheits- und Verträglichkeitsprofil; Dennoch wurden wichtige Wirksamkeitsendpunkte nicht erreicht (
70
). Die Monotherapie mit Lebrikizumab, einem anderen monoklonalen Anti-IL-13-Antikörper, führte über 52 Wochen zu keinem Vorteil hinsichtlich der Lungenfunktion oder Mortalität (
65
). Die Kombination von Lebrikizumab und Pirfenidon wurde gut vertragen, erreichte jedoch nicht den primären Endpunkt der Abnahme der FVC in %; dennoch wurde ein Trend zu positiven Wirkungen auf die Sterblichkeit und akute Exazerbationen beobachtet (
66
,
67
). Darüber hinaus konnte SAR156597, ein monoklonaler bispezifischer Antikörper, der auf IL-4 und IL-13 abzielt, das Fortschreiten der Krankheit weder als Monotherapie noch in Kombination mit standardmäßigen Antifibrotika aufhalten (
72
). Eine offene Phase-2-Studie mit Pamrevlumab (FG-3019), einem monoklonalen Antikörper, der die nachgeschalteten Wirkungen des Bindegewebe-Wachstumsfaktors (CTGF) blockiert, zeigte ein akzeptables Sicherheits- und Wirksamkeitsprofil, und daher wird derzeit eine klinische Phase-III-Studie erwartet (
68
).
79
,
80
). Sicherheit und Wirksamkeit von VAY736, einem monoklonalen Antikörper gegen das Zytokin BlyS, einen B-Zell-Aktivierungsfaktor, wird derzeit ebenfalls in einer Phase-2-Studie getestet (
71
). BG00011 (STX-100), ein humanisierter monoklonaler Antikörper gegen Integrin αvβ6, zeigte ein akzeptables Sicherheitsprofil und seine Wirksamkeit wird derzeit in einer Phase-2b-Studie untersucht (
66
,
81
). Schließlich zeigte Rituximab ± intravenöses Immunglobulin einen 1-Jahres-Überlebensvorteil in einer kleinen Kohorte von Patienten mit IPF, die sich einer akuten Exazerbation unterzogen, im Vergleich zu historischen Kontrollen (
82
). Eine Phase-2-Studie mit Rituximab bei IPF mit dem Ziel, die Titer von Autoantikörpern gegen HEp-2-Zellen über einen Nachbeobachtungszeitraum von 9 Monaten zu reduzieren, wurde kürzlich abgeschlossen (
73
,
83
). Darüber hinaus werden die Ergebnisse der Autoantikörperreduktion bei akuten Exazerbationen von IPF (STRIVE-IPF) mit Spannung erwartet (
74
).Connective Tissue Disease-Associated Interstitial Lung Disease (CTD-ILD) Rheumatoide ArthritisLungenkomplikationen sind ein wichtiges extraartikuläres Merkmal der rheumatoiden Arthritis und eine Hauptursache für Mortalität und Verschlechterung der Lebensqualität (
16
). Die Entscheidung, sie zu behandeln, erfordert einen multidisziplinären Ansatz, der Folgendes abwägt: (i) die Schwere der Erkrankung und den klinischen Status des Patienten, (ii) den potenziellen Nutzen einer frühen Therapie (dh Behandlung der Entzündung, bevor sich eine Fibrose entwickelt) und (iii) das Risiko einer Nebenwirkungen (dh Immunsuppression, insbesondere bei Patienten mit bestehender Fibrose oder schweren bronchiektatischen Läsionen). Angesichts des fehlenden Konsens über klinische Studien basiert das Management derzeit auf Expertenmeinungen. Das kürzliche Auftauchen neuartiger antifibrotischer Verbindungen für die IPF-UIP-Lunge ist vielversprechend für die RA-UIP-Lunge (
84
–
87
) und die erste randomisierte Studie mit Antifibrotika bei RA-ILD (TRAIL-Studie) wird derzeit untersucht (
84
). Zu diesem Zweck können biologische Behandlungen bei einem Teil der Patienten mit refraktärer RA-ILD vorteilhafte Ergebnisse zeigen.Rituximab stellt die am weitesten verbreitete biologische Behandlung bei Patienten mit schnell fortschreitender RA-ILD dar, die nicht auf therapeutische Verbindungen der ersten Wahl, einschließlich Kortikosteroide und Methotrexat, ansprechen (
88
). Leider basiert die Evidenz auf kleinen Beobachtungsstudien und daher sind weitere Daten erforderlich (
89
–
97
). Eine kürzlich durchgeführte prospektive beobachtende Kohortenstudie mit 43 Patienten unter Rituximab und 309 Patienten unter TNF-α-Inhibitoren zeigte ein besseres Langzeitüberleben bei Patienten, die Rituximab erhielten, als bei Patienten, die TNF-α-Inhibitoren erhielten, da die Ereignisraten 53,0 und 94,8 pro 1.000 Personen betrugen Jahren (
98
).Die Anwendung von TNF-α-Inhibitoren führte zu kontroversen Sicherheits- und Wirksamkeitsergebnissen bei Patienten mit RA-ILD. Vorbehalte nach ihrer Verwendung bei CTD-ILD entsprechen denen, die zuvor bei Sarkoidose beschrieben wurden. Trotz ihrer Wirksamkeit bei der Verbesserung des klinischen Zustands und der Verlangsamung des Fortschreitens von Gelenkerkrankungen bleibt die Lungentoxizität ein großes Problem (
99
–
103
). Kleine Fallserien von Patienten mit RA-ILD haben gezeigt, dass Infliximab und Etanercept Dyspnoe und Husten verbessern sowie den Funktionsstatus der Krankheit stabilisieren könnten (
104
–
107
). Andererseits wurden Sicherheitsbedenken für aktuelle TNF-α-Inhibitoren wie Infliximab (
108
–
111
), Etanercept (
112
–
116 ) geäußert
), Adalimumab (
117
–
121
), Golimumab (
90
) und Certolizumab (
37
,
122
,
123
) unter Berücksichtigung von Berichten über ILD-Exazerbation. Wichtig ist, dass TNF-induzierte ILD schnell fortschreiten und sogar tödlich verlaufen kann, insbesondere bei Patienten mit vorbestehender ILD (
34
,
124
–
127
). Nichtsdestotrotz berichteten große Kohorten von Patienten mit RA über keinen Zusammenhang zwischen Anti-TNF-Mitteln und ILD-Entwicklung oder -Progression (
128
,
129
). Bei älteren Patienten ist Vorsicht geboten, da sie eine Hochrisiko- und Gebrechlichkeitsgruppe von Patienten darstellen (
100
).Daten für andere Wirkstoffe wie Abatacept, Tocilizumab und Anakinra sind noch spärlich. Abatacept hat sowohl in großen RCTs (
130
) als auch in kleineren Fallstudien (
45
,
90
,
102
,
131
,
132
) ein akzeptables Sicherheits- und Wirksamkeitsprofil gezeigt, das anhand von Dyspnoe, funktionellen Indikatoren und dem radiologischen Ausmaß der Entzündung beurteilt wurde. Die Anwendung von Tocilizumab führte zu widersprüchlichen Ergebnissen und scheint nur bei einer kleinen Untergruppe von Patienten mit RA-ILD von Vorteil zu sein (
42
,
90
,
102
,
126
,
133
–
137 ).
). Einzelfälle von ILD-Exazerbationen nach Behandlung mit Tocilizumab wurden beschrieben (
138
). Schließlich wird Anakinra, ein IL-1-Rezeptorantagonist, selten, wenn überhaupt, bei der Behandlung von Patienten mit RA-ILD eingesetzt (
126
,
139
).SklerodermieBis vor kurzem galt Cyclophosphamid als Standardbehandlung für systemische Sklerose-assoziierte ILD (SSc-ILD), basierend auf den Ergebnissen der Scleroderma Lung Study (
140
). Zuvor berichtete Daten aus kleinen Studien zeigten jedoch positive Wirkungen von Mycophenolatmofetil bei SSc-ILD (
141
–
143
). Die kürzlich berichtete groß angelegte, randomisierte, doppelblinde Sklerodermie-Lungenstudie II, in der Cyclophosphamid mit Mycophenolatmofetil direkt verglichen wurde, ergab, dass Mycophenolatmofetil genauso wirksam wie Cyclophosphamid war, jedoch ein besseres Sicherheitsprofil aufwies. Somit hat sich Mycophenolatmofetil als aktueller Behandlungsstandard für SSc-ILD etabliert (
144
). Der statistisch signifikante, aber klinisch eher geringe Nutzen aus der Verwendung einer solchen Behandlung zusammen mit der allgemein resistenten Natur von SSc-ILD unterstreicht deutlich die Notwendigkeit für neue Behandlungen. Biologische Wirkstoffe, insbesondere Rituximab, wurden in kleinen Studien bei einer Minderheit von Patienten mit fortschreitender, behandlungsresistenter Erkrankung untersucht (
145
). Die Ergebnisse einer multizentrischen, offenen Vergleichsstudie, in der Rituximab zusätzlich zur Standardbehandlung ( n = 33) im Vergleich zur Standardbehandlung allein ( n= 18) zeigten, dass Patienten in der Rituximab-Gruppe nach 2 Behandlungsjahren einen Anstieg der FVC um 6 % im Vergleich zu den Ausgangswerten aufwiesen, ein Vorteil, der offensichtlich später erhalten blieb; jedoch war die Zahl der Patienten nach 7 Behandlungsjahren zu klein für sichere Schlussfolgerungen (
146
). Der direkte Vergleich zwischen der Rituximab-Gruppe und der Standardbehandlungsgruppe ergab einen statistisch signifikanten Nutzen für die mit Rituximab behandelten Patienten. Andere Studien haben Ergebnisse in die gleiche Richtung berichtet (
19
,
20
,
145
,
147
–
149
). Dennoch sind formelle, multizentrische, groß angelegte Studien eindeutig erforderlich, um den Wert von B-Zell-Depletionsbehandlungen bei Patienten mit SSc-ILD zu bewerten. Eine Phase-III-Studie zur Bewertung der Wirkungen des monoklonalen Anti-IL-6-Rezeptor-Antikörpers Tocilizumab wurde trotz relativ vielversprechender Ergebnisse in den früheren Phasenstudien (
150
,
151
) und den Ergebnissen aus der Verwendung von Belimumab, einem monoklonalen Anti-BLyS-Antikörper, beendet. wurden nur in einer Studie mit einer kleinen Anzahl von Patienten ( n = 9) mit klinisch nicht signifikanter SSc-ILD ausgewertet (
152
).Myositis/Antisynthetase-SyndromILDs stellen eine Haupttodesursache bei Dermatomyositis (DM), Polymyositis (PM) und Antisynthetase-Syndrom dar. Die häufigsten Antikörper bei Patienten mit Myositis-ILD sind Anti-EJ, Anti-PL12, Anti-PL7, Anti-Jo1, Anti-OJ und Anti-KS (
153
). Biologika wurden in Fällen von Myositis-assoziierter ILD eingesetzt, die gegenüber häufiger verwendeten immunmodulatorischen Mitteln wie Kortikosteroiden, Azathioprin und Mycophenolatmofetil refraktär waren (
92
,
153
). Daten aus Fallserien, Fallberichten und retrospektiven Studien deuten auf klinische, funktionelle und radiologische Vorteile von Rituximab bei Patienten mit progressiver ILD in Verbindung mit PM/DM/Antisynthetase-Syndrom hin (
92
,
154
–
161
). Basiliximab, ein monoklonaler Antikörper, der die Alpha-Kette (CD25) des IL-2-Rezeptorkomplexes blockiert, führte zu einer radiologischen und funktionellen Verbesserung in drei von vier Fällen von klinisch amyopathischer Dermatomyositis (CADM) mit Anti-MDA5-Positivität und schnell fortschreitender ILD (
162
). Vor der Anwendung solcher Therapien ist jedoch der Ausschluss anderer Ursachen der Lungenfunktionsverschlechterung wie medikamenteninduzierte Pneumonitis, Superinfektion und Atemmuskelschwäche zwingend erforderlich.Zukunftsperspektiven und Schlussbemerkungen (
Tabelle 3
)ILDs repräsentieren Krankheitsparadigmen mit unbekannter Pathogenese, unvorhersehbarem klinischen Verlauf und relativ ineffektiven therapeutischen Ansätzen. Biologische Therapien können eine wirksame Alternative in progressiven und refraktären Fällen darstellen. Die Früherkennung dieser Patienten ist von größter Bedeutung. Leider liefern aktuelle physiologische Biomarker weder mechanistische Einblicke in Krankheitsendotypen noch sagen sie den klinischen Krankheitsverlauf voraus. Während ILDs mit mehreren zugrunde liegenden Mechanismen assoziiert sind, zielen derzeit angewendete Therapien auf spezifische Signalwege ab, und daher besteht nach wie vor ein Bedarf an neuen Verbindungen. Die Entwicklung von Biologika zur Behandlung von fibrotischen Lungenerkrankungen kann angesichts des Potenzials zur Krankheitsmodulation vielversprechend sein (
163
).Es hat sich gezeigt, dass biologische Wirkstoffe bei schweren refraktären Fällen von Sarkoidose eine große Wirkung haben. Darüber hinaus ist Canakinumab, ein menschlicher monoklonaler Antikörper gegen IL-1 b, in die Pipeline klinischer Studien für Sarkoidose eingetreten, und die Ergebnisse werden mit Spannung erwartet (
54
). Leider haben die meisten biologischen Wirkstoffe bei IPF bisher zu enttäuschenden Ergebnissen geführt, hauptsächlich aufgrund der Tatsache, dass sie auf immunvermittelte Entzündungen und nicht auf Fibrose abzielen. Die Anwendung onkologischer und personalisierter Medizinansätze stellen entscheidende Schritte zur erfolgreichen Implementierung biologischer Wirkstoffe bei Lungenfibrose dar (
164
). Das Aufkommen und die Implementierung von Hochdurchsatz-Computerwerkzeugen könnten Biomarker identifizieren, die in der Lage sind, die Endotypen von Patienten zu unterscheiden und somit die Untergruppe von Patienten vorherzusagen, die mit größerer Wahrscheinlichkeit von spezifischen biologischen Interventionen profitieren (
165
,
166
). Die biologische Anreicherung zukünftiger klinischer Studien und die Implementierung von Biomarkern als Endpunkte könnten einen entscheidenden Einfluss in diese Richtung haben. Eine systematische Vorbehandlungsbewertung für latente Infektionen und Immunschwäche ist obligatorisch vor Beginn der Behandlung, um unerwünschte Nebenwirkungen zu vermeiden. Sorgfältige Überwachung und multidisziplinäre Versorgung mit Rheumatologen und Pneumologen werden dringend empfohlen.




OMNIA TEMPUS HABENT
Diagnose IPAH im Februar 2013, in Behandlung bei OA Dr. Ulrich Krüger, jetzt Dr. Fischer Herzzentrum Duisburg, Medikamente: Sildenafil, Bosentan jetzt Macitentan, Subkutane Treprostinilpumpe, seit Januar 2024 getunnelter ZVK mit externer Pumpe (Groshongkatheter), 24/7 Sauerstoff, Marcumar, Diuretika
Bitte Anmelden oder Registrieren um der Konversation beizutreten.
