- Beiträge: 1727
Sidebar
PH, Fallbeispiele, Hintergründe
13 Mai 2022 22:44 - 13 Mai 2022 23:02 #1462
von danny
OMNIA TEMPUS HABENT
Diagnose IPAH im Februar 2013, in Behandlung bei OA Dr. Ulrich Krüger, jetzt Dr. Fischer Herzzentrum Duisburg, Medikamente: Sildenafil, Bosentan jetzt Macitentan, Subkutane Treprostinilpumpe, seit Januar 2024 getunnelter ZVK mit externer Pumpe (Groshongkatheter), 24/7 Sauerstoff, Marcumar, Diuretika
PH, Fallbeispiele, Hintergründe wurde erstellt von danny
www.rcpe.ac.uk/college/journal/pulmonary...-specialistPulmonale Hypertonie für den Laien Autor(en): Harrison Stubbs 1 , Martin Johnson 2Autorenverbindungen: 1 Pulmonary Vascular Fellow, 2 Respiratory and Pulmonary Vascular Consultant, Scottish Pulmonary Vascular Unit, Golden Jubilee National Hospital, Glasgow, UKKorrespondenz: Harrison Stubbs, Scottish Pulmonary Vascular Unit, Golden Jubilee National Hospital, Agamemnon St, Glasgow G81 4DY, UKE- Mail: Diese E-Mail-Adresse ist vor Spambots geschützt! Zur Anzeige muss JavaScript eingeschaltet sein!Zeitschriftenausgabe: Band 51: Ausgabe 4: 2021Papier zitieren als: JR Coll Physicians Edinb 2021; 51: 392–401
Format
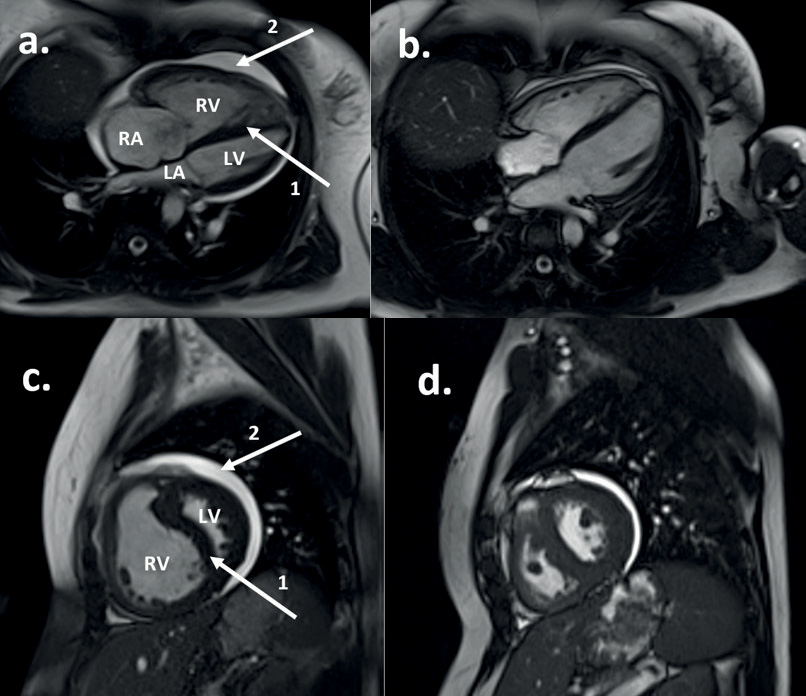
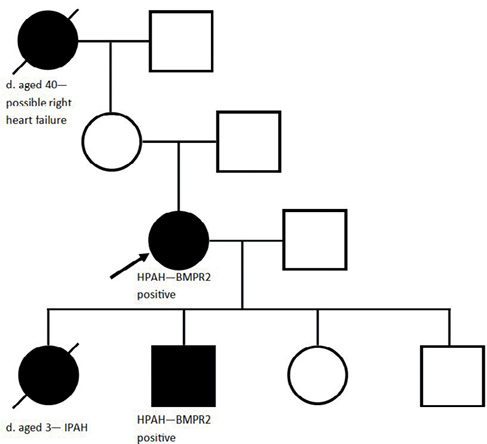
Pulmonale Hypertonie ist eine seltene und komplexe Erkrankung, die aus einer Vielzahl von Grunderkrankungen entsteht. Die therapeutischen Möglichkeiten haben sich in den letzten zwei Jahrzehnten enorm erweitert, was zu erheblichen Verbesserungen der Prognose für einige Patienten geführt hat. Daher ist es wichtig, dass die Krankheit frühzeitig erkannt und zur weiteren Untersuchung und endgültigen Diagnose an spezialisierte Zentren überwiesen wird, um die Prognose bei diesem lebensverändernden Zustand zu verbessern. Leider ist es in Großbritannien immer noch so, dass die Diagnose der pulmonalen Hypertonie verzögert wird, oft Monate oder Jahre nach dem Auftreten der Symptome. Diese Übersicht zielt darauf ab, die wichtigsten Punkte bei der anfänglichen Behandlung und Überweisung von Patienten mit Verdacht auf pulmonale Hypertonie hervorzuheben, und stellt drei Fälle vor, um diese Bereiche zu unterstreichen.EinführungEine pulmonale Hypertonie (PH) liegt vor, wenn der mittlere pulmonalarterielle Druck (mPAP) ≥ 25 mmHg beträgt, gemessen während der Rechtsherzkatheterisierung (RHC). 1 Dies ist ein relativ willkürlicher Grenzwert, der ursprünglich gewählt wurde, um eine Überdiagnose und Behandlung zu verhindern. Im Jahr 2018 wurde ein überarbeiteter Schwellenwert von 20 mmHg vorgeschlagen, um PH zu definieren. Dies berücksichtigt eine systematische Überprüfung der mPAP-Bereiche für gesunde Personen, wobei ≥ 20 mmHg mehr als zwei Standardabweichungen über dem Bevölkerungsmittel entspricht. 2Klinische EinordnungPH wird in fünf klinische Gruppen mit ähnlicher Pathophysiologie, Hämodynamik und Ansprechen auf die Behandlung innerhalb jeder Gruppe eingeteilt. Diese sind in Tabelle 1 zusammengefasst.Tabelle 1 Klinische und hämodynamische Klassifikation der pulmonalen Hypertonie 2GruppeUntergruppePVR (WU)PAWP (mmHg)Gruppe IPulmonale arterielle Hypertonie (PAH)Idiopathisch (IPAH)Erblich (HPAH)Drogen- und Toxin-induziertBindegewebserkrankung (CTD-PAH)Portale Hypertonie (Portopulmonal, PoPAH)Angeborene Herzfehler (CHD-PAH)Lungenvenenverschlusskrankheit (PVOD)Andere: HIV, Bilharziose, persistierende PH des Neugeborenen≥3≤15Gruppe IILinksherzkrankheit (PH-LHD)Herzinsuffizienz mit erhaltener linksventrikulärer Ejektionsfraktion (HFpEF)Herzinsuffizienz mit reduzierter linksventrikulärer Ejektionsfraktion (HFrEF)HerzklappenerkrankungenIsolierte Postkapillare≤3>15Kombiniert Prä- und Postkapillare≥3>15 Gruppe IIILungenerkrankung und/oder HypoxieRestriktive LungenerkrankungObstruktive LungenerkrankungHypoxie ohne Lungenerkrankung ≥3≤15Gruppe IVPulmonale arterielle ObstruktionChronisch thromboembolische pulmonale Hypertonie (CTEPH)Andere Obstruktionen der Lungenarterie ≥3≤15Gruppe VMultifaktorielle oder unklare UrsachenHämatologische ErkrankungenSystemische und metabolische StörungenKomplexer angeborener Herzfehler ≥3≤15 Wie in Fall 1 gezeigt, ist die pulmonale arterielle Hypertonie (PAH, Gruppe I) eine primäre pulmonale Vaskulopathie, bei der ein Anstieg des pulmonalen Gefäßwiderstands (PVR) zu einer fortschreitenden rechtsventrikulären Belastung und einem Versagen führt. 3 PH aufgrund einer Linksherzerkrankung (LHD, Gruppe II) wird bei RHC durch einen pulmonalarteriellen Keildruck (PAWP) > 15 mmHg definiert und entsteht durch einen Anstieg des linksatrialen Drucks aufgrund einer zugrunde liegenden LHD. 4 PH aufgrund von Lungenerkrankungen und/oder Hypoxie (Gruppe III) tritt aufgrund von Mechanismen wie hypoxischer Vasokonstriktion und Obliteration des Lungengefäßbetts auf. 5PH als Folge einer Pulmonalarterienobstruktion (Gruppe IV) besteht hauptsächlich aus chronischer thromboembolischer pulmonaler Hypertonie (CTEPH). Dies wird durch die Nichtauflösung und Organisation von thromboembolischem Material nach einer Lungenembolie (LE) verursacht und ist bemerkenswert für die potenziell kurativen chirurgischen Behandlungsoptionen, die zur Verfügung stehen. 6 Gruppe V umfasst eine Mischung von Krankheiten mit multifaktoriellen oder unklaren Mechanismen. 2PH kann auch durch den Ort des Krankheitsprozesses in Bezug auf das pulmonale Gefäßkapillarbett definiert werden, wo die Gruppen I, III, IV und V typischerweise präkapillär auftreten. 2 Die Gruppen II und V können als isolierte postkapilläre (IpcPH) ohne intrinsische Erhöhung des PVR oder als kombinierte post- und präkapilläre (CpcPH) mit erhöhtem PVR vorliegen. 4Epidemiologie96 % der PH in Europa sind auf Linksherz- oder chronische Lungenerkrankungen zurückzuführen. 7 Im Vereinigten Königreich sind etwa 48–55 Personen pro Million (ppm) von PAH betroffen, mit einer Inzidenz von 6 ppm pro Jahr. Es wird anerkannt, dass die Inzidenz von CTEPH mit 3–6 ppm pro Jahr bei einer Prävalenz von 26–38 ppm zu wenig gemeldet wird. 8–10 Weltweit können die Ursachen von PH sehr unterschiedlich sein, wobei Fälle von PH im Zusammenhang mit Sichelzellenanämie und Infektionskrankheiten (HIV, Schistosomiasis, rheumatische Herzkrankheit nach Streptococcus ) häufiger in Ländern vorkommen, in denen diese noch endemisch sind. 7Im Vereinigten Königreich beträgt das Durchschnittsalter bei der Diagnose einer idiopathischen pulmonalen arteriellen Hypertonie (IPAH) 60 Jahre, und 37,7 % der IPAH-Patienten sind männlich. 11 In den letzten 20 Jahren sind neu diagnostizierte Patienten mit PAH mit größerer Wahrscheinlichkeit älter und haben mehrere Komorbiditäten, was die zunehmende Anerkennung von PH bei älteren Patienten und ihre Weiterverweisung widerspiegelt. 12,13PrognoseWährend PH eine fortschreitende und lebensbegrenzende Erkrankung bleibt, variiert die Prognose je nach Ätiologie und verfügbaren Behandlungen erheblich. 11 Im Vereinigten Königreich beträgt die 5-Jahres-Überlebensrate für Gruppe II 45 % und für Gruppe III 23 %. Allerdings haben sich die 5-Jahres-Überlebensraten für jüngere Patienten (18–53 Jahre) mit PAH im letzten Jahrzehnt von 74 % auf 83–85 % verbessert, und Patienten mit CTEPH, die sich einer chirurgischen Behandlung unterziehen, haben eine 5-Jahres-Überlebensrate von 85 %. 11,12 Bei PAH-Patienten, die auf eine Vasoreaktivitätsprovokation ansprechen und mit Calciumkanalblockern behandelt werden, schränkt PH ihre Lebenserwartung möglicherweise nicht ein.PathophysiologieBei Patienten mit PAH führen Umbau und Obstruktion der Lungengefäße zu einem erhöhten PVR. Wenn die Nachlast des rechten Ventrikels (RV) zunimmt, entwickelt sich eine Belastung des rechten Herzens mit Drucküberlastung, was dazu führt, dass der RV von einem Niederdruck- zu einem Hochdrucksystem umgestaltet wird. Als Reaktion auf die nachfolgende Volumenüberlastung erweitert sich der RV, um das Schlagvolumen aufrechtzuerhalten, und es entwickelt sich eine funktionelle Trikuspidalinsuffizienz (TR). Schließlich wird der RV dekompensieren, was zur Entwicklung einer Rechtsherzinsuffizienz führt. 14,15Abbildung 1 (a, c) zeigt Merkmale der RV-Dekompensation in einem Magnetresonanzbild des Herzens.Abbildung 1 Kardiales Magnetresonanzbild eines Patienten mit IPAH (siehe Fall 1), vor (a und c) und nach (b und d) der Behandlung mit einer krankheitsgerichteten Therapie. Die Tafeln (a) und (b) zeigen die Vierkammer-Querebene; (c) und (d) zeigen die Zweikammer-Sagittalebene. Die Felder (a) und (c) zeigen das Herz in der Enddiastole mit einem vergrößerten RV, der eine Kompression des LV mit Septumdeviation verursacht (Pfeil 1). Pfeil 2 bezeichnet einen Perikarderguss. Die Felder (b) und (d) zeigen enddiastolische Ansichten desselben Patienten nach der Behandlung, was auf eine Gesamtreduktion der Herzgröße, eine Verbesserung des Perikardergusses und eine Normalisierung der RV-Größe hinweist.
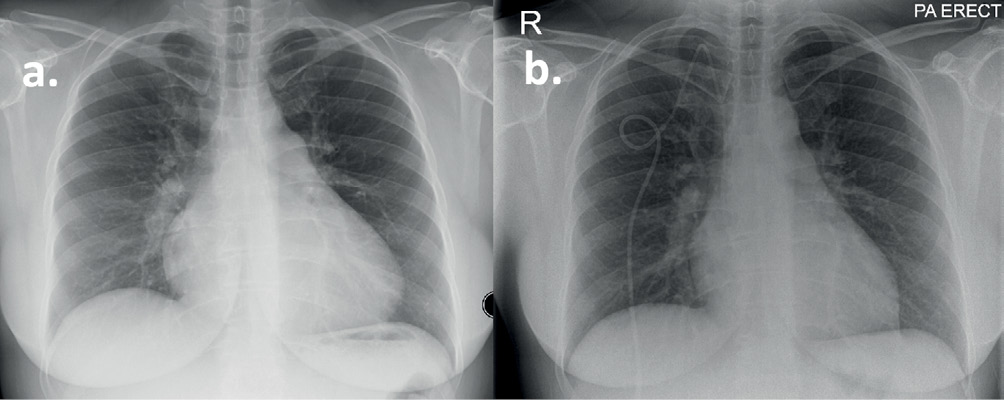
Fall 1Eine 35-jährige Frau stellte sich nach einer Präsynkopen-Episode nach der Anwendung von Cyclizin gegen Übelkeit vor. Bei weiteren Befragungen litt sie seit einem Jahr an Atemnot bei Anstrengung und hatte kürzlich zwei synkopische Episoden erlebt. Transthorakales Echokardiogramm (TTE), das einen erhöhten systolischen Pulmonalarteriendruck (sPAP) von 134 mmHg und einen erweiterten und beeinträchtigten RV zeigte. Computertomographie-Lungenangiographie (CTPA) berichtete, dass sie eine bilaterale Lungenembolie mit Rechtsherzdilatation zeigt. Sie wurde mit Warfarin behandelt und anschließend entlassen. Trotz Antikoagulation schritten ihre Symptome fort und sie entwickelte Brustschmerzen bei Belastung und eine Verschlechterung der Präsynkope, was zu einer erneuten Aufnahme und Verlegung in die Scottish Pulmonary Vascular Unit (SPVU) mit einer vorläufigen Diagnose von CTEPH führte. Spirometrie wurde beibehalten, DLCO (Transferfaktor für Kohlenmonoxid) war um 53 % des Sollwerts reduziert, NTproBNP war nicht erhöht. Sie ging 426 m bei einem Sechs-Minuten-Gehtest (6 MWT) und war leicht entsättigt zu einem SpO2von 94 %. RHC zeigte einen erhöhten mPAP von 71 mmHg, einen normalen PAWP von 9 mmHg und einen erhöhten PVR von 17,2 Wood-Einheiten (WU). Die radiologische Überprüfung des anfänglichen CTPA stimmte nicht mit der Diagnose einer akuten LE überein, und das Lungenangiogramm, das Magnetresonanz-Lungenangiogramm (MRPA) und das wiederholte CTPA zeigten auch keine Merkmale einer chronischen oder akuten pulmonalen thromboembolischen Erkrankung. Aufgrund des Fehlens einer zugrunde liegenden Ätiologie wurde ihre Diagnose auf IPAH geändert. Aufgrund der Vorgeschichte synkopaler Episoden wurde bei ihr eine krankheitsgerichtete Dreifachtherapie mit i.v. Epoprostenol, Sildenafil und Macitentan begonnen. Sie hatte danach eine deutliche Verbesserung ihrer Symptome, ist wieder arbeitsfähig und gehört jetzt der Funktionsklasse I der Weltgesundheitsorganisation (WHO FC) an. Nach sechsjähriger Behandlung mit i.v. Epoprostenol entwickelte sie eine Hickman-Linien-Infektion Aufforderung zur Überprüfung ihrer Therapien. Das i.v. Epoprostenol wurde durch orales Selexipag ohne Anzeichen einer Verschlechterung ersetzt (Abbildungen 1 und 2).Abbildung 2 Röntgen-Thorax eines Patienten mit IPAH (siehe Fall 1). (a) Postero-anteriore Projektion bei der Diagnose, die eine Kardiomegalie und erweiterte Pulmonalarterien zeigt. (b) Nach sechsjähriger Behandlung mit einer krankheitsgerichteten Dreifachtherapie, die einen rechtsseitigen zentralvenösen Tunnelkatheter zur Verabreichung von Epoprostenol und eine Verbesserung der Herzgröße zeigt.
Klinische UntersuchungNach wie vor werden Patienten mit PH erst spät im Krankheitsverlauf diagnostiziert (Kasten 1). 16–18 Um die Diagnose zu erleichtern, sind grundlegende Kenntnisse des Zustands und ein Verdachtsindex erforderlich. Tabelle 2 zeigt, wie sich Patienten mit PH bei einer Vielzahl von Fachgebieten der Sekundärversorgung vorstellen können.Box 1 Warum gibt es eine Verzögerung bei der Diagnose von PH?
- Unspezifische frühe Symptome und Anzeichen
- Symptome und Anzeichen werden häufigeren Komorbiditäten zugeschrieben
- Seltener Zustand und daher ein niedriger Verdachtsindex
- Komplexer Präsentationsweg, der kardiologische, respiratorische oder andere Fachgebiete umfassen kann
- Mangelndes Bewusstsein für Überweisungswege, Richtlinien und tertiäre Zentren
- Keine wirksamen Screening-Strategien bei den meisten Erkrankungen, die PH verursachen, z. B. IPAH, chronische Herzerkrankungen, Lebererkrankungen
- Screening nicht durchgeführt, z. B. postpulmonale Embolie, Bindegewebserkrankung, genetisches Screening
- (A) Ventrikel: RV:LV Basaldurchmesser > 1,0, Abflachung des intraventrikulären Septums
- (
 Pulmonalarterie: Pulmonalklappenbeschleunigungszeit < 105 ms, Pulmonalarteriendurchmesser > 25 mm, frühdiastolische Lungeninsuffizienzgeschwindigkeit > 2,2 m/s
Pulmonalarterie: Pulmonalklappenbeschleunigungszeit < 105 ms, Pulmonalarteriendurchmesser > 25 mm, frühdiastolische Lungeninsuffizienzgeschwindigkeit > 2,2 m/s - (C) Untere Hohlvene und rechter Vorhof: verringerter inspiratorischer Kollaps der unteren Hohlvene, vergrößerter rechter Vorhof
OMNIA TEMPUS HABENT
Diagnose IPAH im Februar 2013, in Behandlung bei OA Dr. Ulrich Krüger, jetzt Dr. Fischer Herzzentrum Duisburg, Medikamente: Sildenafil, Bosentan jetzt Macitentan, Subkutane Treprostinilpumpe, seit Januar 2024 getunnelter ZVK mit externer Pumpe (Groshongkatheter), 24/7 Sauerstoff, Marcumar, Diuretika
Letzte Änderung: 13 Mai 2022 23:02 von danny.
Bitte Anmelden oder Registrieren um der Konversation beizutreten.